首次進入人體臨牀!“基因鹼基編輯”能徹底預防心臟病?_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。2022-07-30 21:32
VERVE-101的最大賣點,是號稱能在預防心血管疾病上“一勞永逸”。
撰文 | 凌駿
來源 | “醫學界”公眾號
通過從分子層面對人體特定遺傳密碼進行“改造”,基因編輯技術的問世似乎為人類戰勝疾病帶了無限可能。
7月12日,美國生物技術公司Verve Therapeutics宣佈,其開發的鹼基編輯療法VERVE-101在新西蘭完成首例患者給藥。這是全球首個開展的體內鹼基編輯臨牀試驗,與目前已存的各類療法不同,它聲稱能一勞永逸地預防心血管疾病。
該療法從原理上並不難理解:通過基因編輯技術,直接關閉人類的一個“壞基因”,從根源上消除致病因素。早在3年前,該公司創始人之一Sekar Kathiresan博士就高調宣稱:如果被證明安全有效,它就是預防和治療心臟病的答案。

可能改變“遊戲規則”的基因編輯
低密度脂蛋白膽固醇(LDL-C)是體檢中常見的指標,被人們稱為“壞膽固醇”,是動脈粥樣硬化性心血管疾病(ASCVD)的重要誘發因素。
據估計,近40%的美國成年人有LDL-C水平升高的問題,這會導致血管阻塞,並可能引起心臟病發作、中風或心力衰竭。
正常情況下,低密度脂蛋白受體(LDL-R)會和低密度脂蛋白(LDL)結合,將其運輸到肝臟降解,避免LDL-C水平過高。但人類有一種名為PCSK9的基因,它能表達出PCSK9蛋白,與肝臟內的LDL-R結合,使其降解。
通俗地解釋,LDL-C是心血管疾病重要的危險因素之一,LDL-R則是對付它的天然武器,但現在PCSK9蛋白把“武器”給毀了。而最新開發的VERVE-101鹼基編輯療法,就是要消滅PCSK9基因。
之所以號稱“一勞永逸”,是因為目前的藥物都只能控制“血脂”,需長期、定期使用,除了療效外,還存在嚴重的患者對藥物依從性問題。“但VERVE-101則可能徹底改變遊戲規則,將傳統的慢性護理模式轉變為單療程、終生的治療解決方案。”Kathiresan博士稱。
VERVE-101使用的是鹼基編輯療法技術。
在傳統的基因編輯領域,CRISPR/Cas9基因編輯通過準確切割DNA雙鏈,先剔除一段“不想要”的基因序列,再依靠細胞的自身修復機制來修正基因,從而完成“治療”過程。但DNA雙鏈的斷裂,可能導致基因編輯後的細胞出現不可預期的結果。
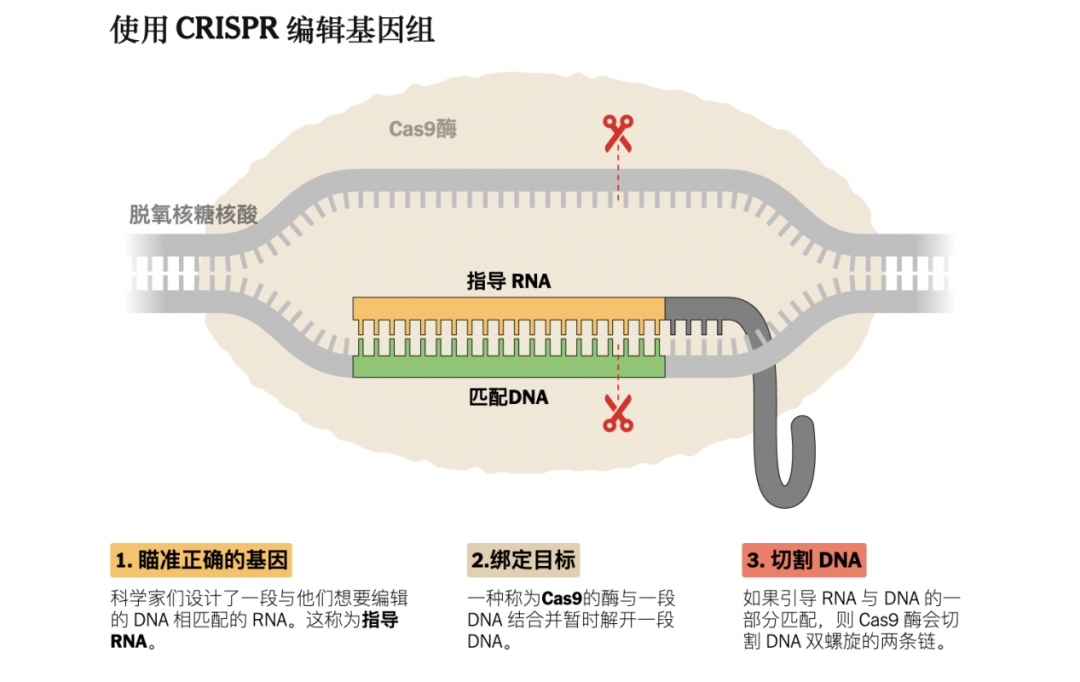
圖源:紐約時報
在此基礎上,鹼基編輯技術誕生。相較於“大刀闊斧”切斷DNA雙鏈,鹼基編輯能精準地將單個核苷酸轉化為另一個核苷酸,從而完成DNA的編輯任務。
從“剔除一段基因序列”到“修改單個DNA字母”,VERVE-101鹼基編輯療法將PCSK9基因序列中的單個鹼基“A”換成了“G”,永久性地讓這個“壞基因”失活。2021年發佈的臨牀前動物實驗顯示,單次VERVE-101給藥,可將“壞膽固醇”水平降低60%,安全性良好,且至今仍保持穩定。
在本月新開展的人體臨牀試驗中,VERVE-101的目標對象是雜合子家族性高膽固醇血癥(HeFH)患者,由於基因突變,他們的膽固醇水平往往是普通人的兩倍,也是心血管疾病的高危人羣。
但該公司相信,一旦初步試驗成功,未來可編輯的靶基因種類會進一步鋪開,包括全球3100萬遺傳性ASCVD患者,同樣技術最終可以用於數以億計的人,保護他們免於心臟病發作。
據相關數據顯示,我國每年死於ASCVD的人數約240萬,約佔總心血管死亡的61%。
編輯生命的“天書”
基因編輯技術最早可追溯至上世紀80年代。
當時,微生物學家在細菌體內發現了一段特殊的DNA片段,後被稱為CRISPR。在和病毒的鬥爭史中,細菌進化出CRISPR-Cas9系統,能把入侵的病毒基因從自己的基因組上切除。
進入20世紀,美國科學家Doudna和法國科學家Charpentier在研究CRISPR時意識到,這一系統的工作原理,或許能讓她們精準地剪切出一段選定的DNA序列。
2012年6月,兩位學者在《科學》期刊發表了人類歷史上里程碑式的論文:《適應性細菌免疫中可編程、雙RNA引導的DNA核酸內切酶》,基因編輯的大門被徹底打開,她們也因此獲得了2020年諾貝爾化學獎。
如今,以癌症研究為例,基因編輯技術能系統地改變癌細胞中的每一個基因,讓科學家們調查到底哪些基因與癌症發生有關。
血液疾病領域,研究人員用CRISPR剪掉了關閉胎兒血紅蛋白基因的“開關”,它們因此可發育成富含血紅蛋白的紅細胞。今年最新公佈的臨牀試驗結果顯示,44名接受基因編輯治療的β型地中海貧血患者中,有42人不再需要定期輸血。
圖源:醫藥魔方
但如前文所述,“剪掉”DNA雙鏈存在未知的安全隱患。在此基礎上,2016年美國華裔科學家劉如謙與團隊開發出了單鹼基編輯器,可將G·C鹼基對轉換成T·A鹼基對。2017年,又實現了A·T與G·C的兑換。
在不依賴DNA雙鏈斷裂的情況下,即可實現單個鹼基的定向修改,如果説CRISPR-Cas9是“剪刀”,那鹼基編輯則是“橡皮”,劉如謙也因此被Nature評為“2017年影響世界十大科學人物”。2019年,劉如謙和團隊在一篇論文中表示,鹼基編輯技術,理論上可修復超6.5萬種已知的致病性人類遺傳變異。
值得一提的是,此次VERVE-101進入體內用的遞送技術,與新冠病毒mRNA疫苗相同,都是用了脂質納米顆粒(LNP)載體。2020年,mRNA疫苗獲得批並投入全球大規模使用,極大推動了LNP技術的發展和成熟。
“一個新的希望”
近年來,基因編輯技術在醫學領域的發展如火如荼,但大多均針對罕見、或暫無有效療法的遺傳性疾病。而VERVE-101被譽為“新的里程碑”,也因為它以常見的心血管疾病為目標病種,被認為是基因編輯治療邁向“普世化”的關鍵一步。
但周鵬教授對“醫學界”分析,總體來看,目前VERVE-101的“前沿概念性”要高於實際價值。這種擔憂與目前不少海外學者對VERVE-101的看法一致。
據周鵬介紹,控制血脂,傳統的廉價他汀類藥物具有非常高的性價比。即便可能要終身服藥,目前仍沒有任何一種藥物或療法被證明能將他汀類藥物徹底取代。
而對於他汀耐藥,或一些用藥後血脂仍控制不佳的患者,除依折麥布外,目前還有兩類前沿的PCSK9抑制劑——單克隆抗體以及siRNA藥物陸續進入臨牀或上市,在與他汀類藥物聯用的基礎上,它們已經被證明安全有效。
相比之下,VERVE-101的最大賣點,可能在於其號稱能在預防心血管疾病上“一勞永逸”。對此,周鵬教授更是持謹慎態度。
“包括動脈粥樣硬化,單獨控制LDL-C水平並不意味能永久消除心血管疾病發作的可能,吸煙、高血壓、糖尿病、肥胖等都是ASCVD的重要危險因素。”周鵬教授介紹,一項研究表明,在他汀類藥物的基礎上聯用PCSK9抑制劑,LDL-C水平能進一步降低50%左右,但在有限的隨訪時間內絕對得益僅提高了2%。
“依折麥布、PCSK9抑制劑等有限的臨牀得益,都建立在他汀類藥物的基礎上。從動物實驗上來看,VERVE-101將‘壞膽固醇’降低了60%,雖然幅度很大,但也並沒有超越其它PCSK9抑制劑。”周鵬教授認為,對於ASCVD的高危人羣,VERVE-101只是多提供了一種治療選擇。此外,費用-效益比也是一個值得關注的問題。
據“彭博社”報道估計,每位患者目前VERVE-101療法的成本可能在50,000至200,000美元之間。
長期安全性方面,MIT Technology Review發文稱,目前已有因降低PCSK9蛋白而出現肌肉疼痛等副作用的案例。普通藥物可以及時停止使用,但基因編輯後想要修改,就沒那麼容易了。
周鵬教授把VERVE-101及類似技術產品稱為“一個新的希望”,“但不能過分誇大”,“認為它即便一路高歌猛進最終上市,ASCVD的問題就徹底解決了,這是不可能的。”
據悉,Verve公司旗下的另一款基因編輯項目也在開發之中,針對的是ANGPTL3基因。作為膽固醇和甘油三酯代謝的關鍵調節因子,ANGPTL3已成為治療嚴重高脂血症最有希望的靶標之一。