Nature子刊:科學家在宏量營養素、腸道菌羣和免疫之間建立了新的聯繫_風聞
中国生物技术网-中国生物技术网官方账号-2022-08-09 10:29
數以萬億計的細菌生活在腸道內,構成了腸道菌羣這個複雜的生態系統。腸道菌羣在宿主生理和免疫中發揮着至關重要的作用已人盡皆知。為了維持共生關係,宿主已經進化出一系列策略來調節其與腸道菌羣的相互作用。其中,粘膜****分泌型IgA(sIgA)在宿主-菌羣共生關係中發揮關鍵作用,它通過排除致病菌和病原體並限制細菌附着在上皮細胞上。雖然選擇性IgA缺乏症患者看起來都很健康,但他們更容易患胃腸道疾病、過敏和其他疾病。這凸顯了sIgA在黏膜穩態中的重要性。
眾所周知,飲食成分是腸道菌羣組成的主要驅動因素。長期以來,科學家們一直關注飲食在維持腸道健康方面的作用。然而,飲食如何影響腸道菌羣和sIgA之間的動態相互作用仍然未知。
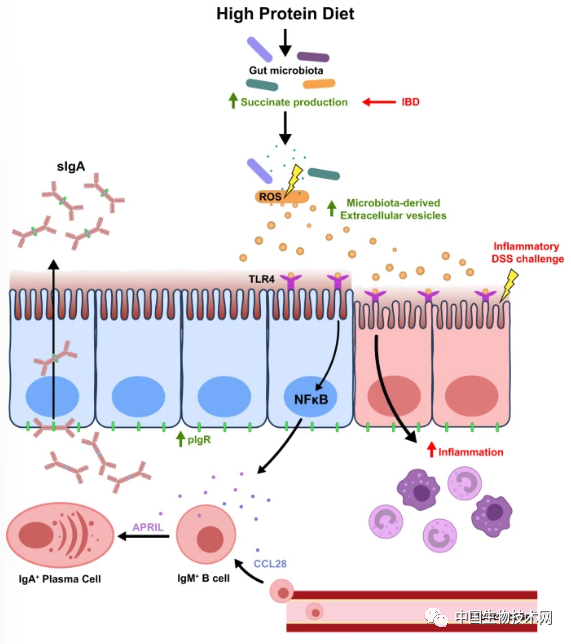
2022年7月27日,發表在**《Nature Communications》上的一項新研究中,來自悉尼大學的研究團隊首次將其開發的營養幾何模型應用於免疫學研究。他們發現,高蛋白飲食可以改變腸道菌羣,從而引發免疫反應。**該研究讓我們進一步瞭解了飲食對腸道健康和免疫的影響。這些新知識可以確定哪些飲食成分有利於恢復腸道穩態,哪些不利於腸道健康,併為通過操縱細菌來優化健康的治療方法奠定了基礎。

在這項新研究中,該團隊使用此前基於生態學開發的營養幾何模型來探索10種具有不同宏量營養素構成(蛋白質、脂肪和碳水化合物)的等熱量飲食對小鼠的影響。
結果顯示,高蛋白飲食改變了腸道菌羣的組成和活性。餵食高蛋白食物的小鼠增加了細菌胞外囊泡的產生。隨後,機體會將這種活動視為一種威脅,並引發了一系列免疫細胞****進入腸壁的事件。
細菌胞外囊泡(EV)是一種由不同類型的細胞釋放到細胞外基質的膜性小囊泡,參與細胞間通信、細胞遷移、分子運輸、血管新生和腫瘤細胞生長等過程。細菌胞外囊泡內含有不同類型的分子,包括蛋白質、脂質、DNA和mRNA等。這些內容物質會隨着親代細胞分泌EV時的狀態和所處環境的改變而發生改變。
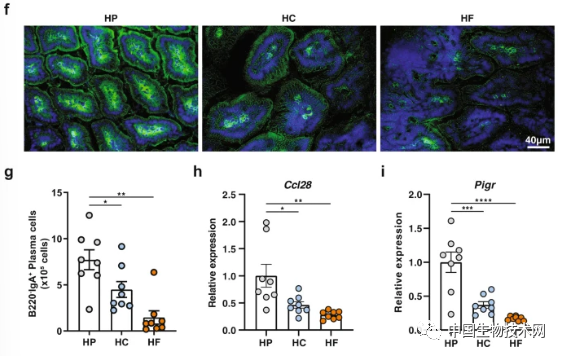
研究人員發現,膳食蛋白質驅動的分泌型IgA誘導不是由T細胞依賴性途徑或腸道菌羣組成的變化介導的。相反,與餵食高碳水化合物或高脂肪飲食的小鼠相比,餵食高蛋白飲食小鼠的腸道菌羣產生的細胞外囊泡數量顯著增加。這些細胞外囊泡激活Toll樣受體4,以增加IgA誘導細胞因子APRIL、B細胞趨化因子CCL28和IgA轉運體PIGR的上皮表達。進一步研究表明,高蛋白飲食餵養動物的腸道菌羣產生的高濃度琥珀酸鹽增加了細菌活性氧生成,進而促進了細胞外囊泡的產生。
研究人員表示,活性氧會誘發細菌突變和抗生素耐藥性,這可能會引起人們對高蛋白飲食可能促進抗生素耐藥性細菌生長的擔憂。
此外,他們在結腸炎模型中發現了更高水平的細菌細胞外囊泡。腸道菌羣失調以及高水平的琥珀酸鹽是這種疾病的主要特徵。
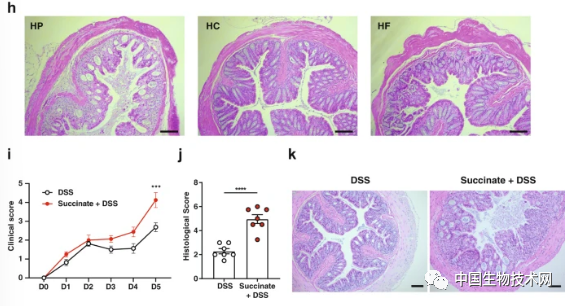
總之,這項研究描述了腸道菌羣通過細菌衍生的細胞外囊泡(EV)調節T細胞非依賴性IgA誘導的途徑,更廣泛地揭示了腸道菌羣影響宿主的機制。這為將微生物組EV表徵為菌羣失調的生物標誌物,以及使用細菌EV作為恢復腸道平衡的生物製劑開闢了有希望的新前景。
該研究共同通訊作者、悉尼大學生命與環境科學學院學術主任Stephen J. Simpson教授説:“營養幾何學框架使我們能夠根據飲食中的營養成分將膳食、膳食與膳食的模式繪製在一起,這有助於研究人員觀察某些飲食、健康和疾病之間的聯繫中被忽視的模式。這是這個模型首次應用於免疫學,我們對接下來可能發生的事情感到興奮。”
論文鏈接:
https://www.nature.com/articles/s41467-022-31761-y