Science|田志剛院士等團隊在免疫學領域連續取得進展_風聞
葆力医学观察-专注生物科研领域,趣味科普与行业干货齐飞2022-08-12 10:18
慢性乙型肝炎病毒 (HBV) 感染是導致肝細胞癌 (HCC) 的主要原因,在中國、東亞和北非國家是一個嚴重的健康問題。目前尚無法有效治療HBV相關的HCC。
2022年8月8日,中國科學技術大學田志剛,陳永豔及孫汭在Hepatology(IF=17)在線發表題為“TIGIT blockade elicits potent anti-tumor immunity in naturally occurring hepatitis B virus-related hepatocellular carcinoma in mice”的研究論文,該研究通過用 HBsAg+ 肝細胞(即 HBs-HepR 小鼠)替代野生型肝細胞,建立了自發性 HBV 相關 HCC 的小鼠模型。 HBs-HepR 小鼠腫瘤為炎症相關 HCC,與患者的 HBV 相關 HCC 相似,這與其他 HCC 小鼠模型不同,例如二乙基亞硝胺 (DEN) 誘導的 HCC、Tak1 敲除誘導的 HCC、stelic 動物模型 (STAM) 中的 HCC 或非酒精性脂肪性肝炎 (NASH) 誘導的 HCC。
HBs-HepR 小鼠 HCC 的特徵是 CD8+ T 細胞數量增加,而肝內 CD8+ T 細胞產生的 IL-2、TNF-α 和 IFN-γ 減少。TIGIT 在 CD8+ T 細胞上的表達增加是功能衰竭的原因。在 HBs-HepR 小鼠 HCC 進展的早期和中期研究了 TIGIT 阻斷劑的治療效果。TIGIT 阻斷劑使肝內 CD8+T 細胞恢復活力,增加了 TNF-α 和 IFN-γ 的產生,並增加了腫瘤中 CD8+ T 細胞的數量,從而減緩了 HBs-HepR 小鼠中 HCC 的發展。阻斷 PD-L1 未顯示直接治療效果或與 TIGIT 阻斷協同作用。總之,在自發性 HCC 小鼠模型中,單獨阻斷 TIGIT 可增強 HBV 相關 HCC 進展過程中 CD8+ T 細胞的抗腫瘤活性。
另外,2021年11月5日,中國科學技術大學魏海明,田志剛及安徽醫科大學李家斌共同通訊在Signal Transduction and Targeted Therapy 在線發表題為“Restoration of HBV-specific CD8+ T-cell responses by sequential low-dose IL-2 treatment in non-responder patients after IFN-α therapy”的研究論文,研究結果表明序貫 IL-2 治療顯示出挽救難治性 CHB 無反應患者免疫功能的功效。
2021年9月15日,中國科學院深圳先進技術研究院畢嘉成,中國科學技術大學田志剛及孫昊昱等團隊合作在Science Advances 在線發表題為“TIPE2 is a checkpoint of natural killer cell maturation and antitumor immunity”的研究論文,該研究結果揭示了小鼠和人類 NK 細胞成熟和抗腫瘤免疫的有效檢查點,表明了一種有前景的靶向 TIPE2 用於基於 NK 細胞的免疫療法的方法。
2021年9月17日,中國科學技術大學田志剛及彭慧共同通訊在Nature Communications 在線發表題為“METTL3-mediated m6A RNA methylation promotes the anti-tumour immunity of natural killer cells”的研究論文,該研究表明m6A甲基化保護了 NK 細胞的穩態和腫瘤免疫監視功能。
2021年9月12日,中國科學技術大學彭慧,田志剛及孫汭共同通訊在Hepatology 在線發表題為“Requirement of RORα for Maintenance and Anti-Tumor Immunity of Liver-Resident Natural Killer Cells/ILC1s”的研究論文,該研究揭示了 RORα 在 LrNK 細胞/ILC1 維持和功能中以前未定義的作用,為利用 LrNK 細胞/ILC1 活性治療肝癌提供了見解。
2021年7月6日,中國科學技術大學魏海明,田志剛及Sun Zimin共同通訊在Nature Communications 在線發表題為“Inflammatory monocytes promote pre-engraftment syndrome and tocilizumab can therapeutically limit pathology in patients”的研究論文,該研究提供了一種治療策略,用於解決 PES 和改善非復發死亡率。2021年3月21日,中國科學技術大學田志剛、彭慧、孫汭及法國馬賽大學EricVivier 共同通訊在Science 發表題為“Liver type 1 innate lymphoid cells develop locally via an interferon-γ-dependent loop” 的研究論文,該研究發現成年肝臟造血前體細胞向1型天然淋巴細胞(肝臟ILC1,即肝臟定居NK細胞)的分化潛能及調控機制,揭示天然淋巴細胞的骨髓外發育新路徑。

肝癌是癌症相關死亡的主要原因之一,特別是在非洲和東亞國家。 2020年,肝癌是全球第六大最常見的癌症類型,也是癌症相關死亡的第三大原因。此外,根據國際癌症研究機構的數據,2020年肝癌是中國第五大常見癌症,導致39萬人死亡,約佔中國癌症相關死亡總數的13%和世界範圍內肝癌相關死亡的一半。肝細胞癌 (HCC) 是最常見的肝癌形式,佔原發性肝癌的 75-85%。它是由多種致病因素引起的,包括乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)感染、酗酒和非酒精性脂肪性肝炎(NASH)。慢性HBV感染是中國HCC的主要原因。儘管早期 HCC 患者適合手術切除或肝移植,但使用免疫抑制藥物治療存在腫瘤復發的風險。大約 70% 的患者被診斷為晚期 HCC,從而限制了手術切除或肝移植的有效性,導致 5 年腫瘤複發率約為 60-70%。多激酶抑制劑,如索拉非尼(sorafenib)和瑞戈非尼(regorafenib),可以將 HCC 患者的總生存期延長不超過 6 個月。其他潛在的治療方法目前處於臨牀前階段。因此,迫切需要治療HCC的新策略。免疫療法,特別是免疫檢查點阻斷,已經徹底改變了癌症療法,並且可能有益於治療 HCC。發現 HCC 的腫瘤浸潤淋巴細胞 (TIL) 表達高水平的一系列免疫檢查點,包括 CTLA-4、PD-1、LAG-3、TIM-3、LAYN 和 TIGIT。這些免疫檢查點誘導 TIL 功能衰竭並導致 HCC 的免疫逃逸。臨牀試驗表明,接受抗 CTLA-4 或抗 PD-1/PD-L1 抗體治療的 HCC 患者的反應率較差(<20%),儘管阻斷 CTLA-4 或 PD-1/PD-L1對其他幾種腫瘤的影響顯示出有希望。這些發現表明,額外的免疫檢查點可能與 HCC 的免疫逃逸有關。 因此,有必要探索其他有可能增強 TILs 在 HCC 患者中的抗腫瘤活性的免疫檢查點。
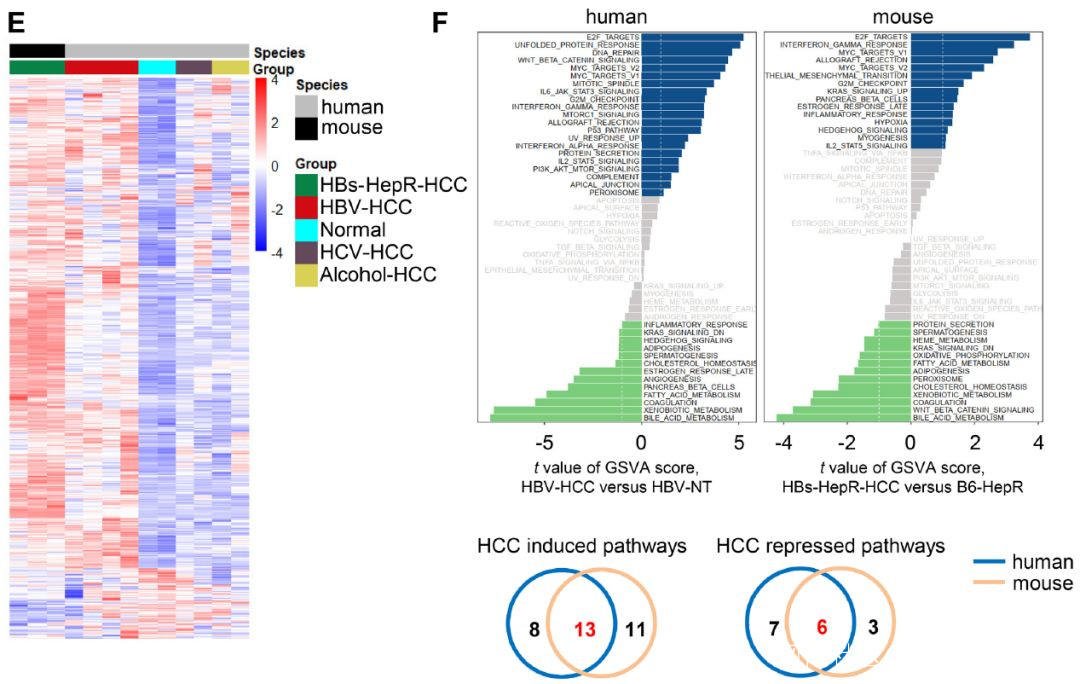
文章部分結果展示(圖源自Hepatology )TIGIT 是一種很有前途的癌症免疫治療新靶點,在 CD4+T 細胞,特別是調節性 T (Treg) 細胞、CD8+ T 細胞和 NK 細胞上表達。與其他常見檢查點(例如 PD-1 和 CTLA-4)不同,TIGIT 在腫瘤浸潤 NK 細胞上高度表達。阻斷TIGIT可有效恢復衰竭NK細胞和CD8+ T細胞的效應功能。TIGIT 在從 HBV 相關 HCC 患者獲得的外周血中的 CD4+T 細胞和 CD8+ T 細胞上顯著上調。PD-1+TIGIT+CD8+T細胞表現出衰竭的特徵,包括細胞因子產生減少和對細胞凋亡的高度易感性。這些特徵與 HBV 相關 HCC 患者的疾病進展加速和預後不良有關。 TIGIT/PD-1 共阻斷通過調節細胞因子產生和細胞毒性在體外重振 CD8+ T 細胞以對抗 HCC 細胞。僅當與 PD-1/PD-L1 阻斷聯合使用時,抗 TIGIT 治療才在 HCC 小鼠模型中顯示出治療效果;然而,基因工程 Trp53KO/c-MycOE 小鼠的腫瘤進展與患者 HBV 相關 HCC 的進展無關。迄今為止,尚未開發出實用的 HBV 相關 HCC 小鼠模型。因此,需要合適的 HBV 相關 HCC 小鼠模型來探索 TIGIT 阻斷劑對 HBV 相關 HCC 的治療效果。該研究通過 HBsAg+ 肝細胞替代在免疫活性小鼠中建立了一種自然發生的 HBV 相關 HCC 模型。 該模型克服了 HBV 感染的宿主限制,避免了對 HBV 病毒抗原的中樞免疫耐受。在這項研究中,該研究發現肝內 CD8+ T 細胞上較高水平的 TIGIT 表達是其功能衰竭的原因。通過增加 CD8+ T 細胞的抗腫瘤活性,單獨阻斷 TIGIT 足以減緩 HBV 相關 HCC 的進展。 參考消息:https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.32715
來源:iNature