如何讓細胞活着,還把轉錄組給測了_風聞
中科院之声-中国科学院官方账号-2022-08-23 10:33
既要轉錄組測得了,又要細胞活得好
若干年前,有一個“詭異現象”困惑着攻讀博士學位的陳萬澤。他在誘導細胞死亡時經常發現,明明誘導條件和細胞來源相同,細胞死亡速度和反應卻大不一樣。這一“詭異現象”似乎説明:那些看起來一樣的細胞其實不完全一樣!
同樣的問題困擾着所有研究單細胞的科學家。細胞從前世到今生的變化藴含了我們生老病死的奧秘:一個受精卵的今時昨日就是一次個體發育的歷程;一個癌細胞的來龍去脈就是一部腫瘤發病史;一個免疫細胞的出場謝幕就是一場和病原殊死搏殺的戰爭大戲。所以,跟蹤細胞的動態變化過程不僅有助於解碼細胞生命的奧秘,更有助於揭示疾病發生的根本原因。
細胞內各個基因是否表達、每個基因表達量的高低被稱作細胞的轉錄組,可以很好地體現細胞的狀態。2009年湯富酬教授開發了單細胞mRNA測序技術,可以瞭解單獨一個細胞的轉錄組來解析細胞狀態。
但是普通的單細胞轉錄組測序技術有一個侷限:需要裂解殺死細胞獲得所有mRNA才能做轉錄組測序。這就導致了科研人員只能解析某一時刻的單細胞轉錄組,無法在測量細胞轉錄組之後繼續觀察細胞的狀態。以陳萬澤遇到的問題為例:想知道看起來一樣的細胞哪裏不一樣,最好的方法就是知道每個細胞在刺激前的轉錄組,再知道刺激後的細胞反應和刺激後的轉錄組。兩相比較就知道了每個細胞的差異,以及哪些差異影響了細胞的反應。可是如果在刺激前就裂解細胞收集mRNA,那麼細胞已經死亡無法接受刺激;如果在刺激完成後收集mRNA,則無法收集到刺激前的細胞轉錄組,從而陷入“既要確保細胞活着,又要完成測序”的死循環。
從韓家淮院士課題組博士畢業後,陳萬澤老師來到了瑞士洛桑聯邦理工學院(EPFL)Bart Deplancke課題組做博後,得到了諾貝爾獎得主Bruce Beutler(先天性免疫受體發現者諾貝爾獎得主)的指引:“一個問題很多人關心,就是一個好問題;一個好問題很多人試圖解決都解決不了,就是一個難題。好問題值得去解決,而難題值得用你所有精力去努力”。
陳萬澤決定,開發一種能對活細胞做轉錄組的技術,要能記錄直徑只有頭髮絲1/1000的細胞中轉錄組的“悲歡離合,電影人生”。
Live-seq開發難,步步逼近路迴轉
剛開始陳老師想收集細胞外泌體(細胞向外面吐出來的小泡,內含蛋白質、RNA等)做轉錄組測序,用外泌體的轉錄組來反映細胞的轉錄組。儘管進行了細胞改造、製備微流控芯片、大幅優化轉錄組測序流程等工作,但是由於細胞分泌的外泌體數量少得可憐,這個方法最後失敗了。
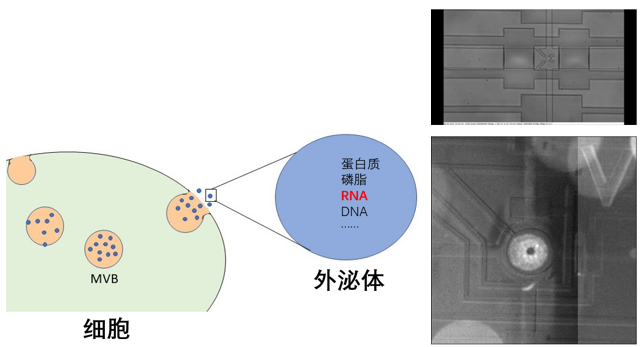
左:外泌體示意圖,修改自維基百科;右:捕獲單細胞的微流控芯片
得益於EPFL學科交叉和非常頻繁的學術交流,陳萬澤瞭解到了材料領域常用但生命科學領域很小眾的工具——原子力顯微鏡。這種顯微鏡有一個很尖很尖的硅探針,多用於檢測物質表面性質。陳萬澤將針尖修飾上polyT,用來結合mRNA的polyA尾巴,通過polyT和polyA的配對結合把mRNA“釣”出來。由於針尖很細,對細胞的損傷就很小。這樣既“釣”到了細胞的mRNA,又保證了細胞能繼續存活。經過嘗試,這個方法能“釣”到基因,但是用了大量探針做實驗只有2個探針有結果。雖然有進展,但高度受限於探針的昂貴和低成功率。
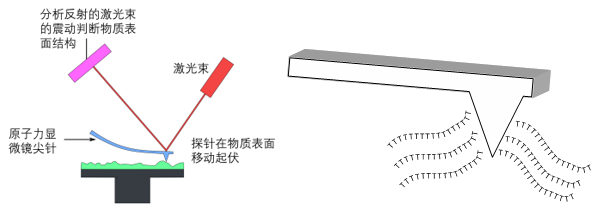
左:原子力顯微鏡原理圖,修改自維基百科;右:探針修飾polyT示意圖
俗話説得好,無巧不成書。一次學術交流中陳萬澤和導師瞭解到,彼時隔壁瑞士聯邦理工學院的Julia Vorholt實驗室開發了一種特殊的原子力顯微鏡,能吸出來一部分細胞質……等會兒,你是説,他們實驗室的原子力顯微鏡能吸出來一部分細胞質?
一番電話溝通,雙方一拍即合。兩個課題組優化了實驗過程,包括探針中預混RNA酶抑制劑、低温下的快速操作、超微量樣品轉移、逐樣品清洗避免交叉污染、圖像下追蹤細胞等措施來保證實驗結果的可靠性,更巧的是陳萬澤一開始為了外泌體測序優化的轉錄組測序流程此時也派上了用場。
經過不斷努力這項新技術開發了出來,並最終被命名為——live-seq活細胞測序。
技術開發不隨便,各個方面要檢驗
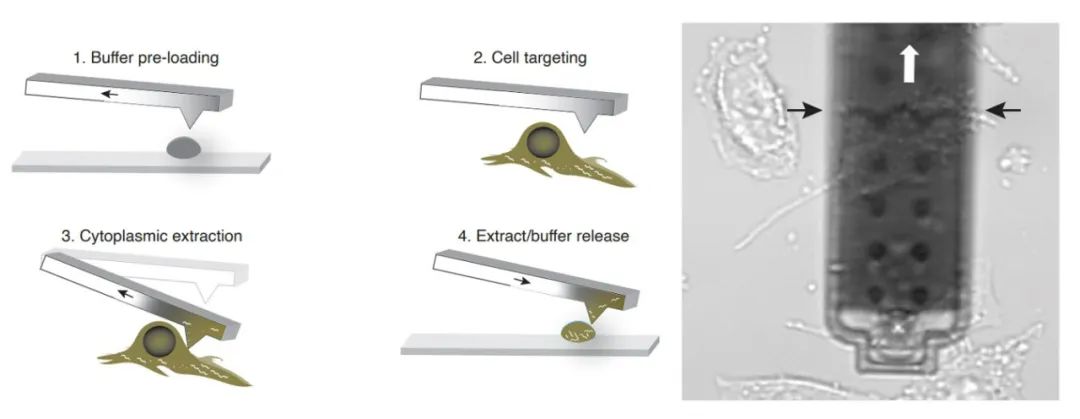
左圖為實驗示意圖,右圖為實拍顯微鏡吸取細胞質(論文作者供圖)
技術開發出來必然要接受一系列的質問和考驗:
普通單細胞轉錄組可以描述不同細胞狀態,你live-seq能準確描述出不同細胞的類型和狀態嗎?
能!聯合課題組用live-seq測了五種狀態細胞的轉錄組,一共檢測了294個細胞,平均每個細胞檢測到約4112個基因的表達,與常規單細胞轉錄組方法檢測到的基因數量接近。live-seq轉錄組的數據能夠清晰地將五種細胞分開,説明live-seq測到的轉錄組能有效區分不同類型的細胞。
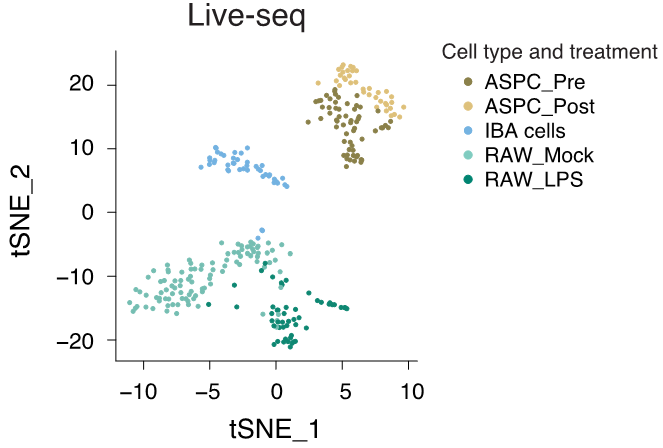
live-seq能有效區分不同的細胞(論文作者供圖)
普通單細胞轉錄組可以描述整個細胞狀態,你live-seq吸出來的這一部分能代表整個細胞嗎?
能!課題組將live-seq測到的數據和整個細胞的轉錄組相比較,發現二者沒有顯著的區別,説明live-seq測到的數據能有效代表整個細胞的轉錄組。
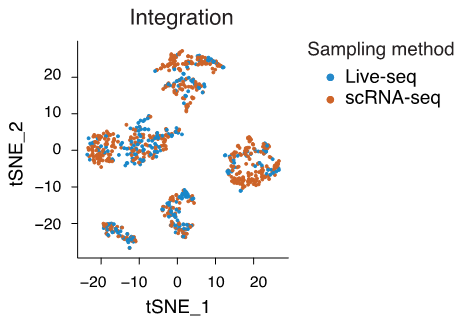
live-seq和完整細胞的測序數據一致(論文作者供圖)
開發live-seq是為了讓細胞測序完還能存活的,你live-seq能保證細胞被吸取了一部分細胞質還存活嗎?
能!live-seq平均每次吸取的細胞質只有1.1 pL,吸取後的細胞存活率在85%-89%,要知道細胞傳代時胰蛋白酶解離後的細胞存活率也才90-95%。課題組還比較了不吸取細胞質的細胞、吸取細胞質後1小時的細胞、吸取4小時細胞的轉錄組,三者一致,説明live-seq沒有對細胞造成很大的影響。並且在顯微鏡下,課題組能觀察到吸取過細胞質後,細胞體積可以快速恢復到正常水平,還能正常分裂,更説明不影響細胞存活。
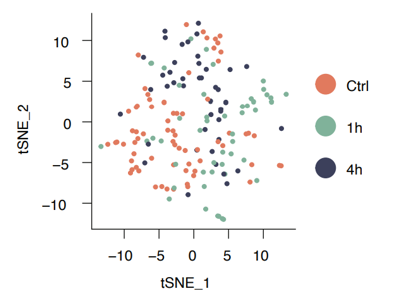
吸取細胞質不會對影響細胞轉錄組(論文作者供圖)
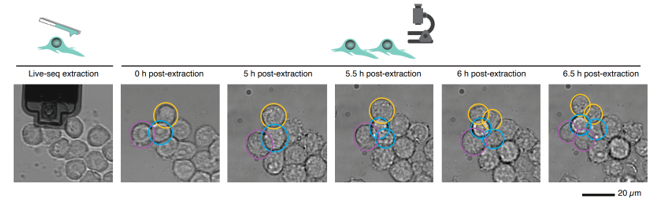
live-seq之後細胞仍能正常生長、分裂(論文作者供圖)
開發新技術是為了解決實際問題,你live-seq能解決實際問題嗎?
能!而且立刻顯現出不俗的實力。Live-seq能夠先測量“過去”的細胞作為細胞變化的“因”,讓細胞存活一段時間後,再對細胞進行測序作為細胞變化的“果”。能夠同時呈現因果是Live-seq的重要特點。作為牛刀小試,聯合課題組採用了RAW-G9巨噬細胞系模型,其中包含一條神奇的通路:當使用LPS刺激,細胞中的NF-κB表達量上升,NF-κB的上升會同時刺激Tnf-mCherry和NFKBIA的上升,但是NFKBIA的上升會抑制NF-κB。
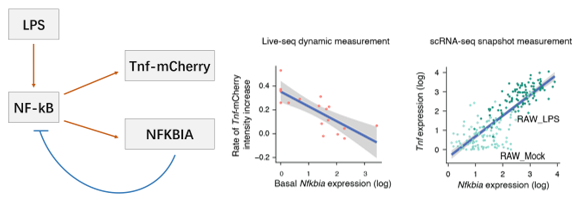
LPS-NF-κB通路關係,紅色箭頭代表促進作用,藍色線條代表抑制作用
使用傳統的單細胞測序,只能暫停到細胞裂解的那個時刻,在這一時刻因為NF-κB的調控,Tnf-mCherry和NFKBIA要麼同時高要麼同時低;但是當使用live-seq觀察的時候,NFKBIA表達量升高會導致Tnf-mCherry表達量下降,這是傳統單細胞測序技術無論如何也觀察不到的。這種奇妙的感覺就像Michael Jackson的“太空舞步”,暫停下來每一幀都好像在向前走,但是當你連貫起來看卻發現人在後退!這一次live-seq完勝。
研究成果想要炫,學科交叉説了算
回顧live-seq的開發過程,學科交叉顯得尤為重要,優化超微量RNA的測序步驟需要紮實的生物學實驗功底,大批的數據分析需要生物信息的能力,更不要提原子力顯微鏡的使用需要跨到材料領域學習。這其中任何一項的缺失都會導致這項技術的開發失敗,陳老師講述中課題組之間的合作早就不是各自分工,而更像武俠小説裏身負多項絕學後洗練招式的融會貫通。
學科交叉的魅力又不侷限於本篇研究。現代科學在研究自然界的時候劃分了很多學科,然而自然界原本就是一個相互聯繫的有機整體。科學交叉集分化與綜合於一體,實現了科學的整體化。既是還原了自然本來面目,也是發現問題、解決問題的新戰場,更有利於解決人類面臨的複雜科學問題。
以上的研究經歷和研究結果是2022年8月17日,中國科學院深圳先進技術研究院合成生物學研究所陳萬澤課題組、瑞士洛桑聯邦理工(EPFL)Bart Deplancke課題組和蘇黎世聯邦理工(ETHZ)Julia Vorholt課題組合作在Nature發表的題為 Genome-wide molecular recording using Live-seq 的文章,該研究開創了一種利用原子力顯微鏡對活細胞轉錄組做測序的方法,可以將scRNA-seq從終點分析轉換為時間分析來解決廣泛的生物學問題。
論文鏈接:https://www.nature.com/articles/s41586-022-05046-9
DOI: 10.1038/s41586-022-05046-9
來源:中國科學院深圳先進技術研究院