Cancer Res:揭示高級別漿液性卵巢癌的分子調控機制_風聞
葆力医学观察-专注生物科研领域,趣味科普与行业干货齐飞2022-08-23 10:10
卵巢癌是致死率最高的婦科腫瘤之一,其中高級別漿液性卵巢癌(High-grade serous cancer,HGSC)是最常見的亞型。高級別漿液性卵巢癌通常在確診時已是晚期,並且常伴隨廣泛的盆腹腔轉移甚至遠端轉移。儘管對手術和化療有初步的臨牀反應,但大多數患者均會在五年內復發。因此,瞭解高級別漿液性卵巢癌發生發展的分子機制具有重要的臨牀意義。
腫瘤內異質性是阻礙高級別漿液性卵巢癌研究最大的障礙之一。單細胞組學測序為研究腫瘤內異質性提供了強有力的工具,此前已有一些研究利用單細胞轉錄組測序技術(scRNA-seq)揭示了高級別漿液性卵巢癌內高度的腫瘤內異質性,但其發生發展過程中的基因組和表觀基因組的變化還有待於進一步研究。
為了全面揭示高級別漿液性卵巢癌在發生發展過程中不同組學層面的分子特徵及其互作關係,北京大學生物醫學前沿創新中心湯富酬課題組與北京大學人民醫院崔恆課題組、清華大學紀家葵課題組合作,對12例高級別漿液性卵巢癌患者、4例非漿液性卵巢癌患者及6例輸卵管組織正常對照進行了高精度單細胞多組學測序分析(基因組(拷貝數變異)、染色質狀態組、DNA甲基化組、轉錄組。
相關研究成果近日以:Single-cell dissection of the multiomic landscape of high-grade serous ovarian cancer 為題在線發表在 Cancer Research 期刊上。

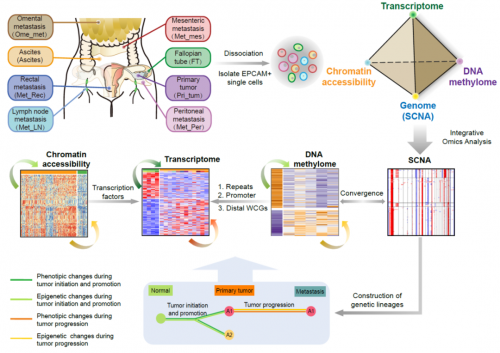
圖1.研究策略示意圖
該研究的主要發現有:1.揭示了高級別漿液性卵巢癌腫瘤發生過程中氧化磷酸化通路和糖酵解通路的活性同時增強。腫瘤組織由多種類型的細胞組成,準確鑑定細胞身份是腫瘤研究中的重要環節。此前大多數基於單細胞轉錄組單組學的研究主要是利用細胞類型特異性標誌物的基因表達以及由RNA表達間接推斷的基因組拷貝數變異(SCNA)來區分惡性細胞(癌細胞,腫瘤細胞)和非惡性細胞(非癌細胞,非腫瘤細胞)。利用單細胞多組學測序技術,除了可以利用轉錄組的信息,還可以利用基因組DNA的信息直接推斷基因組拷貝數變異,更準確地反映拷貝數變異的情況。結果顯示,存在一些由RNA間接推斷有基因組拷貝數變異的細胞實際上不含有基因組拷貝數變異(假陽性),也存在一些由RNA間接推斷沒有基因組拷貝數變異的細胞實際上含有少量的基因組拷貝數變異(假陰性),這突顯了應用單細胞多組學技術的必要性。通過比較輸卵管上皮細胞(FTE)與原發位腫瘤細胞之間的基因表達差異,該研究發現,與真核轉錄和蛋白質泛素化相關的通路在高級別漿液性卵巢癌腫瘤細胞中顯著下調,提示在高級別漿液性卵巢癌的腫瘤發生過程中蛋白質翻譯和降解等方面發生了劇烈變化。另外,有361個基因的表達在腫瘤細胞中特異性上調,它們主要富集在VEGFA-VEGFR2信號通路、金屬離子穩態、病毒相關過程調控和代謝調控等通路上。值得注意的是,對細胞能量代謝至關重要的氧化磷酸化(OXPHOS)通路和糖酵解通路同時發生上調。為了進一步探究這一現象是否是由於存在兩種不同亞型的腫瘤細胞 (一種亞型腫瘤細胞中上調氧化磷酸化通路,而另一種亞型腫瘤細胞中上調糖酵解通路),該研究計算了每個單細胞的氧化磷酸化評分和糖酵解評分。結果顯示正常輸卵管上皮和高級別漿液性卵巢癌細胞可以被明確區分,而腫瘤細胞無法進一步劃分為不同的亞型,且不同患者之間存在微小的差異,這説明腫瘤細胞中同時增強了氧化磷酸化通路和糖酵解通路的活性(圖2)。為了進一步明確高級別漿液性卵巢癌的典型特徵,該研究還將高級別漿液性卵巢癌與非漿液性卵巢癌中的腫瘤細胞進行了系統比較。通過主成分分析(PCA)發現,高級別漿液性卵巢癌的腫瘤細胞與非漿液性卵巢癌的腫瘤細胞的基因表達差異非常突出,表明高級別漿液性卵巢癌具有獨特的基因表達特徵。此外,差異基因表達分析顯示,與非漿液性卵巢癌相比,高級別漿液性卵巢癌的腫瘤細胞中金屬硫蛋白基因和干擾素(IFN)信號通路相關基因的表達也更高。這説明干擾素信號通路的強烈上調是高級別漿液性卵巢癌的突出特徵。
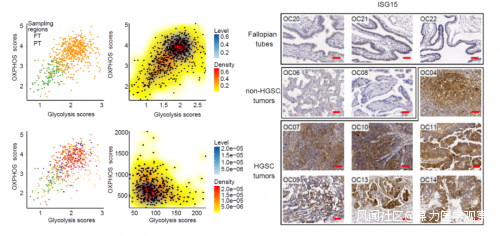
圖2. 代謝相關通路的打分及ISG15的免疫組化2. 確認了高級別漿液性卵巢癌腫瘤發生過程中8號染色體拷貝數增加導致MYC基因劑量增加進而導致氧化磷酸化通路和糖酵解通路活性增強。高級別漿液性卵巢癌細胞中8號染色體經常發生拷貝數增加,因此該研究分析了腫瘤細胞中特異性上調的基因(361個)是否與8號染色體的擴增有關。結果表明,腫瘤細胞特異性上調的361個基因中有46個位於8號染色體上,8號染色體是腫瘤上調基因最富集的染色體。這46個基因主要富集在電子傳遞鏈和氧化磷酸化相關的通路上。進一步的研究發現這46個基因的上調與患者更短的總生存期密切相關。此外,該研究還觀察到調控細胞分裂、氧化磷酸化和糖酵解的MYC(位於8號染色體上)在12例高級別漿液性卵巢癌患者中有10例發生上調。結果提示,8號染色體的擴增可能通過增加原癌基因MYC以及OXPHOS相關基因的劑量來促進高級別漿液性卵巢癌的腫瘤發生。3.探究了高級別漿液性卵巢癌腫瘤發生過程中DNA甲基化對基因表達的調控作用。DNA甲基化是最重要的表觀遺傳修飾之一,在腫瘤發生過程中經歷廣泛的重編程,並可能影響基因表達。該研究分析了重複元件區域甲基化、基因啓動子區域甲基化和遠端調控元件區域甲基化對基因表達的潛在調控作用。該研究發現絕大部分卵巢癌患者(9/11)的腫瘤細胞的基因組甲基化水平都顯著降低,這表明大規模DNA去甲基化也是卵巢癌的顯著特徵。對所有患者而言(11/11),衞星核元件(satellite DNA)和長散在核元件1 (LINE1)均表現出最顯著的DNA去甲基化。相關性分析顯示,可能同時受satellite DNA和LINE1負調控的基因主要富集在金屬硫蛋白結合金屬、干擾素、凋亡、血管生成相關通路;可能受其正調控的基因主要富集在核糖體合成相關通路。進一步分析受啓動子甲基化調控的基因,發現金屬硫蛋白結合金屬相關基因以及干擾素通路相關基因很可能也同樣受其啓動子甲基化改變的影響。該研究利用MICMIC分析了遠端調控元件(例如:增強子)的甲基化對基因表達影響。該研究共檢測到16,941對調控區域-靶基因對。其中53.9%與靶基因的表達呈負相關關係。大多數靶基因可能受DNA甲基化調控的調控區域個數小於5個。上述結果表明,有些基因不僅可能受其啓動子區域甲基化的調控,還可能受其遠端調控區域甲基化的調控。例如,腫瘤細胞特異性上調的基因IFI27(圖3)的表達與其啓動子DNA甲基化負相關,也與其遠端調控元件(距離IFI27轉錄起始位點約235kb)甲基化負相關。此外,該遠端調控元件區域與一個已知的增強子區域重疊,其側翼區域在原發位腫瘤細胞中比輸卵管上皮細胞表現出更高的染色質開放性,突出了其對IFI27表達的潛在調控作用。

圖3. 示意圖顯示遠端區域(WCG7649168: chr14: 94,577,079-94,583,033)的甲基化可能調控IFI27的表達4.發現在高級別漿液性卵巢癌腫瘤發生過程中FOXK1、TFAP2C、NR2F6、DDIT3等重要轉錄因子的調控活性顯著增強。轉錄因子蛋白與基因順式調控元件的特異性結合是轉錄調控的基本機制,而轉錄因子的結合通常受染色質狀態的調控。該研究發現腫瘤細胞的全局染色質狀態比輸卵管上皮細胞更開放,而基因啓動子區域(轉錄起始位點鄰近區域)的染色質開放程度卻比輸卵管上皮細胞更低(開放區域更窄、開放幅度更低)。為了探索高級別漿液性卵巢癌腫瘤發生過程中潛在的關鍵調控因子,該研究使用chromVAR對NDR進行轉錄因子結合基序(binding motif)富集分析。總共有107個轉錄因子的基序在腫瘤細胞中更開放,而另外126個轉錄因子的基序則更封閉。為了進一步探究哪些轉錄因子更可能參與到腫瘤特異性的基因表達調控中,該研究使用Lisa推斷調控腫瘤特異性表達基因的轉錄因子。在這107個轉錄因子中,FOXK1、TFAP2C、NR2F6、DDIT3這4個轉錄因子本身的表達水平在腫瘤細胞中顯著高於輸卵管上皮細胞(圖4)。FOXK1是誘導糖酵解的重要調控因子,考慮到糖酵解途徑在高級別漿液性卵巢癌中表達上調,並且其轉錄調控因子FOXK1的結合基序顯示出較高的可及性,該研究認為FOXK1很可能是高級別漿液性卵巢癌的候選治療靶點。圖4. 利用染色質可及性和轉錄組信息綜合探究高級別漿液性卵巢癌中可能起重要調控作用的轉錄因子5. 發現高級別漿液性卵巢癌在腹腔轉移過程中腫瘤細胞的基因表達模式基本不變。在準確鑑定出腫瘤細胞後,該研究利用染色體內的斷點信息構建了同一個患者體內腫瘤細胞的不同遺傳譜系。儘管高級別漿液性卵巢癌攜帶有大量的基因組拷貝數變異,它們的遺傳譜系組成卻相對簡單,大多數患者(8/9)的腫瘤細胞只有1-2個遺傳譜系。在分析了輸卵管上皮細胞與高級別漿液性卵巢癌的原發位腫瘤細胞之間的差異後,該研究接下來探究了同一個遺傳譜系的原發位腫瘤細胞與轉移位腫瘤細胞之間的基因表達差異。結果顯示,在大多數患者中(5/6),同一個遺傳譜系的腫瘤細胞在轉移到腹腔後只有極少數基因的表達發生了改變(但是在轉移到淋巴結的一例患者中,同一個遺傳譜系的腫瘤細胞在轉移前後有兩千多個基因的表達發生了顯著改變;圖5)。這表明,雖然腫瘤細胞已經轉移到腹腔,但腹腔的微環境並不會強烈影響腫瘤細胞的整體基因表達模式,並提示腫瘤細胞轉移到腹腔的能力很可能是在腫瘤發生的早期階段獲得的。雖然腹腔轉移位腫瘤和原發位腫瘤之間只有少數幾個基因是有表達差異的,但這些差異表達基因為發現促進腹腔轉移的關鍵基因提供了線索。該研究驗證了在高級別漿液性卵巢癌轉移過程中HSPA6基因的特異性下調的作用。結果顯示,過量表達HSPA6可抑制癌細胞的遷移和侵襲,提示HSPA6的特異性下調促進了高級別漿液性卵巢癌的腫瘤轉移過程(圖5)。
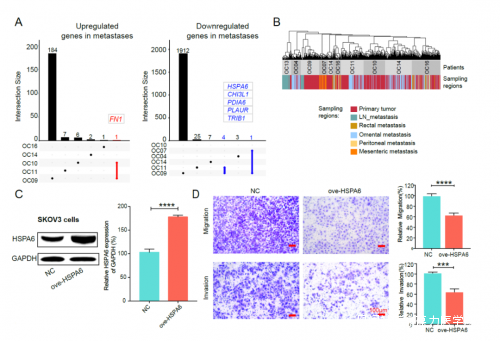
圖5. 原發位腫瘤和轉移位腫瘤間的差異基因及HSPA6的功能驗證6.發現高級別漿液性卵巢癌在腹腔轉移過程中腫瘤細胞的DNA甲基化模式基本不變。該研究發現,在大多數高級別漿液性卵巢癌患者的腫瘤轉移過程中,腫瘤細胞的全局DNA甲基化水平基本維持不變(圖6)。因此,可以利用DNA甲基化模式來推斷同一個患者體內腫瘤細胞的遺傳譜系。對DNA甲基化進行的無監督分層聚類驗證了這一點,結果顯示基於DNA甲基化模式推測出了與基於基因組拷貝數變異一致的腫瘤細胞遺傳譜系(圖6)。
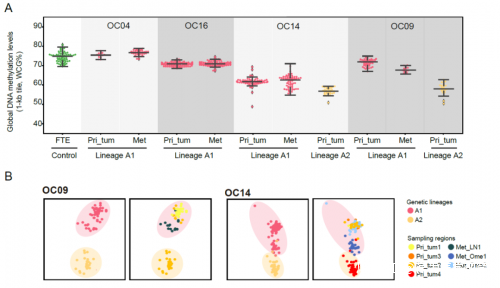
圖6. 癌細胞在轉移過程中保持DNA甲基化水平和模式7.發現可以利用原發位腫瘤內不同譜系腫瘤細胞之間的基因表達差異尋找參與腫瘤轉移的候選基因。腫瘤細胞遺傳譜系的重建可以揭示腫瘤內異質性並提供更加精確的腫瘤轉移分析。原發位腫瘤裏不同遺傳譜系的腫瘤細胞不僅具有不同的基因組拷貝數變異、不同的DNA甲基化水平和不同的基因表達模式,而且很可能也具有不同的轉移潛力。例如, OC09患者和OC14患者均有兩個不同的腫瘤細胞遺傳譜系(譜系A1和A2)。譜系A1的腫瘤細胞發生了轉移,而譜系A2的腫瘤細胞卻沒有發生轉移。差異基因表達分析顯示,OC09患者和OC14患者的A1譜系腫瘤細胞相比於A2譜系,均特異性上調了CCN1和HSP90AA1的表達(圖7)。利用CRISPR-Cas9系統敲除CCN1基因後,卵巢癌細胞的遷移和侵襲能力均顯著降低。使用HSP90α抑制劑TAS-116特異性抑制HSP90AA1活性後,卵巢癌細胞的遷移和侵襲能力都顯著降低(圖7)。上述結果表明,CCN1和HSP90AA1很可能參與了高級別漿液性卵巢癌的腫瘤轉移過程,並可能作為卵巢癌的潛在治療靶點。
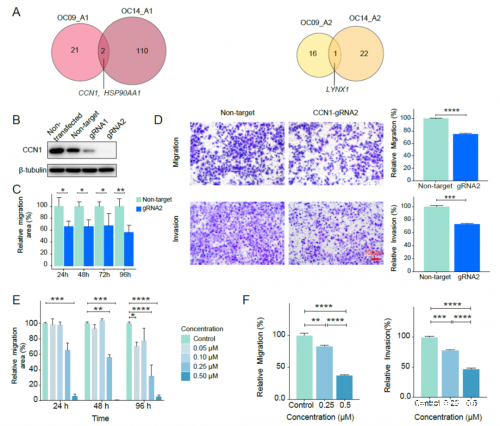
圖7. CCN1和HSP90AA1的功能驗證綜上,該研究首次以單細胞和單鹼基分辨率系統性地探索了高級別漿液性卵巢癌中基因組拷貝數變異、DNA甲基化組、染色質狀態組以及轉錄組等不同組學層面的分子特徵。綜合分析了高級別漿液性卵巢癌的分子變化規律,發現了CCN1、HSP90AA1等潛在治療靶點,有助於更深入地理解該疾病的分子特徵,為該疾病的診斷和治療提供理論依據。論文鏈接:https://aacrjournals.org/cancerres/article/doi/10.1158/0008-5472.CAN-21-3819/707741/Single-cell-dissection-of-the-multiomic-landscape