細胞工程突破!科學家開發無需病毒載體的CRISPR,一次可設計超過10億個細胞_風聞
中国生物技术网-中国生物技术网官方账号-2022-08-31 10:36
 CRISPR是細菌長期演化過程中的一種適應性“免疫系統”。當病毒入侵時,細菌可以捕獲外源遺傳物質的片段並將其整合到自身基因組的CRISPR序列中,隨後通過Cas核酸酶精準切斷病毒的DNA,從而抵禦病毒入侵。 自從十年前,兩位科學家首次證實CRISPR-Cas9可以在活細胞內編輯基因組以來,CRISPR便開創了自己的時代。越來越多的臨牀科學家投入到基於CRISPR-Cas9技術的活細胞療法中。CRISPR基因組工程在原代人類細胞中引入靶向序列替換或插入的能力在研究突變基因、糾正遺傳疾病和重新編程細胞治療方面已被證實具有巨大的前景。最近,基於CRISPR-Cas9的第一個治療應用已進入臨牀試驗階段。
CRISPR是細菌長期演化過程中的一種適應性“免疫系統”。當病毒入侵時,細菌可以捕獲外源遺傳物質的片段並將其整合到自身基因組的CRISPR序列中,隨後通過Cas核酸酶精準切斷病毒的DNA,從而抵禦病毒入侵。 自從十年前,兩位科學家首次證實CRISPR-Cas9可以在活細胞內編輯基因組以來,CRISPR便開創了自己的時代。越來越多的臨牀科學家投入到基於CRISPR-Cas9技術的活細胞療法中。CRISPR基因組工程在原代人類細胞中引入靶向序列替換或插入的能力在研究突變基因、糾正遺傳疾病和重新編程細胞治療方面已被證實具有巨大的前景。最近,基於CRISPR-Cas9的第一個治療應用已進入臨牀試驗階段。
然而,CRISPR-Cas9並非是完美的,仍面臨着諸多挑戰。例如,在經典CRISPR-Cas系統中,研究人員必須依靠病毒載體(不含致病成分的病毒外殼)將用於基因治療的DNA(DNA模板)帶到細胞中。因此,製造大量臨牀級病毒載體一直是細胞療法的主要瓶頸。此外,使用病毒載體的成本高昂且耗費資源;而且,研究人員也無法輕鬆控制傳統病毒載體在基因組中插入基因的位點。 2022年8月25日,發表在**《Nature Biotechnology》上的一項新研究中,來自格萊斯頓-加州大學舊金山分校基因組免疫學研究所所長Alex Marson領導的研究團隊開發改進版的CRISPR-Cas9基因編輯技術解決了上述問題,該方法不需要病毒載體即可非常高效地將長DNA序列精準引入細胞基因組中的位點,而且可以一次設計超過10億個細胞,這遠遠多於治療單個患者所需的細胞數量。該研究成果是向下一代安全有效的細胞療法邁出了一大步。 多年來,該團隊的目標之一就是以一種不依賴病毒載體的方式將冗長的DNA指令插入靶基因位點。Marson表示,使用非病毒基因工程方法的一個主要好處是不受成本、製造複雜性和供應鏈挑戰的限制。** 2015年,Marson團隊與CRISPR先驅Jennifer Doudna教授(2020年諾貝爾化學獎得主)實驗室合作,首次證明可以在沒有病毒載體的情況下將短DNA模板插入免疫細胞,並使用脈衝電場讓細胞的外膜更具滲透性。
多年來,該團隊的目標之一就是以一種不依賴病毒載體的方式將冗長的DNA指令插入靶基因位點。Marson表示,使用非病毒基因工程方法的一個主要好處是不受成本、製造複雜性和供應鏈挑戰的限制。** 2015年,Marson團隊與CRISPR先驅Jennifer Doudna教授(2020年諾貝爾化學獎得主)實驗室合作,首次證明可以在沒有病毒載體的情況下將短DNA模板插入免疫細胞,並使用脈衝電場讓細胞的外膜更具滲透性。
到了2018年,他們開發了一種不需要病毒載體的CRISPR-Cas9基因組靶向系統,允許在原代人類T細胞基因組的特定位點快速有效地插入更長的DNA序列(大於1kbp)的同時保持細胞活性和功能。
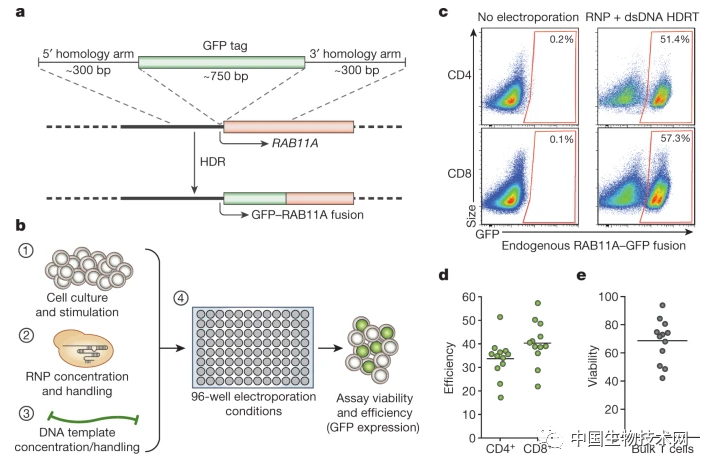 原代人T細胞中的高效非病毒基因組靶向
原代人T細胞中的高效非病毒基因組靶向
然後,在2019年,該團隊發現,通過使用一種可以與Cas9酶結合的改進版DNA模板,他們可以更有效地將新序列傳遞到靶基因位點。,但還需要更多的工作來提高工程化免疫細胞的產量,並使這一過程與未來細胞療法的製造兼容。
這些目標推動了當前的研究。現在,該團隊不僅開發了新的技術,還展示了該技術如何被用來生成具有抗擊多發性骨髓瘤(一種血癌)潛力的CAR-T細胞,以及改寫可能導致罕見遺傳性免疫疾病的基因序列。 眾所周知,DNA可以以單鏈或雙鏈的形式存在,而Cas9靶序列(CTS)附着在雙鏈DNA(dsDNA)上。由於高水平的雙鏈DNA模板會對細胞產生毒性,因此,老方法只能用於少量的模板DNA,從而導致效率低下。 該團隊發現,即使在相對較高的濃度下,單鏈DNA(ssDNA)的細胞毒性也較小。因此,在這項新研究中,他們描述了一種將修飾的Cas9酶連接在單鏈模板DNA上的方法,即只需在分子末端添加少量的雙鏈DNA。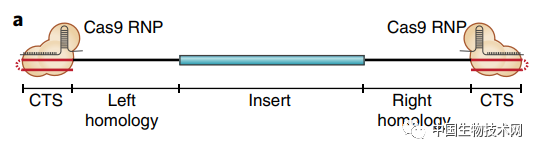 這給了科學家們一個平衡且兩全其美的方法。與較早的雙鏈方法相比,單鏈模板DNA可以使基因編輯的效率提高一倍以上。分子的雙鏈末端讓研究人員可以使用Cas9來增強非病毒載體進入細胞的能力。 在這項新研究中,**研究人員使用新的DNA模板生成了超過10億個靶向多發性骨髓瘤的CAR-T細胞,遠遠超過治療單個患者所需要的細胞數量。**CAR-T細胞是一種經過基因改造的免疫T細胞,可以有效地對抗特定的細胞或癌症。使用新的單鏈Cas9定向模板,大約一半的T細胞獲得了新的基因,並因此被轉化為CAR-T細胞。
這給了科學家們一個平衡且兩全其美的方法。與較早的雙鏈方法相比,單鏈模板DNA可以使基因編輯的效率提高一倍以上。分子的雙鏈末端讓研究人員可以使用Cas9來增強非病毒載體進入細胞的能力。 在這項新研究中,**研究人員使用新的DNA模板生成了超過10億個靶向多發性骨髓瘤的CAR-T細胞,遠遠超過治療單個患者所需要的細胞數量。**CAR-T細胞是一種經過基因改造的免疫T細胞,可以有效地對抗特定的細胞或癌症。使用新的單鏈Cas9定向模板,大約一半的T細胞獲得了新的基因,並因此被轉化為CAR-T細胞。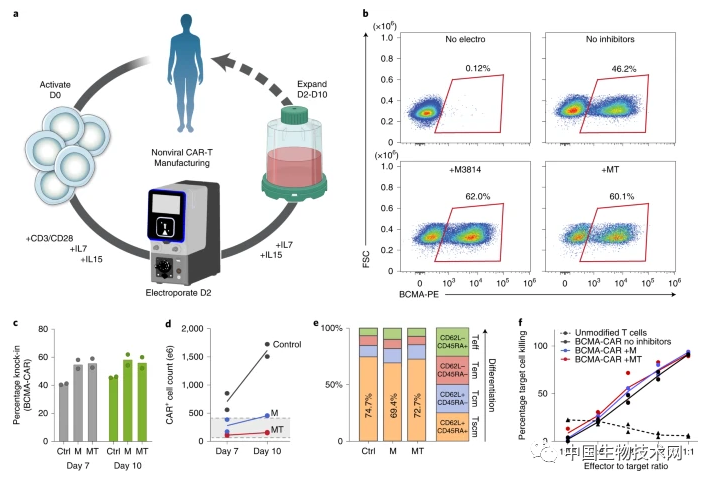 Marson表示,將DNA模板定位到基因組中的一個特定位置(TRAC位點)將提高CAR-T細胞的抗腫瘤效力。這種新的非病毒方法使他們可以更有效地實現靶向,這將加速下一代CAR-T細胞療法的發展。
Marson表示,將DNA模板定位到基因組中的一個特定位置(TRAC位點)將提高CAR-T細胞的抗腫瘤效力。這種新的非病毒方法使他們可以更有效地實現靶向,這將加速下一代CAR-T細胞療法的發展。
此外,該團隊首次表明,他們的方法可以完全替代與罕見遺傳性免疫疾病相關的兩個基因,即IL2RA和CTLA4基因。 在過去的研究中,科學家們已經證明可以在個別患者發生突變的IL2RA基因中替換一小片段。現在,該團隊證明,他們可以一次性替換整個IL2RA和CTLA4基因,這種“一刀切”的方法可以治療許多這類患者,而不必為每個患者的突變生成個性化模板。研究人員發現,用這種基因工程方法處理的細胞中,近90%獲得了健康版本的基因。 Marson表示,這種新方法有有望使新的細胞和基因療法更好、更快、更便宜。目前,該團隊正在推進CAR-T細胞治療和在IL2RA缺陷的患者中使用非病毒載體CRISPR技術的臨牀試驗。
論文鏈接: https://www.nature.com/articles/s41587-022-01418-8
https://doi.org/10.1073/pnas.1512503112
https://www.nature.com/articles/s41586-018-0326-5
https://www.nature.com/articles/s41587-019-0325-6