Cell:高脂肪飲食會“吃”掉腸道有益菌,罪魁禍首是糖!_風聞
中国生物技术网-中国生物技术网官方账号-2022-09-05 09:22
 眾所周知,肥胖是導致心血管疾病、中風、2型糖尿病等一系列代謝綜合徵的重大風險因素,而飲食在其中發揮了關鍵作用。也就是説,絕大部分的肥胖都是吃出來的。 此前廣泛的人類和動物研究證實,高脂肪飲食引發了一系列生理事件,並最終導致肥胖和肥胖相關的代謝疾病。近幾年,科學家們對這類疾病的後期病理生理學已經有了充分了解,並進行了廣泛的研究報道。
眾所周知,肥胖是導致心血管疾病、中風、2型糖尿病等一系列代謝綜合徵的重大風險因素,而飲食在其中發揮了關鍵作用。也就是説,絕大部分的肥胖都是吃出來的。 此前廣泛的人類和動物研究證實,高脂肪飲食引發了一系列生理事件,並最終導致肥胖和肥胖相關的代謝疾病。近幾年,科學家們對這類疾病的後期病理生理學已經有了充分了解,並進行了廣泛的研究報道。
然而,還有兩個重要的問題尚待解決,即:飲食如何啓動代謝疾病的病理事件?非脂肪膳食成分(如糖)又在其中發揮了什麼作用?
2022年8月29日,發表在**《Cell》上的一項最新研究中,來自哥倫比亞大學的研究團隊通過小鼠研究確定了構成代謝綜合徵風險的飲食和腸道微生物組因素,並揭示飲食、腸道菌羣與腸道免疫在調節代謝紊亂中的複雜相互作用。該研究強調,飲食與健康的腸道菌羣對於預防肥胖以及肥胖相關代謝疾病至關重要。** 
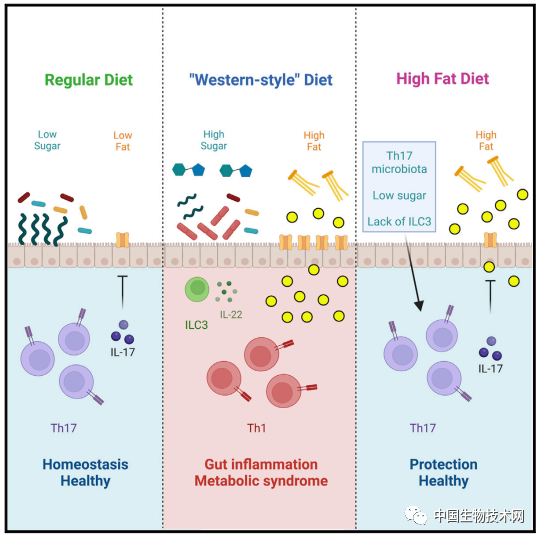 眾所周知,腸道菌羣與宿主健康息息相關。這個複雜的生態系統與腸道免疫共同調節着組織穩態。此前的研究發現,高脂肪飲食引發腸道菌羣組成發生改變,並誘導腸道炎症水平增加。膳食脂質被發現是這一過程的主要驅動因素,但所涉及的詳細機制及其對代謝疾病的影響還是未知的。 在這項新研究中,研究人員首先調查了典型的西式高脂肪飲食對小鼠腸道菌羣的影響。他們發現,與餵食低糖低脂飲食的小鼠相比,4周餵食高脂肪的小鼠出現了代謝綜合徵特徵,包括體重增加、胰島素抵抗和葡萄糖耐受不良。
眾所周知,腸道菌羣與宿主健康息息相關。這個複雜的生態系統與腸道免疫共同調節着組織穩態。此前的研究發現,高脂肪飲食引發腸道菌羣組成發生改變,並誘導腸道炎症水平增加。膳食脂質被發現是這一過程的主要驅動因素,但所涉及的詳細機制及其對代謝疾病的影響還是未知的。 在這項新研究中,研究人員首先調查了典型的西式高脂肪飲食對小鼠腸道菌羣的影響。他們發現,與餵食低糖低脂飲食的小鼠相比,4周餵食高脂肪的小鼠出現了代謝綜合徵特徵,包括體重增加、胰島素抵抗和葡萄糖耐受不良。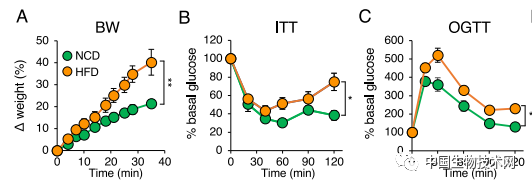 而且,動物的腸道菌羣組成也發生了重大改變。在小腸固有層中,高脂肪飲食導致輔助性T細胞17(Th17)細胞的比例和總數顯著減少,而其他細菌數量大幅增加。迴腸末端組織中IL-17轉錄本水平嚴重降低。
而且,動物的腸道菌羣組成也發生了重大改變。在小腸固有層中,高脂肪飲食導致輔助性T細胞17(Th17)細胞的比例和總數顯著減少,而其他細菌數量大幅增加。迴腸末端組織中IL-17轉錄本水平嚴重降低。 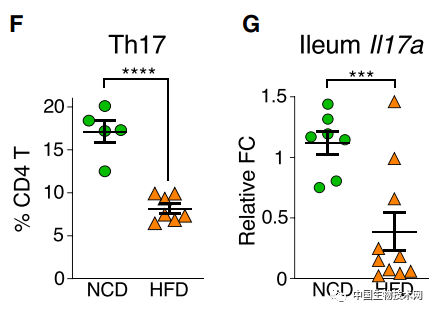 Th17細胞是一種能分泌白介素17(IL-17)的T細胞亞羣,在許多炎症性疾病中發揮致病的作用,同時也在以非炎症性方式維持腸道屏障完整性。IL-17在促進受損上皮細胞修復和保持腸道屏障完整性中發揮着重要作用。 該團隊此前的研究表明,在無特定病原體的小鼠中,Th17細胞主要由腸道共生菌分節絲狀菌(SFB)誘導。 隨後,研究人員調查了高脂肪飲食是否影響了SFB的水平。實驗結果顯示,高脂肪飲食造成更多脂肪進入迴腸末端,**導致動物糞便和迴腸黏膜中的SFB快速丟失;**而正常情況下,脂質的吸收主要發生在空腸。此外,SFB的減少要先於Th17細胞的減少。而且,剩餘Th17細胞的RORγt表達降低。轉錄因子RORγt在維持成熟Th17細胞譜系中發揮着關鍵調控功能。因此,這意味着Th17細胞功能普遍喪失。
Th17細胞是一種能分泌白介素17(IL-17)的T細胞亞羣,在許多炎症性疾病中發揮致病的作用,同時也在以非炎症性方式維持腸道屏障完整性。IL-17在促進受損上皮細胞修復和保持腸道屏障完整性中發揮着重要作用。 該團隊此前的研究表明,在無特定病原體的小鼠中,Th17細胞主要由腸道共生菌分節絲狀菌(SFB)誘導。 隨後,研究人員調查了高脂肪飲食是否影響了SFB的水平。實驗結果顯示,高脂肪飲食造成更多脂肪進入迴腸末端,**導致動物糞便和迴腸黏膜中的SFB快速丟失;**而正常情況下,脂質的吸收主要發生在空腸。此外,SFB的減少要先於Th17細胞的減少。而且,剩餘Th17細胞的RORγt表達降低。轉錄因子RORγt在維持成熟Th17細胞譜系中發揮着關鍵調控功能。因此,這意味着Th17細胞功能普遍喪失。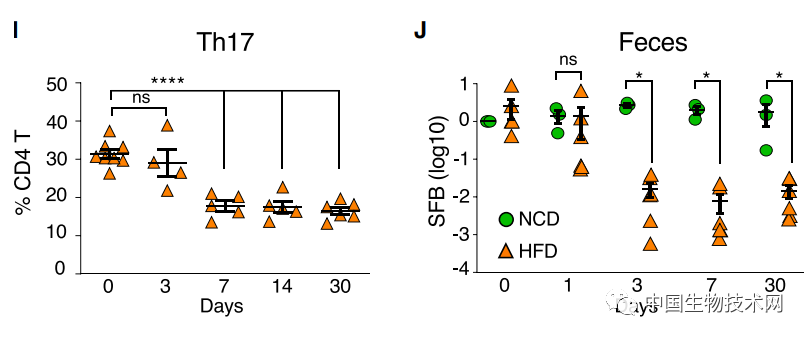 進一步的實驗表明,**受分節絲狀菌調節的腸道共生Th17細胞在預防代謝疾病、糖尿病和體重增加中發揮着核心作用。這些免疫細胞產生的分子可以減緩腸道對‘壞’脂質的吸收,從而減少腸道炎症。**此外,過渡到高脂肪飲食的小鼠內臟脂肪組織中的主要炎症免疫細胞亞羣還沒有發生顯著變化。這表明,腸道的炎症變化要先於肝臟和脂肪組織,腸道免疫穩態失衡是這些全身性疾病發病機制的重要初始步驟。 接下來,該團隊研究了導致保護性腸道共生Th17細胞喪失的膳食成分。眾所周知,高脂肪飲食中,除了脂肪以外,另一種成分是高糖含量。那麼這兩個成分哪一個對健康的影響更甚?
進一步的實驗表明,**受分節絲狀菌調節的腸道共生Th17細胞在預防代謝疾病、糖尿病和體重增加中發揮着核心作用。這些免疫細胞產生的分子可以減緩腸道對‘壞’脂質的吸收,從而減少腸道炎症。**此外,過渡到高脂肪飲食的小鼠內臟脂肪組織中的主要炎症免疫細胞亞羣還沒有發生顯著變化。這表明,腸道的炎症變化要先於肝臟和脂肪組織,腸道免疫穩態失衡是這些全身性疾病發病機制的重要初始步驟。 接下來,該團隊研究了導致保護性腸道共生Th17細胞喪失的膳食成分。眾所周知,高脂肪飲食中,除了脂肪以外,另一種成分是高糖含量。那麼這兩個成分哪一個對健康的影響更甚?
實驗結果顯示,糖的影響更惡劣。**在正常飲食中添加蔗糖水後,糖以劑量依賴性的方式清除了分節絲狀菌,保護性的Th17細胞也因此減少。**進一步研究表明,糖通過增加丹毒絲菌科成員Faecalibaculum rodentium的數量取代了分節絲狀菌。 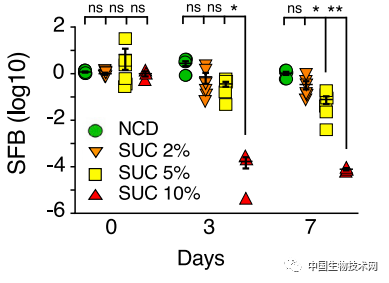 當研究人員給小鼠餵食無糖高脂肪食物時,即使攝入了相同數量的熱量,動物腸道的Th17細胞也沒有減少,從而避免了肥胖和出現糖尿病前期症狀。
當研究人員給小鼠餵食無糖高脂肪食物時,即使攝入了相同數量的熱量,動物腸道的Th17細胞也沒有減少,從而避免了肥胖和出現糖尿病前期症狀。
然而,不攝入糖分並沒有對所有小鼠都有幫助。那些一開始就沒有分節絲狀菌的小鼠即使攝入無糖飲食也沒能產生有益效果,它們依然會變得肥胖並患上糖尿病。因此,這意味着,一些流行的飲食干預措施,如無糖飲食,可能只對那些腸道中有特定菌羣的人有幫助。
研究人員表示,雖然人體內的分節絲狀菌和小鼠的存在差異,但人體其他腸道細菌可能具有相同的保護作用。
總之,這項研究表明飲食、腸道菌羣和腸道免疫調節宿主肥胖和代謝綜合徵。腸道的炎症變化要先於肝臟和脂肪組織,進而驅動了肥胖相關代謝疾病的病理變化。腸道免疫穩態失衡是這些全身性疾病發病機制的重要初始步驟。該研究還將蔗糖鑑定為大幅消耗誘導保護性Th17細胞的腸道共生菌的膳食成分;而這些腸道細菌可以通過調節腸道T細胞穩態來避免代謝疾病。因此,研究人員認為,這一機制可以作為2型糖尿病和代謝綜合徵的關鍵治療靶點。
論文鏈接: https://doi.org/10.1016/j.cell.2022.08.005