新冠疫苗什麼時候才能拯救人類?_風聞
新潮沉思录-新潮沉思录官方账号-2022-10-19 21:20
文 | 北方朔風
新冠疫情至今已經接近三年,應該説人類的各種技術,對於抗擊疫情,起到了很大的作用。如果説其中哪個技術對疫情改變最大,那無疑是疫苗技術了,而目前,有368個新冠疫苗在研/投入使用,**這在人類醫學史上面也是絕無僅有的。**疫苗明顯降低了新冠的死亡率,以至於去年的時候,西方國家甚至有不少人在幻想,疫苗可以使得疫情在今年年中結束。
當然,現實告訴我們,這個想法實在是過度樂觀了。現實十分嚴肅的告訴我們,我們需要新的,更好的新冠疫苗,來面對接下來的問題。今天我們來討論一下目前全球疫苗的研發情況。
當然,按有些人的認知,新冠已經不需要防治,只要接受感染就好,那在這些人的認知裏自然也是不需要研發疫苗的。但現實是全球主要國家們都在馬不停蹄的研發更有效的疫苗,進度表非常急迫,並且仍然沒有看到決定性的好消息。我們討論疫苗研發情況當然是基於我們正面臨着嚴重問題,以及疫苗是解決這個問題的重要方法的認知。
疫苗的五層作用
新冠疫苗的作用是什麼,在筆者之前看到的一篇綜述裏邊,作者把新冠疫苗的作用,分成了四個方面,**降低症狀率,降低重症/死亡率,降低傳染性,預防long covid。**這個分類方法筆者認為是有一定道理的,我們不妨從這四個角度,去分析一下這幾個方面。
第一個,降低症狀率,我們看到各種宣傳裏邊,説疫苗的有效率多少,一般指的都是這個數據。毋庸置疑,這是十分重要的一點,如果可以降低症狀率,可以明顯降低醫療系統負擔,應該説在疫情早期,疫苗這一點做的還是非常好的,但是隨着變種和時間的推移,疫苗的效果開始了明顯的滑坡。
一般認為,在防止症狀的過程之中,人體裏邊的中和抗體是扮演了主要的角色。所以在這方面,科學家的想法是誘導更廣譜,更持久的抗體,如果實在不行,那就反覆接種,來保持抗體濃度保持在較高的水平。應該説,這個方向算是被關注最多的方向。
第二個是降低重症和死亡率,這一點各個疫苗做的應該説都很好,只要三針下去,不管是什麼疫苗,什麼變種,死亡率都能下降超過百分之九十。學界的觀點認為,防重症的效果更多取決於細胞免疫,細胞識別病毒的機制,與抗體不同,所以病毒的突變,對於重症率影響相對有限,而細胞免疫也更加持久,所以現在的疫苗在這點已經做的很好了。如果想要繼續降低死亡率,通過減少病例降低整體的醫療系統負擔,是更好的選擇。
第三個是降低傳染性,應該説,現在的各個疫苗,在這方面的能力都差了點意思。從動物和人體研究的結果來看,即使是最優秀的疫苗,針對原版毒株,這方面的性能也都很難令人滿意。從其他傳染性學的實踐來説,如果可以誘導粘膜免疫,對於遏制新冠傳播應該會有很大的幫助,但是遺憾的是,**注射用疫苗似乎在這方面並沒有什麼優勢,似乎吸入/鼻噴/口服疫苗會更有優勢。**如果這方面能出現什麼突破,筆者相信,很多局面有可能得到徹底的改變。
第四個是預防long covid,其實現在的疫苗就可以降低long covid發生率,就是隻能降低一點點。如何去改進疫苗來預防long covid,這個問題其實學界也沒有把握,最好的辦法就是完全不感染,但是想要做到這點還是太困難。如果做不到這點,想要預防的話,就實在是很困難。
畢竟long covid的機理,我們現在的認識還是十分初級的,並且,這一系列後遺症,也不太可能是單一原因的。比如説最近有幾個證據十分粗糙的研究表示,long covid患者在注射疫苗之後,有超過一半的人羣症狀減輕,但是還有少數表示症狀加重。有的解釋認為,long covid與殘留在人體之內的少量病毒有關係,如果提高免疫水平,人體説不定可以清除這些殘餘,但是還有一些研究認為,long covid可能與自身炎症反應有關,提高免疫水平,可能會適得其反。
第五個是筆者自己補充的,那就是降低新冠變異發生概率,已經有研究證明,即使出現了突破性感染,接種過疫苗的人,排出的病毒突變數量也會低於沒有疫苗的人。而同時,免疫缺陷病人在新冠突變的機制裏邊扮演着重要的角色,已經有研究證明,給出現新冠慢性感染的免疫缺陷患者注射疫苗,可以使得慢性感染狀態消失。
因為全球感染基數太大,新冠變異速度仍然極快
不過,對於這些患者,疫苗效果不佳的問題,也需要克服。整體來説,**如果能降低新冠突變速度,也可以明顯降低公共衞生負擔。**不過要在這方面實現突破,除了提高疫苗效果之外,還要改善疫苗接種方式,同時使得疫苗更容易保存,保證第三世界國家有更高的接種率。
目前各路線疫苗的進展
我們理想之中的疫苗,肯定是這幾個方向都做到十分優秀的地步,如果每個方向都出現了突飛猛進的話,新冠疫情自然是可以結束了。但是理想和現實,總是存在着不小的距離,我們不妨從不同角度來分析一下,在我們可見的未來之中,各個疫苗技術路線,是否能滿足這些方面的需求。
多價疫苗
首先是傳統意義上的多價疫苗,簡單地説呢,就是幾種不同的毒株的抗原混合在一起。歐美最近批准的幾個疫苗,就是之前的疫苗的多價版本。從各種實驗結果來看,這樣的疫苗接種後產生的中和抗體水平,對於變異株,確實比舊版本有了更好的效果,只不過這個效果能否達到期望,依然需要打一個問號。比如説疫苗持久力的問題,恐怕這個方案難以解決。至於粘膜免疫的提高,傳統的多價疫苗顯然也力不能及。
但是不可否認,這個方案也有巨大的優勢,首先是可以利用之前成熟的方案,只要稍作調整,就可以快速生產;其次是在臨牀試驗上面,也快了很多,很多早期的實驗數據,可以直接拿來使用,而監管機構也對這樣的方案有更高的接受度。比如説現在美國批准的兩個二價新冠疫苗,是ba4/5的,而實際上這個方案,基本上沒有臨牀試驗的數據,如果選擇其他方案,fda自然是不可能給這麼大的優待的。
如果不出意外的話,在未來兩三年,這樣的疫苗應該會佔據主流的疫苗市場。而主要的討論方向就在於,如何選擇疫苗配方,比如説這次針對奧密克戎的二價疫苗,世衞組織傾向於ba1/2的抗原,但是fda傾向於ba4/5的配方,什麼樣的配方適合什麼樣的場景。而二價以上的疫苗,是否會達到更好的價值,也是值得討論的事情,為此已經有了一些相關的努力。
比如説我國神州細胞公司,就正在阿聯酋對四價的重組蛋白疫苗進行測試,而科興也在哥倫比亞開始了三價滅活疫苗的研究。以及,在新一代疫苗技術平台的基礎上面,如果監管給予足夠的支持,能否快速針對全新毒株設計出全新的疫苗?
然後是使用了新技術的多價疫苗,在許多研究裏邊已經證明,單純的混合,很多時候並不是多價疫苗最好的方案,如果要引導出來更廣譜更持久的疫苗,需要新的設計。比如説,加州理工學院有一個方案,利用其他蛋白,讓多種不一樣的rbd排列成為球體,在上面表達出來八種不同的抗原,在動物實驗之中,誘導出來了相當廣譜的抗體。

加州理工實驗的那個疫苗的示意圖
類似的設計還有不少,比如説有的公司的mrna疫苗,表達的s蛋白,不同區域實際上來自於不同的毒株,再比如説智飛生物的下一代疫苗方案,二聚體的rbd,一個來自奧密克戎毒株,一個來自於德爾塔毒株。這些創新設計,在誘導更廣譜的抗體上面,是存在不小的優勢的。
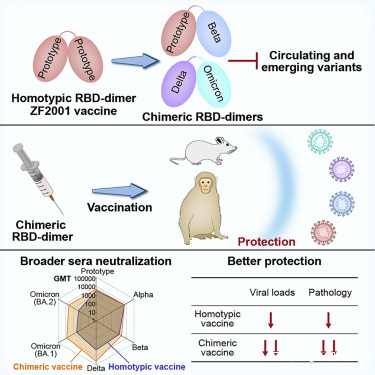
智飛正在做的嵌合疫苗的示意圖
除此之外,這類多價疫苗還使用了另一個思路,那就是利用了冠狀病毒其他毒株的抗原,比如説加州理工學院的那個疫苗項目,有很多抗原來自於其他冠狀病毒,這些病毒和新冠關係很近,但是幾乎不會感染人類。這可以誘導更加廣譜的疫苗。實際上這樣的思路在流感疫苗的研發之中就存在,利用一些不太可能感染人類的流感病毒和傳統流感病毒組合,試圖引導廣譜免疫。
應該説,無論是從理論還是早期實驗結果來説,這種思路的疫苗都有很大的前途,其中一部分疫苗的目標也很是高遠,不光是要預防新冠變異株,還想要預防未來可能出現的全新冠狀病毒。不過這方面的技術,成熟依然需要一段時間,而這個一段時間具體是多久,就算是傑出的科學家,也難以準確預計。短時間之內,可能難以大規模推廣。
廣譜中和抗體
還有一類試圖對抗變種的思路,是用新冠病毒上面的保守區域,去誘導廣譜的中和抗體。這無疑是很有難度的選項,新冠病毒最容易引導中和抗體的rbd和s1區域,因為受到了很大的選擇壓力,所以也是突變高發區,想要誘導高效的抗體,無疑是很挑戰技術水平的東西。
較為常見的思路,有在之前的重組蛋白疫苗基礎上面,使用全新的佐劑,來誘導更持久,更廣譜的抗體,比如説復旦的姜世勃教授就開發了一款佐劑,在動物實驗之中,它可以明顯提高蛋白疫苗的廣度和持久性,即使用原始毒株的rbd,也可以引導出來對奧密克戎病毒的中和能力,不過還需要更多的驗證。
而比較激進的思路,就是以劍橋大學的DIOSynVax項目為代表的這種,它試圖使用蛋白質結構學和計算生物學的結合,設計出來一種目前不存在,但是可以誘導出最優免疫性的新冠疫苗,這個平台可以在蛋白質,mrna,dna疫苗上面使用,並且未來可以拓展到其他病毒身上,如果實現,無疑會對疫苗研發產生巨大的改變,應該説是個非常志向高遠的計劃,但是難度也可想而知。
劍橋大學dios項目試驗用的無針注射器
還有一個方向,是用新冠病毒身上一些壓力很低,但是不擅長誘導中和抗體的區域來設計疫苗,這些區域受到了壓力無疑是很低的,而需要解決的問題則在於,這些區域免疫原性很低,誘導出來的抗體,很多時候只有結合能力,沒有中和能力,甚至部分研究還認為,這些抗體與ade的產生,存在複雜的關係,不過部分研究證明,這些區域在一定情況下,還是可以誘導出來中和抗體的,但是需要了解的地方,還是很多的。
此外,這些結構區域可能和細胞免疫有着更密切的關係,如果能提高細胞免疫的強度,對於對抗新冠疫情,也是一件好事情。但是同樣的,不確定因素實在是很多。
粘膜疫苗
**接下來要討論的是粘膜疫苗。應該説,粘膜疫苗在人類對抗傳染病的歷史上面,扮演了十分關鍵的角色。**脊髓灰質炎能被控制到現在的水平,這正是粘膜疫苗的功勞。首先發明的脊髓灰質炎疫苗,是滅活的注射疫苗,雖然這種疫苗可以有效的預防嚴重疾病,但是在預防脊髓灰質炎的傳播上面,難以達到理想的效果,並且早期因為技術問題,帶來了不小的副作用。
而美國醫生阿爾伯特薩賓發明了滅活疫苗,首先在蘇聯使用,效果得到了十分優秀的效果,於是美國這邊也加速了實驗過程,使得疫苗得以推廣,這才有了現在的脊髓灰質炎良好控制。而我國生產的版本,就是大家熟悉的糖丸(原版薩賓疫苗主要是滴劑口服,在歐美給小孩子吃的時候,常常滴在方糖上面)。
**所以,如果某種新冠粘膜疫苗的效果能有如此理想,那無疑是十分美好的事情。**但是理想歸理想,現實歸現實。目前為止,批准的大多數粘膜疫苗都是消化道疫苗,而針對呼吸道傳染病的疫苗,只有流感的,數據也算不上多理想。當然,這很大程度是流感本身的特性導致的。不過現實是,對於開發呼吸道粘膜疫苗,人類還是相當不熟練的。
目前為止,人類在其他疾病上面批准的粘膜疫苗,不是滅活的,就是減毒活病毒的。不過在新冠相關粘膜疫苗的研發之中,病毒載體疫苗佔了絕大部分,其中腺病毒載體疫苗是主要的技術方向,比如説我國康希諾公司研發的疫苗,就是基於複製缺陷的5型腺病毒載體,從注射劑拓展了吸入劑的使用。

康希諾吸入用的專用設備
這是個十分成熟的技術,被認為很適合粘膜疫苗設計,但是有個問題在於,腺病毒載體疫苗會受到腺病毒本身的影響,腺病毒是人類日常生活之中很容易感染的病毒,人體預存的免疫力,會影響腺病毒疫苗的效果。
為了解決這些問題,科學家開始從之前常見的腺病毒,轉向了一些人體不太感染的腺病毒,但是如果考慮到多次接種的問題,這個矛盾依然難以避免(俄羅斯的衞星5疫苗,兩針選擇了不同的腺病毒載體,一定程度也是考慮這方面的因素)。目前在實驗室階段,有研究試圖對腺病毒進行進一步操作,減少人體預存免疫力的影響。還有的項目,試圖使腺病毒載體疫苗有着一定程度的複製能力(目前的腺病毒載體疫苗都是複製缺陷型,不具備在人體複製的能力),來增強效果。
至於其他的病毒載體,部分應該説是很有潛力,也可以規避腺病毒載體的一些問題,但是成熟度就差了一些。以及,由注射疫苗轉向粘膜給藥,有哪些方面是可以進行優化,依然需要進行探索。
一般認為,蛋白本身並不適合作為粘膜疫苗的抗原,因為免疫原性不足,但是現在已經有實驗證明,在接種過疫苗的情況下,用單純的rbd就可以誘導出來一定程度的粘膜免疫,如果這個路線可以走通,相信粘膜疫苗會有更好的選擇,同時,部分研究暗示,mrna疫苗也可以選擇吸入路線。但是如果想要實現最好的效果,需要選擇一種遞送方式,來穿透粘膜。
目前有早期研究認為,特定的脂質可以實現這方面的遞送,如果可以實用化,那麼確實可以改變粘膜疫苗的現狀,不過類似技術的成熟度,顯然是相當之低的,但是這方面的進步,依然值得期待,畢竟可以規避病毒載體疫苗的很多問題。
除此之外,還有傳統一些的粘膜疫苗,也就是最傳統的減毒疫苗。在新冠疫苗的種種路線之中,減毒活疫苗的研究,數量是最少的。這倒也不奇怪,但是極少數減毒疫苗在粘膜免疫之中的潛力,依然值得關注,畢竟這是最類似自然免疫過程的,但是考慮到新冠病毒的傳染性和突變能力,不得不説這方面的研究是有一定風險的。不過現在已經篩選出來了一些減毒株,這些病毒感染人體的能力是野生的毒株的數千分之一,如果在必要的情況下,作為選項之一也未嘗不可。
具體什麼樣的路線最能優化粘膜免疫,需要實踐來證明,但是粘膜免疫的相關研究,依然有很多東西需要去彌補,我們對於粘膜免疫的基本原理,認識的水平是十分低下的。比如説,中和抗體可以較為簡單的進行測定,細胞免疫測定雖然沒有統一的標準,但是對於較大的實驗室來説,依然是可以測定的。
可是如何測定粘膜免疫的水平呢?是測定粘膜表面的iga水平,或者是細胞相關的水平,學界對此幾乎沒什麼標準,這對於研究粘膜疫苗來説,無疑是個相當嚴重的障礙,所以甚至有國外的疫苗公司,想要進行人體攻毒實驗,來直接測試效果。
所以,粘膜相關疫苗的開發,存在着巨大的不確定性。如果目前的腺病毒疫苗改成吸入就能帶來良好的粘膜反應,那麼明年可能就會實現粘膜疫苗的普及,如果需要全新的方式,時間要多長就不好説了。
當然,雖然粘膜疫苗開發起來難度不會小,但是回報理論上是相當豐厚的,從理論和實驗都足以證明,粘膜免疫對於降低新冠傳染性是相當有效的。新冠之所以對人類社會造成如此巨大的破壞,很大程度來自於它強大的傳染性,如果靠着粘膜免疫,把它的傳染性控制到流感水平,很多問題就不再是無解的。
同時,鼻腔,吸入或者是口服給藥,對於操作的專業性需要低了很多,不需要大量專業衞生人員就可以接種,甚至可以居家使用,這對於新冠疫苗持久性不足的問題也可以解決,每三個月吃一片藥或者是噴一噴鼻子,比每半年打一針可方便多了。而且每次接種的用量理論上也低於注射,這利於疫苗快速普及。
還有些相當小眾的路線,比如説針對免疫缺陷患者專門的新冠疫苗,倒也有不小的意義,不過按照那個新聞的説法,接受採訪的科研人員似乎表示,全球只有一兩個小組在做這方面的內容。此外,似乎還有在做動物新冠疫苗的研究,不過各種動物各不相同,人類的問題都還沒有很好解決,這也就遠不是重點了。
前景樂觀嗎?
這些不同的疫苗路線,究竟哪些可以給人類帶來最大的進步,筆者實在是難以預測,畢竟疫苗的開發過程之中,幾個氨基酸的優化,就有可能帶來十幾倍抗原性的改變。但是如果從技術之外的問題來説,筆者倒是認為,歐美市場應該還是幾個疫苗大公司佔盡優勢,這不單是資金與技術方面的優勢,還是審批方面的。
就在7月底的時候,輝瑞宣佈了一個新的二價疫苗的二期試驗,説是對於相關蛋白進行了修飾,以期待帶來更好的效果,這樣“微調”式的研發,對於大公司來説,無疑是可以最大程度的利用監管優勢,至於某些全新的路徑,很顯然在監管上面不會有什麼優勢。
具體的技術方向沒有説明,但是在和輝瑞開發疫苗的biontech公司的投資人相關ppt裏邊,他們表示在未來3-5年,每年會向機構申請5-10款不同新冠疫苗的申請,這很明顯是漸進式研發的趨勢。而同一ppt之中顯示,從長期來説,輝瑞和biontech似乎更看好通過t細胞加強,來解決新冠問題。
當然,大公司的技術實力是不差的,通過這種策略來實現技術迭代也是好的,但是在我們無法確定哪種路線最好的時候,大公司各方面的優勢,可能會影響新路線的發展。而大公司的路徑依賴,也註定不能覆蓋所有的技術方向。比如説通過納米粒子和病毒樣顆粒來實現一次性多種抗原的呈遞,這就是mrna技術難以完成的。
而同時,也有研究認為,mrna疫苗帶來的抗體水平降低的很快,是因為表達的抗原在人體細胞表面,而人體細胞表面積遠大於病毒表面積,這會使得識別相關的空間結構不一致,這個問題也是mrna技術短時間難以克服的問題。在我們現在的水平難以確定最優方向的情況下,百花齊放是最為有利的策略。
然而遺憾的是,事情似乎並不是完全如此發展,美國能快速生產出新冠疫苗,一定程度和特朗普政府在2020年3月批准的“曲速行動”有關,這個項目批准了一百多億美元和一系列政策支持,加速了美國的疫苗發展。然而今年,雖然拜登政府多次説了要有新一代疫苗,7月份的時候還召開了一個疫苗峯會,但是錢什麼的,是一個子都沒有給,現在給各種全新疫苗支持最多的,居然類似CEPI這樣的非政府機構,不得不這十分諷刺了。

無論是從經濟還是從政治角度,美國再花一百億,甚至是三五百億去支持下一代疫苗,都是穩賺不賠的選擇,美國政府不會差這三瓜兩棗,這對於經濟復甦或者是國際影響力,都是極為優質的投資,就連現在美國頭痛的通脹問題,説不定也能解決不少。而美國目前為止依然沒有這方面的舉動,甚至打算從今年開始,把美國的新冠防治,開始商業化,我對此只能感覺到十分遺憾了。
畢竟從生物技術的角度來説,美國依然引領世界,美國官方的這種態度,對於全球的下一代疫苗研發,是非常不利的,這顯然是對於世界人民的壞事。
不過,這倒是讓筆者想到了另一個事情,國內有不少人在上半年吹應該大規模引進外國疫苗,但是非常有趣的現實是,從性能的角度來説,輝瑞的疫苗相對於國產疫苗最大的優勢,是在德爾塔流行期間。到了奧密克戎流行的時候,反而大家都一樣了,都是隻防重症,為什麼偏偏在這個時候,吹的這麼多呢?
同時,國外除了輝瑞,還有莫德納的mrna疫苗,某些數據甚至更好一些,為什麼國內的相關企業,沒有嘗試引進呢?是不是因為,莫德納説到底是個新興企業,在中國市場,幾乎沒什麼利益佈局呢?選擇在這種問題上面造勢,是否是為了人民羣眾的利益呢?
從筆者的角度來説,倘若下一代歐美的某些疫苗,確實是好非常多,比如説可以有效的阻斷傳播,那麼出於對人民羣眾角度來講,那麼引進也是合情合理的。如果不是這樣的話,筆者實在是缺乏替醫藥企業思考的動力了呢。
如果樂觀一點來説,新冠疫苗依然是目前為止人類研發投入最多的疫苗,甚至有可能超過其他疫苗之和,而考慮到原始株疫苗優秀的數據,那麼在可見的未來,更好的疫苗肯定會不斷出現,只不過,這個時間是多久,更好能好到什麼樣的程度,依然存在明顯的變數,總體來説,在這個問題上面,保持謹慎樂觀是沒有錯的。
但是有些問題是更好的疫苗解決不了的,比如説反疫苗的人羣,而新冠帶來的一系列經濟社會問題,雖然新冠無疑是導火索,但是可能早在疫情之間幾十年,頑疾就已經深埋。説到底,技術解決方案,也只能解決技術問題啊。