發現PD-L1靶向嵌合開關受體增強CAR-T細胞對胸膜和腹膜轉移的療效_風聞
葆力医学观察-专注生物科研领域,趣味科普与行业干货齐飞2022-11-22 08:53
胸膜和腹膜轉移伴惡性胸腔積液(MPE)或惡性腹水(MA)常發生於晚期來源於肺、乳腺、胃腸道和卵巢的實體腫瘤患者。CAR-T細胞的區域傳遞是控制腫瘤在漿膜腔播散的一種新策略。然而,惡性積液構成了一種免疫抑制環境,可能誘導CAR-T細胞功能障礙。
2022年11月19日,四川大學王永生及李丹共同通訊在Signal Transduction and Targeted Therapy(IF=38)在線發表題為“A PD-L1-targeting chimeric switch receptor enhances efficacy of CAR-T cell for pleural and peritoneal metastasis”的研究論文,該研究表明PD-L1靶向嵌合開關受體可以增強CAR-T細胞對胸膜和腹膜轉移的療效。該研究證明了MPE/MA的細胞和非細胞成分都顯著抑制了傳統的第二代CAR-T細胞的抗腫瘤細胞毒性,這主要是由於MPE/MA環境中CAR-T細胞增殖和細胞因子產生的損害。有趣的是,作者發現PD-L1在新鮮分離的MPE/MA細胞上廣泛表達。基於這一特性,一種新型PD-L1靶向嵌合開關受體(PD-L1.BB CSR)可以與PD-L1結合,將抑制信號轉換為附加的4-1BB信號。當與第二代CAR,PD-L1共表達時。
BB CSR修飾的CAR-T細胞在培養基和MPE/MA環境中表現出優越的適應性和增強的功能,在異種移植模型中導致胸膜和腹膜轉移瘤的快速和持久的根除。進一步的研究發現,T細胞激活、增殖和細胞毒性相關基因表達升高,作者確認PD-L1單鏈抗體和4-1BB胞內結構域是PD-L1的兩個重要組成部分。BB和CSR,都是CAR-T細胞功能改善的必要條件。總之,該研究揭示了PD-L1.BB CSR修飾的雙靶向CAR-T細胞的臨牀應用。基於該研究,一項I期臨牀試驗在胸膜或腹膜轉移患者中啓動(NCT04684459)。

在過去的幾年裏,細胞毒性和免疫治療藥物的局部給藥已成為一種有前途的治療方式的胸膜和腹膜轉移。值得注意的是,最近的一項I期臨牀試驗報告了區域遞送間皮靶向嵌合抗原受體(CAR)-T細胞與抗程序性死亡受體-1(PD-1)藥物派姆單抗聯合治療惡性胸膜疾病有良好的抗腫瘤療效和耐受性。儘管CAR-T細胞在血液系統惡性腫瘤中取得了顯著的成功,但在實體腫瘤中效果卻差得多。更重要的是,某些類型癌症患者的術後復發通常侷限於胸膜或腹膜腔,例如惡性間皮瘤、肺癌、胃癌,尤其是卵巢癌。因此,局部輸注CAR-T細胞可能為這些患者提供有希望的選擇。
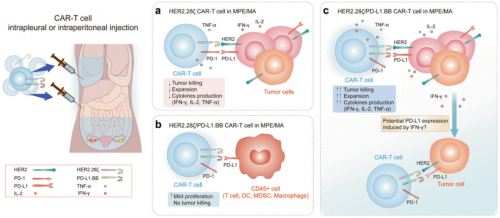
CAR-T細胞在胸膜/腹膜腔的虛擬治療方案(圖源自Signal Transduction and Targeted Therapy )然而,當CAR-T細胞被注入胸腔或腹膜腔治療轉移性腫瘤時,由於MPE/MA難以完全排出,且含有高水平的免疫抑制細胞因子和細胞,CAR-T細胞必須適應複雜的免疫抑制環境,並經常會遇到惡性積液。此外,多項研究發現MPE/MA可誘導腫瘤細胞和免疫細胞過表達程序性死亡配體1 (PD-L1),而PD-L1與不良預後密切相關。回顧性研究表明,在PD-L1≥1%的非小細胞肺癌(NSCLC)以及dMMR/MSI-H轉移性結直腸癌和胃癌中,PD-L1抑制劑的療效被MPE/MA顯著削弱,導致PFS和OS縮短。不良結果可歸因於MPE/ MA誘導的效應T細胞功能障礙。總之,這些報告強調了基於環境的CAR-T細胞優化的必要性。在本研究中,設計了一種新型PD-L1.BB CSR修飾的雙靶向CAR-T細胞系統,解決了MPE/MA伴免疫抑制胸膜和腹膜轉移環境的挑戰。這種治療策略顯著提高了CAR-T細胞的適應性,並顯示出臨牀轉譯的巨大潛力。由於腫瘤細胞和表達PD-L1的腫瘤相關免疫細胞可以在各種腫瘤微環境中觀察到,雙靶向CAR設計可能為實體腫瘤中的CAR-T細胞治療策略提供廣泛的解決方案。原文鏈接:https://www.nature.com/articles/s41392-022-01198-2