新冠免疫,男女有別_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!2022-12-20 09:08

撰文 | Catherine Offord
編譯 | XZ
全球新冠大流行到現在已持續近三年,在這場人類與病毒的戰爭中,男女之間對抗病毒的差異也逐漸清晰。早在2020年2月,也就是新冠大流行暴發的初期,研究人員就觀察到,儘管男性和女性感染新冠病毒的人數相接近,但男性似乎更有可能死於這種疾病[1]。
隨着新冠病毒病的病例不斷增長,這種差異性的證據也不斷顯現。根據非洲人口與健康研究中心(APHRC)的數據顯示[2],儘管世界各國對於新冠疫情的統計數據差異很大,但從整體來看,男性患者住院的可能性比女性患者高20%左右,並且一旦住院,男性更有可能需要重症監護,甚至可能死亡。
“性別不同導致免疫功能差異化”這個議題之前並不受人關注,但在過去幾年裏,這一觀念已經在研究界佔據了一席之地。例如,對2003年SARS和2013-2014年MERS暴發數據的分析表明[3, 4],男性患者的死亡風險高於女性。然而另一方面,自身免疫疾病如紅斑狼瘡、多發性硬化症和類風濕性關節炎等,則在女性中更為普遍。這些疾病被認為是由抗病毒免疫途徑的過度激活引起的,因此,免疫激活也就像硬幣一樣存在兩面性,有好也有壞。
二十多年來,霍普金斯大學彭博公共衞生學院的生物學家Sabra Klein一直在研究病毒感染的免疫反應,並表示新冠疫情正在幫助我們揭示傳染病生物學中的一個重要事實,即,病毒和其他病原體對女性和男性的影響是不相同的,前者具有兩條X染色體,而後者具有一條X染色體和一條Y染色體,這些差異的體現可能均需要從生物學角度來探索。
免疫反應中的性別差異
早期,研究人員在研究哺乳動物免疫系統時,發現雌性面對病毒感染時產生的免疫反應往往高於雄性,這種差異在先天免疫反應中尤為明顯。
德國漢堡Heinrich Pette研究所的免疫學家Marcus Altfeld的團隊長期專注於研究toll樣受體7(TLR7)。這是一種能識別並結合病毒單鏈RNA的蛋白質,也是病毒入侵細胞的早期預警信號。早在2009年,當時還在哈佛醫學院的Altfeld和他的同事們觀察到[5],當面對少量艾滋病毒RNA的刺激時,女性中攜帶TLR7的漿細胞樣樹突狀細胞(pDC)產生的干擾素明顯多於男性;此外,與男性相比,女性中的中性粒細胞(具有吞噬作用)對I型干擾素(一種由免疫細胞釋放的細胞因子)信號也更加敏感[6]。
不僅如此,近幾年研究還發現,適應性免疫也存在這種差異。例如, Klein用流感疫苗實驗研究小鼠對免疫刺激的反應[7],發現雌鼠往往產生更高的中和抗體反應。同時,也有多項研究[8]發現,女性(包括兒童和成人)的輔助性T細胞數量高於男性,這種細胞能夠促進大量適應性免疫系統的激活。
Tips
先天免疫反應,是指機體對進入體內的抗原物質的一種無選擇性的排斥、清除功能。
適應性免疫,又稱特異性免疫,是一種經由與特定病原體接觸後,產生能識別並針對特定病原體啓動的免疫反應。
女性免疫反應更強,可能有助於對抗體內的病毒數量,例如在艾滋病毒感染後的頭幾年,女性的病毒載量往往比男性低得多。此外,接種流感、黃熱病、登革熱等其它病毒疫苗後,女性似乎比男性產生了更好的保護性抗體反應[9]。但是,從健康角度來看,事情還有另一面:這種過度活躍的免疫反應也可能使女性更容易患自身免疫性疾病。
面對新冠病毒時的免疫性別差異
在過去的一年中,許多醫學研究報告稱[10],男性比女性更有可能死於由新型冠狀病毒引起的新冠病毒病。儘管各國的疾病統計數據有很大差異,但從生物學角度看,出現這種免疫差異似乎也是合理的。
下面就一起來看下,在面對新冠病毒感染時,男女之間的免疫差異性體現在哪裏。
病毒入侵
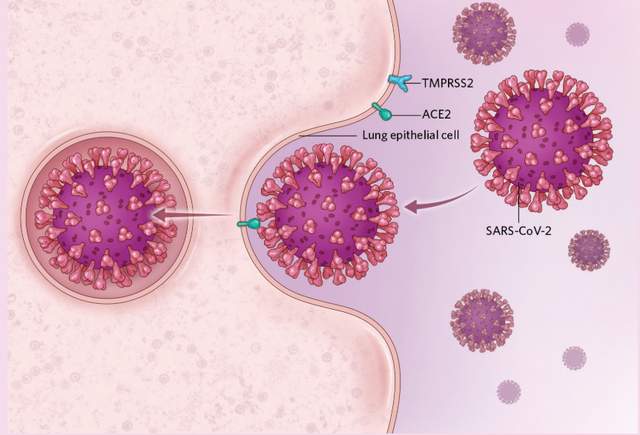
新冠病毒通過與人體細胞膜蛋白ACE2和TMPRSS2結合,從而進入人體細胞。這兩種膜蛋白在男女中的表達有所差異,其中ACE2的表達可能被雌激素下調,而TMPRSS2卻能被雄激素上調,這種調控結果可能會導致男性存在更大的感染風險。
感染早期反應
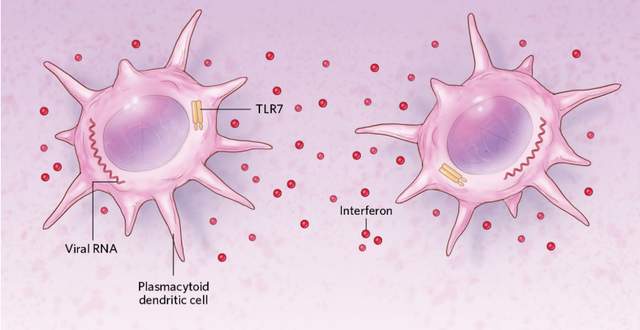
病毒進入人體後被漿細胞樣樹突狀細胞(pDC)吞噬,之後病毒的RNA被細胞中的蛋白質TLR7識別並結合,pDC細胞也隨之被激活,分泌抗病毒因子(干擾素)。由於TLR7是由X染色體編碼的,而女性有兩條X染色體,故女性產生的免疫反應也更大;此外,女性的雌激素也可使pDC細胞等免疫細胞的活性增強。
先天免疫
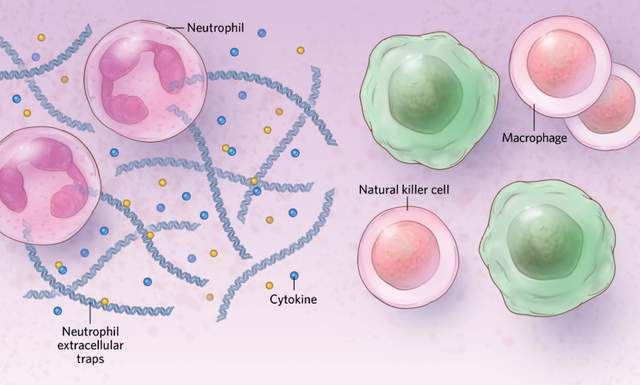
在參與先天免疫的細胞中,如中性粒細胞,面對病毒感染時,女性比男性表現出更高的活性。這些細胞可以受到性激素的調節,與男性相比,女性的這些細胞可能具有更成熟的表型,能夠更好地應對病毒感染。此外,其他免疫細胞,如自然殺傷細胞(NK細胞)和巨噬細胞,也顯示出性別差異,這或許有助於解釋女性中出現更強免疫反應的原因。
適應性免疫
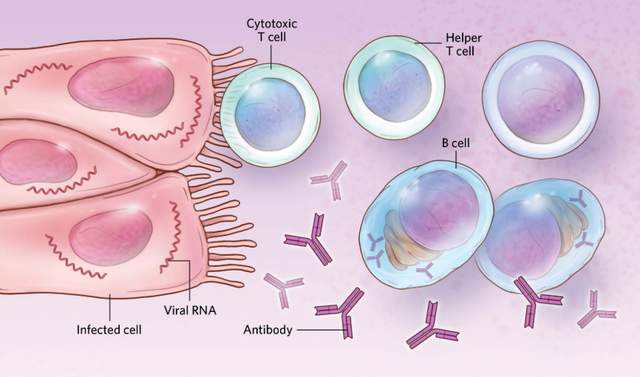
病毒進入人體細胞之後,除了啓動先天免疫之外,還會啓動特異性免疫(適應性免疫)。此時,被感染的細胞會將病毒抗原呈遞給T細胞和B細胞,引發T、B細胞免疫反應。其中T細胞會分化為TH細胞(輔助性T細胞,可輔助激活B細胞)和CTL細胞(細胞毒性殺傷T細胞,殺傷受感染的細胞),而B細胞在TH細胞的輔助作用下,也會分化成漿細胞,從而產生針對病毒抗原的抗體。有研究表明[11],在面對新冠病毒感染時,女性產生的抗體高於男性並且T細胞響應也更強。
免疫性別差異是怎樣產生的?
近些年來,隨着對免疫性別差異的研究深入,科學家漸漸地將這種差異歸因於性激素濃度的變化,即,男性主要產生睾酮等雄性激素,女性主要產生雌激素和孕酮。
某些研究可以支持這一觀點。有人發現[12],提前使用雌激素刺激細胞,可以降低細胞被艾滋病毒入侵的可能性。此外,與男性免疫細胞相比,女性中性粒細胞具有更成熟的表型,能更好地對干擾素刺激做出反應,並且使用雌二醇(最普遍的雌激素類型)來處理未成熟的中性粒細胞,可將其表型推向成熟[6]。進一步的證據則發現,女性絕經後患某些疾病的風險會發生變化[13],例如,絕經後婦女對流感疫苗的免疫反應弱於絕經前婦女。
類似的情況也發生在新冠病毒感染中。發表在medRxiv上的一項研究表明[14],在相同年齡段中,絕經後的女性比絕經前的女性更容易被新冠病毒感染,並且可能引發更嚴重的症狀;同時,研究還指出,45歲以下服用含雌激素避孕藥的女性比沒有服用此類避孕藥的女性其住院的可能性更低,這似乎意味着雌激素可能有助於女性免受病毒感染。
儘管激素可能起着重要作用,但男女之間最根本的差異還是性染色體不一樣。女性有兩條X染色體,一條X通常在發育早期被沉默或失活。但在2018年,圖盧茲INSERM病理生理學中心主任Jean-Charles Guery及其同事的研究發現[15],位於X染色體上的TLR7基因在女性和患有克氏綜合徵(XXY)的人中以某種方式逃脱了失活,這使得女性表達TLR7蛋白的能力強於男性,也就意味着女性在面對病毒感染時有更強的免疫反應,但代價是患自身免疫行疾病的風險也更高。
為什麼要研究免疫性別差異?
儘管新冠疫情推動了免疫性別差異的研究,但仍存在一些爭議的地方。如預印本的一項研究表明[16],在新型冠狀病毒感染中,抗體反應的性別差異可能沒有其他流感病毒明顯。對300多名輕症患者的血液測試表明,男性可能比女性產生更多的抗體來應對病毒。這一結論似乎又與先前描述的情況相反,這讓一些研究人員開始懷疑自己的結論。
情況到底是怎樣的?
事實上,免疫反應的差異並不只是受性別影響,年齡似乎也起到一定作用。美國國立衞生研究院(NIH)發起了一項研究[17],試圖梳理年齡和性別等因素對新冠肺炎的影響,以及瞭解其他與性別有關的因素——如人的行為(吸煙、喝酒等)——和不同的健康狀況是否也會引發不同的新冠感染症狀。
誠然,每個人或多或少都會存在一些差異(不只是性別差異),在面對疾病或接受治療時,所引發的反應也是有所不同的。當前,大多數人都在談論個性化治療,但迄今為止,沒有一種個性化治療在大多數傳染病的治療中取得進展,更不用説疫苗接種或其他預防策略了。
或許,將人羣分為男性和女性,並優化治療策略,才是個性化治療的開端。因此,正確理解這些差異將是人類邁向精確醫療的關鍵一步。
參考文獻
[1] Mobaraki, K., Ahmadzadeh, J. Current epidemiological status of Middle East respiratory syndrome coronavirus in the world from 1.1.2017 to 17.1.2018: a cross-sectional study. BMC Infect Dis 19, 351 (2019).
[2] https://globalhealth5050.org/the-sex-gender-and-covid-19-project/
[3] J. Karlberg, D. S. Y. Chong, W. Y. Y. Lai, Do Men Have a Higher Case Fatality Rate of Severe Acute Respiratory Syndrome than Women Do?, American Journal of Epidemiology, Volume 159, Issue 3, 1 February 2004, Pages 229–231
[4] Alghamdi I, Hussain I, Almalki S, Alghamdi M, Alghamdi M, El-Sheemy M. The pattern of Middle East respiratory syndrome coronavirus in Saudi Arabia: a descriptive epidemiological analysis of data from the Saudi Ministry of Health. Int J Gen Med. 2014;7:417-423
[5] https://www.nature.com/articles/nm.2004
[6] https://www.pnas.org/doi/10.1073/pnas.2003603117
[7] Lorenzo, M. E., Hodgson, A., Robinson, D. P., Kaplan, J. B., Pekosz, A., & Klein, S. L. (2011). Antibody responses and cross protection against lethal influenza A viruses differ between the sexes in C57BL/6 mice. Vaccine, 29(49), 9246–9255.
[8] https://www.nature.com/articles/nri.2016.90
[9] Aaby, P., Benn, C.S., Flanagan, K.L. et al. The non-specific and sex-differential effects of vaccines. Nat Rev Immunol 20, 464–470 (2020).
[10] Takahashi, T., Ellingson, M.K., Wong, P. et al. Sex differences in immune responses that underlie COVID-19 disease outcomes. Nature 588, 315–320 (2020).
[11] 11. Wenham, C., Smith, J. & Morgan, R. COVID-19: the gendered impacts of the outbreak. Lancet 395, 846–848 (2020).
[12] Rodriguez-Garcia, M., Biswas, N., Patel, M. V., Barr, F. D., Crist, S. G., Ochsenbauer, C., Fahey, J. V., & Wira, C. R. (2013). Estradiol reduces susceptibility of CD4+ T cells and macrophages to HIV-infection. PloS one, 8(4), e62069.
[13] Potluri, T., Fink, A.L., Sylvia, K.E. et al. Age-associated changes in the impact of sex steroids on influenza vaccine responses in males and females. npj Vaccines 4, 29 (2019).
[14] https://www.medrxiv.org/content/10.1101/2020.07.30.20164921v3
[15] https://www.science.org/doi/10.1126/sciimmunol.aap8855
[16] https://www.medrxiv.org/content/10.1101/2020.11.12.20230466v1.full
[17] https://www.cancer.gov/research/key-initiatives/covid-19/coronavirus-research-initiatives/serological-sciences-network
本文經授權編譯自the-scientist.com,原標題為Sex Differences in Immune Responses to Viral Infection