2021年度觀察|內卷時代,創新藥加速出海

(文/觀察者網 李鵬濤 編輯/馬友友)揮別2021,回首又見國內新藥取得空前發展。在這一年中,“創新”無疑是醫藥圈的C位關鍵詞。
國金證券研報顯示,2021年中國國家藥監局(下稱:NMPA)共批准了91款新藥上市,創造了歷史新高。其中,獲批的國產創新藥為48款,進口創新藥為43款。
觀察者網注意到,國內的新藥開發明顯“卷”起來了。《報告》指出,目前我國臨牀試驗在研的生物創新藥大部分為抗體類藥物,且靶點集中度高,同質化競爭激烈。
不過,在過去的一年中,我們見證了國內第一款CAR-T、ADC等藥物的問世,以及新冠疫苗、特效藥產業實現從0到1的突破。
創新藥開啓“內卷”模式
回顧2021年,在醫藥評審新政密集出台、集採等政策環境倒逼下,我國醫藥行業研發支出持續快速上升。
同花順ifind數據顯示,2015年A股上市的醫藥企業研發支出總規模僅為189億元,而在2020年醫藥企業的研發支出總規模達到690億元,5年間年複合增速達29%。
2021年前三季度,80%以上的A股上市醫藥企業研發投入總額同比有所增加。其中,研發投入超10億元有6家,包括恆瑞醫藥、復星醫藥、邁瑞醫療、君實生物、上海醫藥、科倫藥業。
隨着研發投入增長,國金證券研報顯示,2021年國產創新藥獲NMPA批准上市的新藥共計91款,其中國產創新藥48款,首次超過了同年獲批的進口創新藥43款。與往年數據相比,2017年至2020年獲批創新藥數量分別為61款、76款、64款和69款,僅2017年進口創新藥獲批數量(53款)明顯高於國產創新藥(8款)。
與此同時,去年11月國家藥監局藥審中心發佈《中國新藥註冊臨牀試驗現狀年度報告(2020年)》顯示,藥審中心2020年完成新藥臨牀試驗申請審評1561件,較2019年增長55.94%;完成新藥上市申請審評289件。
雖然我國新藥臨牀試驗的數量較往年已大幅增加,但《報告》指出,藥物靶點和適應症領域分佈較為集中,顯示我國藥物臨牀試驗發展存在同質化的問題。
上述報告顯示,2020年藥物臨牀試驗共登記2602項,其中藥物品種的前10靶點為PD-1、CYP51A1、VEGFR、PD-L1、DNA、EGFR、microrubule、HER2、GLP-1R、JAK1,總品種數量多達389項,佔比超10%。
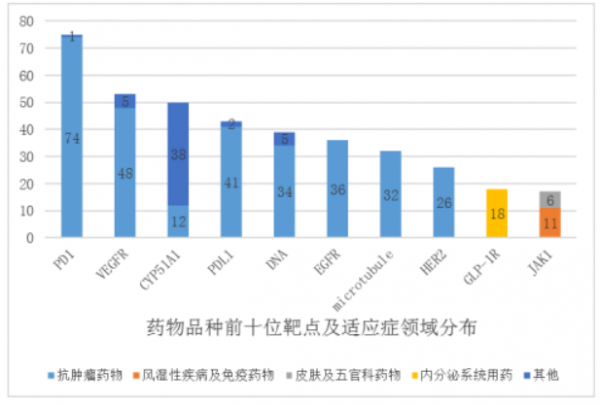
從臨牀試驗數量看,上述前10靶點也很集中,其中PD-1、VEGFR、PD-L1等靶點的品種開展的臨牀試驗均超過60多項,PD-1靶點的臨牀試驗的數量將近100項。
從適應症看,臨牀試驗主要集中在抗腫瘤和抗感染等領域,生物藥和化藥臨牀試驗適應症都以抗腫瘤為主,分別佔各臨牀試驗總體的42.1%和47.3%。
從零到一,精準創新
值得一提的是,2021年國內一些前沿技術的突破引發行業關注。
2021年3月,NAMP批准華昊中天的優替德隆NDA,用於治療復發轉移性晚期乳腺癌。作為國內首個上市的埃博黴素類抗腫瘤藥物,該藥結束了除紫杉醇外近30年無突破性化療藥物的局面。兩天後,榮昌生物推出全球首個治療系統性紅斑狼瘡的“雙靶”生物藥泰它西普,這是近60年來該領域的一大革新。
同年6月,NMPA批准復星凱特的CD19靶點自體CAR-T細胞治療產品阿基侖賽注射液上市,用於成人復發或難治性大B細胞淋巴瘤。三個月後,NMPA又批准了藥明巨諾的CD19靶點的同款適應症CAR-T產品。
資料顯示,CAR-T治療屬於免疫治療的一種,將工程化T細胞注入患者體內治療癌症。然而跟隨CAR-T產品獲批喜悦而來的,是一張對於大多數中國家庭都難以支付的天價賬單。據瞭解,阿基侖賽注射液未經官方確認的網傳價格為120萬元,同時該產品在去年12月未能進入醫保目錄談判環節。
頭豹研究院分析認為,中國CAR-T療法市場規模將由2021年的2億人元升至2025年的80億元,未來隨着更多的CAR-T產品獲批,預計2023年市場將達到289億元。
上述同期,榮昌生物的ADC藥物獲批上市,用於至少接受過2個系統化療的HER2過表局部晚期或轉移性胃癌(包括胃食管結合部腺癌)患者的治療,是我國首個自主研發的ADC新藥。隨後兩個月,榮昌生物又創下一項紀錄,以26億美元授權西雅圖基因公司開發和商業化其ADC新藥。
此外,在新冠疫情的“持久戰”中,新冠疫苗和藥物突破依舊是人們關注的熱點。在國內,以滅活疫苗為主,目前有條件獲批或緊急使用的共計7款疫苗,其中6款均在2021年獲批上市。
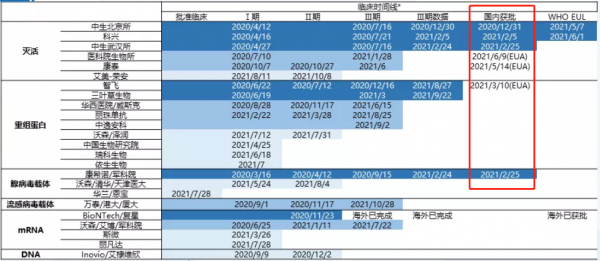
截至2021年12月31日,國家衞健委通報,全國累計新冠疫苗接種已達28.35億次;截至同年12月28日完成全程接種人數超12.07億人,至此我國疫苗接種率已達85.64%。
目前,世界衞生組織在全球範圍內發佈緊急使用清單疫苗有10款,其中包含2款我國生產的滅活疫苗,分別為科興和中生北京所生產的疫苗。迄今為止,我國已向120多個國家和國際組織提供近20億劑疫苗,佔中國以外全球疫苗使用總量的三分之一,成為對外提供疫苗最多的國家。
在mRNAy疫苗領域,我國仍處於研發階段。目前,艾博生物和斯微生物兩家的mRNA疫苗處於3期臨牀。除此之外,在國內未獲批的復星醫藥與德國BioNTecH公司合作研發的mRNA疫苗復必泰已在全球約150個國家和地區獲批使用。2021年,復星醫藥已向台灣運抵1333萬劑mRNA新冠疫苗。
在新冠藥物方面,2021年12月8日,NMPA應急批准騰盛博藥的安巴韋單抗/羅米司韋單抗的聯合療法,用於治療輕型和普通型且伴有進展為重型高風險因素的成人和青少年新冠患者。這一療法被稱為“首個國產新冠特效藥”。
此外,在國內多款新冠藥物正在競速。邁威生物、神州細胞的新冠中和抗體處於II/III期臨牀;百濟神州、丹序生物的BGB-DXP593處於國際多中心II期臨牀,DXP-604處於國內I期臨牀。
從資金方面來看,興業證券預測,治療新冠的中和抗體藥物的商業化市場空間可達69億美元至146億美元。
而對於未來創新藥將走入何方,國盛證券認為,我國的創新藥市場在當下已經慢慢從“泛泛創新”進入到“精選優質創新”的時刻。單抗熱門靶點未來同質化競爭將持續白熱化,同質化產品將逐漸失去競爭力,新技術、稀缺的技術平台、差異化的治療領域、創新的給藥方式等都可能會給企業帶來更好的競爭格局,有技術沉澱的公司有望脱穎而出。
本文系觀察者網獨家稿件,未經授權,不得轉載。