第七批國家組織藥品集採啓動,涉及58個品種
None
昨日,上海陽光醫藥採購網發佈《關於開展第七批國家組織藥品集中採購相關藥品信息填報工作的通知》(以下簡稱《通知》),自2月18日起,聯合採購辦公室開展第七批國家組織藥品集中採購相關藥品信息填報工作。
根據《通知》,此次國採共涉及58個藥品品種,208個規格,覆蓋奧美拉唑注射劑、美託洛爾緩釋劑型、美羅培南注射劑等市場銷售規模過億元的大品種,涉及的治療領域包括心血管、神經系統、糖尿病等。值得一提的是,本次集採藥品品種中注射劑達27種,佔比近47%。

《關於開展第七批國家組織藥品集中採購相關藥品信息填報工作的通知》圖自上海陽光醫藥採購網
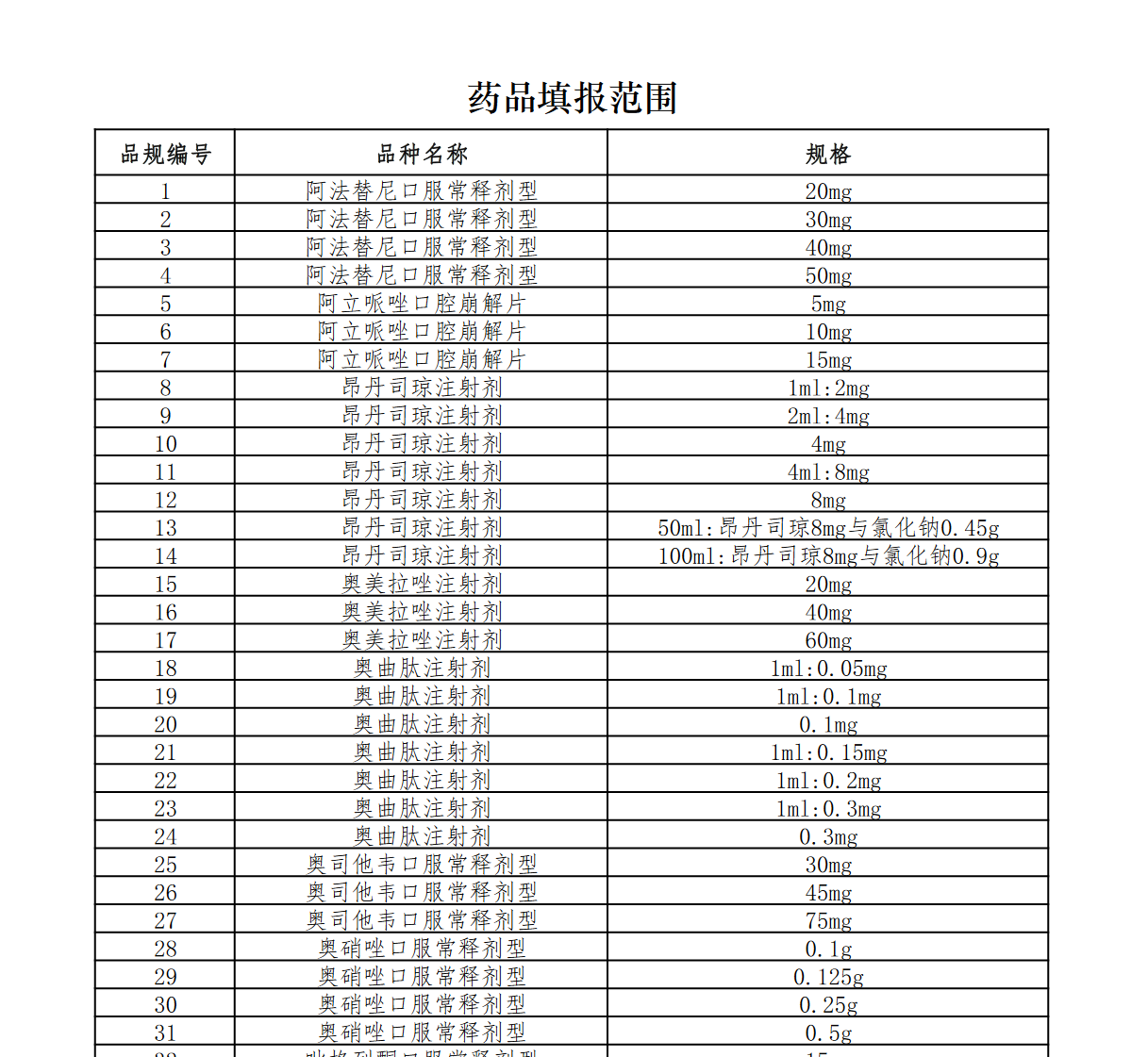
藥品填報範圍截圖
通知全文如下:
關於開展第七批國家組織藥品集中採購相關藥品信息填報工作的通知
各藥品相關企業:
為做好第七批國家組織藥品集中採購工作,進一步優化工作流程,建立常態化工作機制,自2022年2月18日起,聯合採購辦公室開展第七批國家組織藥品集中採購相關藥品信息填報工作,現將有關事項通知如下:
一、藥品要求
屬於藥品填報範圍(詳見附件)並獲得國內有效註冊批件的上市藥品,且滿足以下要求之一:
1、原研藥及國家藥品監督管理局發佈的仿製藥質量和療效一致性評價參比製劑。
2、通過國家藥品監督管理局仿製藥質量和療效一致性評價的仿製藥品。
3、根據《國家食品藥品監督管理總局關於發佈化學藥品註冊分類改革工作方案的公告》〔2016年第51號〕或《國家藥監局關於發佈化學藥品註冊分類及申報資料要求的通告》〔2020年第44號〕,按化學藥品註冊分類批准,並證明質量和療效與參比製劑一致的仿製藥品。
4、納入國家藥品監督管理局藥品審評中心《化學藥品目錄集》的藥品。
二、企業要求
屬於本次藥品填報範圍並滿足藥品要求的相關企業,包括:提供藥品及伴隨服務的國內藥品生產企業,藥品上市許可持有人,境外藥品上市許可持有人境內代理人。上述所稱的代理人,是指按照國家有關部門關於境外藥品上市許可持有人境內代理人管理規定,取得我國藥品註冊證書的境外持有人依法指定,代表其履行法律法規規定的藥品上市許可持有人義務的中國境內企業法人。
三、填報內容
1、生產企業、藥品上市許可持有人、境外藥品上市許可持有人境內代理人的證明材料(包括企業名稱、統一社會信用代碼、聯繫人、授權書等)。
2、符合藥品要求的證明材料(包括藥品註冊批件、補充註冊批件、説明書等)。
3、產能及原料藥自產説明等。
四、注意事項
1、填報方式:請登陸“國家組織藥品集中採購綜合服務平台”(網址:http://pub.smpaa.cn/xxsj)進行企業註冊及信息填報。新用户需選擇“資質維護用户”身份進行註冊;已有“資質維護用户”賬號的,需要重新提交與本次集採相關的資質文件,待審核通過後方可進行“品種信息”維護。用户賬號長期有效無需重複註冊。
2、審核通過的藥品信息經企業確認將生成《申報信息一覽表》,作為第七批國家組織藥品集中採購的申報依據,請正確填寫相關信息。具體要求以採購文件規定為準。
3、聯繫方式:021-31773244、31773255、31773266
(服務時間8:30-11:30,13:30-16:30,節假日除外)
特此通知。
聯合採購辦公室
2022年2月17日