5家中企獲批仿製輝瑞新冠口服藥,但銷售區域不含中國
周毅“平芜尽处是春山。”

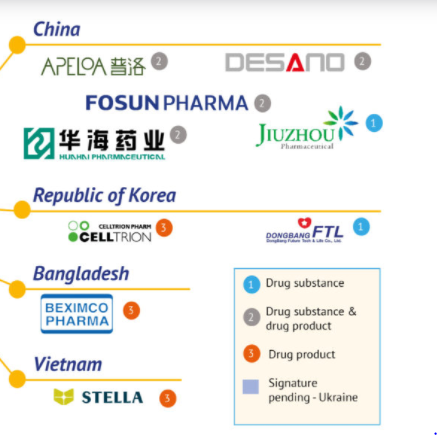
日內瓦藥品專利池(MPP)網站3月17日消息,該組織已與35家藥企簽署協議,允許其生產輝瑞(PFE)新款口服藥“奈瑪特韋(Nirmatrelvir)”原料藥或製劑。其中包括5家中國企業:上海迪賽諾、華海藥業(600521)、普洛藥業(000739)、復星醫藥(600196)和九洲藥業(603456)。
不過,仿製產品不能在中國地區銷售。
部分企業授權情況圖 MMP網站
根據協議,九洲藥業僅生產原料藥,其餘四家企業則可以同時生產原料藥和製劑。仿製產品可以被售往包括印度在內的95箇中低收入國家,不包括中國。
其實在此之前,已有中國企業拿下輝瑞新冠口服藥Paxlovid(即奈瑪特韋和利托那韋的組合)的中國大陸地區運營權。3月9日,中國醫藥健康產業股份有限公司(600056)與輝瑞公司簽訂協議,在協議期(2022年度)內,中國醫藥負責輝瑞公司新冠病毒治療藥物Paxlovid在中國大陸市場的商業運營。
綜合美國有線電視新聞網(CNN)此前報道,輝瑞口服新冠藥Paxlovid由抗病毒成分“奈瑪特韋”和“利托那韋”組合構成。該藥物需每日服用兩次(間隔12小時),每次三片(兩片“奈瑪特韋”和一片“利托那韋”),需服用五天。
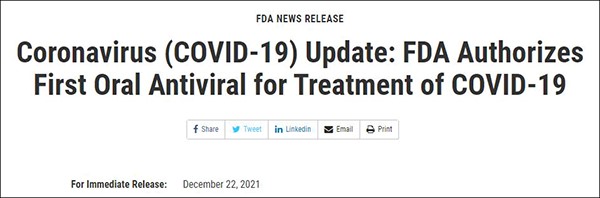
2021年12月,Paxlovid獲得美國食品和藥物管理局(FDA)批准,成為美國首個獲批的口服抗新冠病毒藥物。輝瑞提供的數據顯示,在預防重症高風險患者住院和死亡方面,該藥物的有效性為89%。
輝瑞曾表示,實驗室數據表明,由於Paxlovid在實驗中阻斷了一種參與奧密克戎病毒複製過程的酶(enzyme),因此它對奧密克戎變異毒株“依然有效”。
FDA網站截圖
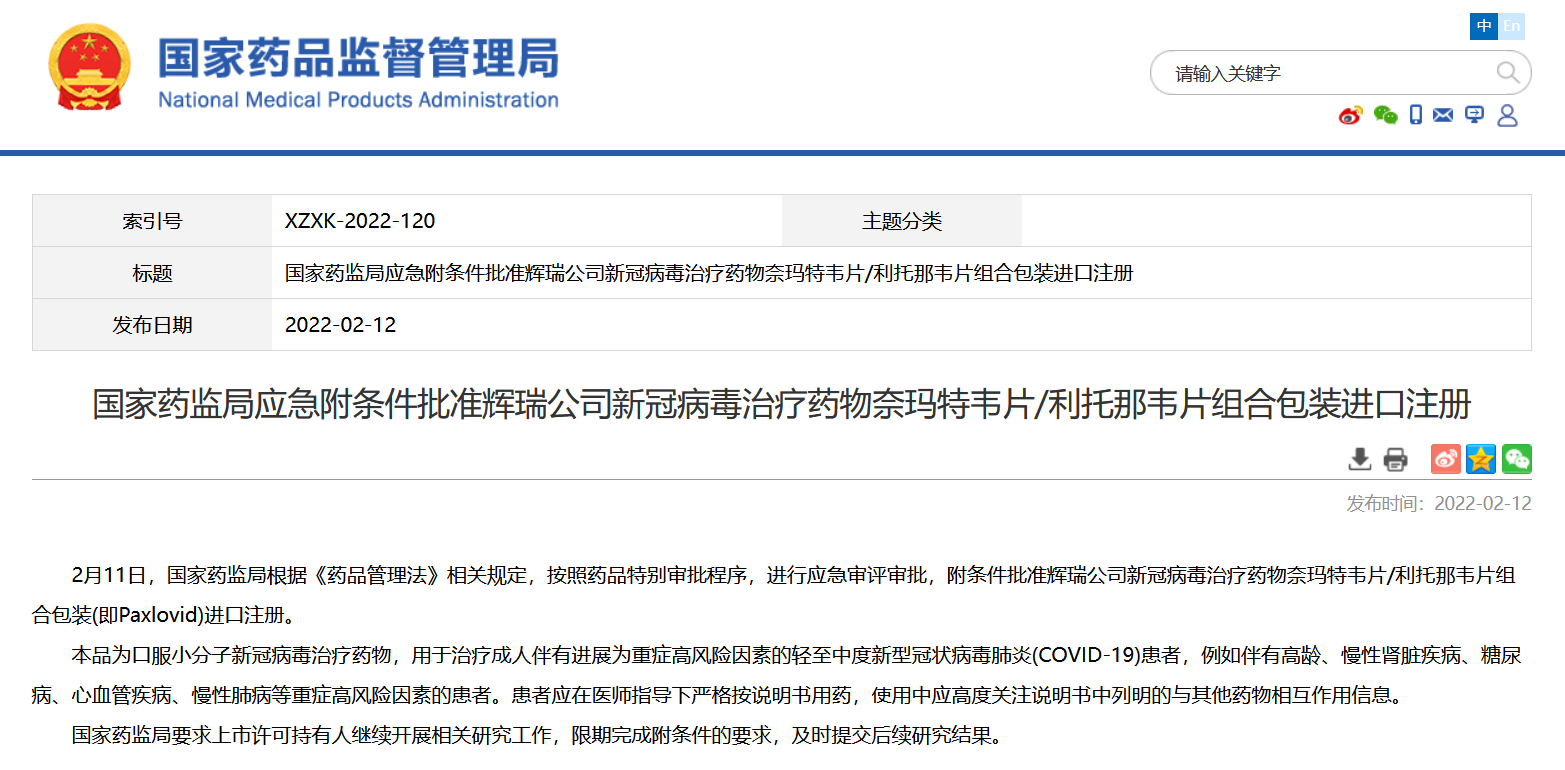
據國家藥品監督管理局網站消息,2月11日,國家藥監局根據《藥品管理法》相關規定,按照藥品特別審批程序,進行應急審評審批,附條件批准輝瑞公司新冠病毒治療藥物奈瑪特韋片/利托那韋片組合包裝(即Paxlovid)進口註冊。國家藥監局要求上市許可持有人繼續開展相關研究工作,限期完成附條件的要求,及時提交後續研究結果。
國家藥品監督管理局網站截圖
這已經不是中國藥企首次獲准仿製口服新冠治療藥物。
今年1月,MPP發佈消息稱,該組織已與27家仿製藥公司簽署協議,授權其生產默沙東口服新冠藥莫努匹韋(molnupiravir)。其中包括5家中國企業:復星醫藥、朗華製藥、龍澤製藥、博瑞醫藥、迪賽諾醫藥。
資料顯示,莫努匹韋由默沙東和Ridgeback聯合開發,它是全球首款獲批的口服抗新冠病毒藥物。莫努匹韋3期臨牀試驗的研究結果顯示,早期治療服用莫努匹韋,可顯著降低未接種疫苗的新冠肺炎高危成年患者的住院或死亡風險。
本文系觀察者網獨家稿件,未經授權,不得轉載。