衝刺首款國產新冠口服藥,多家藥企有新進展
周毅“平芜尽处是春山。”

4月17日晚間,君實生物(688180)發佈新冠口服藥VV116的最新研究成果。資料顯示,在小鼠模型上,VV116顯示對RSV(呼吸道合胞病毒,容易造成5歲以下兒童嚴重下呼吸道疾病)多個敏感細胞繫上具有優異的抗病毒效果。
在這之前,VV116更為人熟知的身份是首款國產新冠口服藥的種子選手。
研究資料顯示:與對照組相比,VV116組可以更好地改善患者的臨牀症狀,縮短SARS-CoV-2核酸轉陰時間,並顯著降低進展為危重型及死亡的風險。VV116此前已在國外獲批上市,目前該藥物正處於國際多中心的III期臨牀研究階段。
在衝刺首款國產新冠口服藥的賽道上,其他企業近期也紛紛傳來好消息:
4月6日,港股上市公司開拓藥業(09939.HK)公佈了普克魯胺的關鍵數據結果;在國家藥品監督管理局藥品審評中心網站上,真實生物提交的溝通交流會申請狀態4月2日已經變更為“已反饋”,這被市場解讀為阿茲夫定申報上市在即。
在外界看來,“首款國產新冠口服藥”很有可能從上述藥物中產出。

公告截圖
VV116:對奧密克戎表現出抗病毒活性,此前已在烏茲別克斯坦獲批
公開資料顯示,VV116是一款新型口服核苷類抗SARS-CoV-2藥物,可抑制SARS-CoV-2複製。VV116由中國科學院上海藥物研究所、中國科學院武漢病毒研究所、中國科學院新疆理化技術研究所、中國科學院中亞藥物研發中心/中烏醫藥科技城(科技部“一帶一路”聯合實驗室)、旺山旺水和君實生物共同研發。
臨牀前研究顯示,VV116在體內外都表現出顯著的抗SARS-CoV-2作用,對SARS-CoV-2原始株和已知重要變異株(Alpha、Beta、Delta和Omicron)均表現出抗病毒活性,同時具有很高的口服生物利用度和良好的化學穩定性。
目前,VV116在健康受試者中表現出良好的安全性、耐受性和藥代動力學性質,相關的三項I期臨牀研究結果已在線發表於藥學領域知名期刊Acta Pharmacologica Sinica。
2021年,VV116在烏茲別克斯坦完成了一項在中、重度新型冠狀病毒肺炎受試者中進行的隨機、開放、對照II期臨牀試驗,研究結果顯示:與對照組相比,VV116組可以更好地改善患者的臨牀症狀,縮短SARS-CoV-2核酸轉陰時間,並顯著降低進展為危重型及死亡的風險。基於該試驗的結果,VV116已在烏茲別克斯坦獲得批准,用於中、重度新冠患者的治療。
目前,VV116正處於國際多中心的III期臨牀研究階段,多項針對輕中度和中重度新冠患者的臨牀研究正在進行中。在今年2月的投資者關係活動上,君實生物表示,該公司對於VV116的產能會做提前的佈局和規劃。“初步評估在現階段,產能將不會成為VV116後續產業化的瓶頸。”
輝瑞產品來華之際,各大企業衝刺首款國產新冠口服藥
奧密克戎變異毒株給國內防疫形勢帶來極大衝擊,新冠口服藥日益成為各界關注的焦點。
2月11日,國家藥監局根據《藥品管理法》相關規定,按照藥品特別審批程序,進行應急審評審批,附條件批准輝瑞公司新冠病毒治療藥物奈瑪特韋片/利托那韋片組合包裝(即Paxlovid)進口註冊。3月17日晚間,2.12萬盒進口輝瑞新冠口服藥Paxlovid從上海入關。
國家感染性疾病臨牀醫學研究中心主任、深圳市第三人民醫院黨委書記劉磊今年4月對健康時報記者表示:“我們對20餘例普通型和輕型患者用該藥物進行了治療,5天療程結束後,患者病毒載量明顯下降,出院時間可縮短至5-7天。”
與此同時,國內多款新冠口服藥傳來最新進展,國產藥物問世可期。
4月6日,開拓藥業公佈了新冠口服藥普克魯胺治療輕中症非住院新冠患者三期臨牀試驗的關鍵數據結果。結果表明,普克魯胺可有效降低輕中症新冠患者的住院/死亡率,並改善相關症狀。
根據公佈的試驗結果,服藥超過7天的受試者保住院/死亡數為0,相應護率達到100%,對伴有高風險因素(肥胖、糖尿病、高血壓等)的中高齡(50和60歲以上)受試者保護率同樣達到100%。結果還顯示,在給藥的第3天到28天,普克魯胺能顯著持續降低新冠病毒載量,並且普克魯胺可以有效改善新冠肺炎的部分相關症狀,如發熱、氣短、咳嗽。
據悉,普克魯胺第三期臨牀試驗於今年2月3日完成最後一名受試者末次訪視,共有733名受試者,其中727名來自美國,所有受試者首次出現新冠症狀不超過五天,治療週期為持續給藥14天。
此外,對於目前的新冠治療,中國醫學科學院提出了A+B方案,即阿茲夫定與可利黴素的組合,即“協和方案”。4月16日在北京舉行的中國醫學發展大會上,中國醫學科學院學部委員、中國工程院院士蔣建東表示,阿茲夫定治療新冠輕重症都非常有效。
阿茲夫定片為國家1類創新藥,由河南真實生物科技有限公司研發。國家藥監局藥審中心發佈的《藥物研發與技術審評溝通交流管理辦法》指出,II類會議為藥物在研發關鍵階段而召開的會議。其網站顯示,真實生物的II類溝通交流會現在狀態已經從“處理中”變更為“已反饋”。
在外界看來,這些動態或將意味着阿茲夫定III期臨牀揭盲、申報上市在即。
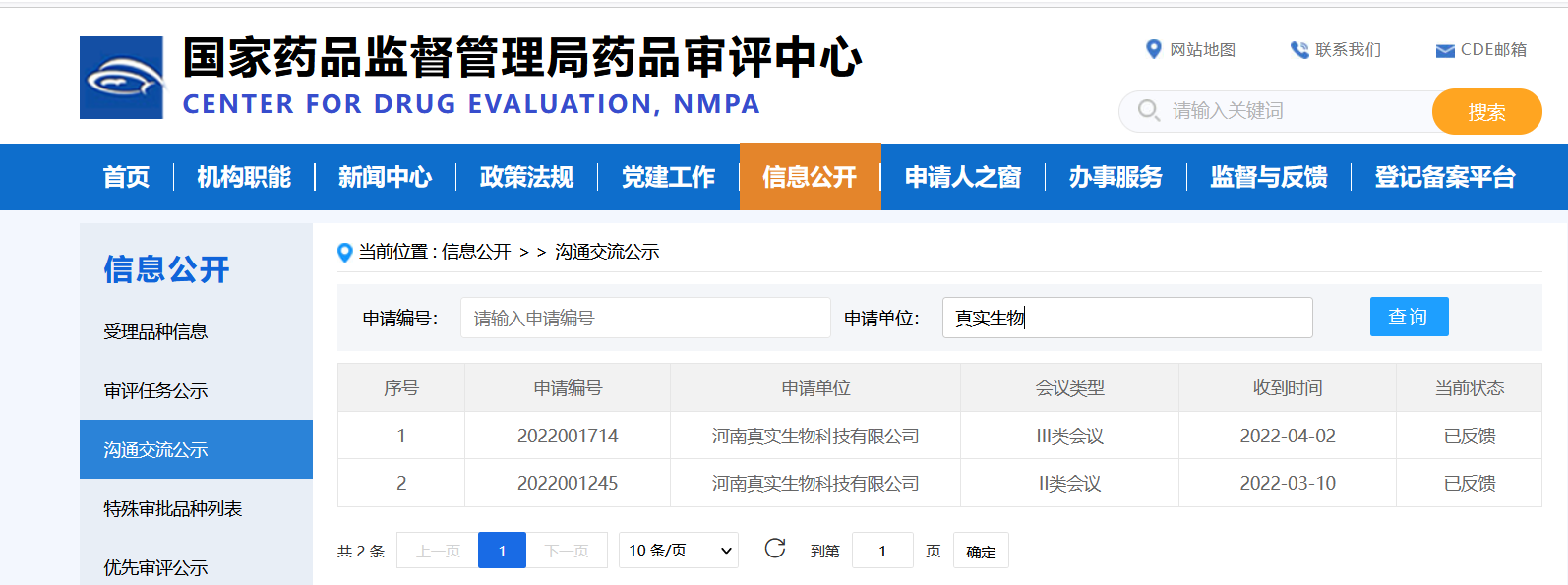
國家藥品監督管理局藥品審評中心網站截圖
東吳證券認為,新冠特效藥是疫情防控的另一關鍵。其中,新冠中和抗體具有靶點明確、純度高以及可大規模製備等優勢,但存在隨着突變的發生而失去中和效力的風險;而新冠小分子口服藥物受毒株變異的影響較小,同時具備生產成本低、服用方便等優勢。
目前在國內附條件批准上市的僅有輝瑞Paxlovid。後續來看,除了君實生物的VV116、開拓藥業普克魯胺,真實生物的阿茲夫定以外,前沿生物的FB2001等國產新冠小分子特效藥,也值得關注。
本文系觀察者網獨家稿件,未經授權,不得轉載。