君實生物官宣VV116三期臨牀結果,試驗設計疑點重重引爭議
张玉
(文/張玉 編輯/馬媛媛)5月25日,君實生物在微信官方平台發佈消息稱,其與旺山旺水合作開發的口服核苷類抗SARS-CoV-2藥物VV116在一項對比奈瑪特韋片/利托那韋片(即Paxlovid,輝瑞公司新冠特效藥)用於輕中度新型冠狀病毒肺炎伴有進展為重度包括死亡的高風險患者早期治療的III期註冊臨牀研究(NCT05341609)達到方案預設的主要終點和次要有效性終點。
研究結果顯示,相比Paxlovid,患者接受VV116治療的中位至持續臨牀恢復時間更短,達到統計學優效。此外,君實生物在5月23日發佈的公告中披露,公司將於近期與藥物監管部門溝通遞交新藥上市申請事宜。
君實生物公告消息發佈的同時,業內關於VV116臨牀試驗的討論和質疑也蜂擁而至。
研發過程“超速”
VV116引發業內關注的第一點是,其臨牀試驗的研發過程太快了。
公開資料顯示,今年3月份,VV116公佈3項I期臨牀研究結果,研究結果顯示,VV116在健康受試者中表現出令人滿意的安全性和耐受性。這是國產口服小分子抗新冠病毒藥物首次公佈I期臨牀數據。
此外,去年,VV116在烏茲別克斯坦完成了一項在中重度新冠肺炎受試者中進行的隨機、開放、對照二期臨牀試驗。基於此,2021年12月31日,君實生物宣佈,烏茲別克斯坦衞生部已批准VV116的緊急使用授權。
3月16日,君實生物公告顯示,已啓動一項在中重度新型冠狀病毒肺炎受試者中評價vv116對比標準治療的有效性和安全性的國際多中心、隨機、雙盲、對照三期臨牀研究,並已完成首例患者入組及給藥。
有意思的是,據中國臨牀試驗註冊中心顯示,4月19日,蘇州旺山旺水生物醫藥登記了一項評價VV116對比輝瑞Paxlovid早期治療輕-中度新型冠狀病毒肺炎有效性和安全性的多中心、單盲、隨機、對照三臨牀研究(NCT05341609)。根據媒體報道,該研究已於4月底完成患者入組。
根據君實生物介紹,該方案經與監管部門溝通後開展,實際入組822例患者,採用單盲設計,即在研究結束最終數據庫鎖定前,研究者(包括研究終點評估者)和申辦方都不會知道具體的治療藥物分配情況。
其中,主要研究終點為“至持續臨牀恢復的時間”,次要研究終點包括“截至第28天發生COVID-19進展(定義為進展為重度/危重COVID-19或全因死亡)的受試者百分比”等。
臨牀研究結果顯示,VV116用於輕中度COVID-19伴有進展為重度包括死亡的高風險患者早期治療達到方案預設的主要終點和次要有效終點。
“對新冠口服藥開放優先審評通道,監管層的目的很明確,防止患者變成重症,然後降低28天死亡率。這個也是當初研究者發起臨牀試驗的指標終點。”病毒專家常榮山向觀察者網表示,該研究直接轉到三期臨牀嚴格意義上是不合規的。與從2020年就開始研究的另一款新冠口服藥普克魯胺相比,VV116研發的時間相對較短。
安全性引爭議
另一方面,儘管君實生物宣稱的是VV116與Paxlovid的頭對頭實驗,在業內人士看來,VV116與瑞德西韋(Remdesivir,美國吉利德科學公司研發的新冠肺炎治療藥物)具有緊密關聯和相似性。
2020年5月,日本批准了美國吉利德科技公司研發的瑞德西韋作為國內首款新冠肺炎治療藥物,將被用於重症患者治療。2020年10月22日,美國食藥監局(FDA)批准了吉利德科學的抗病毒藥物瑞德西韋用於治療新冠住院患者,成為美國首個正式獲批的新冠治療藥物。
由於瑞德西韋可能會產生嚴重副作用,世界衞生組織曾評估不建議使用該藥物進行治療。2020年11月20日,世界衞生組織發表聲明説:不論新冠住院患者病情多嚴重,都不建議使用抗病毒藥物瑞德西韋進行治療,因為尚無證據表明該藥能提高患者生存率或降低患者對呼吸機的需求等。
據悉,口服瑞德西韋的生物利用度很低,只有2%左右,做成口服用藥很難發揮藥效,因此,只能做成注射液,直接注射進入血液來發揮藥效。
常榮山告訴觀察者網,VV116和瑞德西韋基是一類化合物,具有一樣的骨架,VV116對瑞德西韋分子水平上的基團進行了改進和優化(將瑞德西韋分子中C7位氫原子替換成氘原子,是瑞德西韋的氘代類似物,可稱為“氘代藥物”),迴避了專利,毒性也減低了。但降低毒性不代表沒有毒性,“它的毒性比Paxlovid還是要大。”
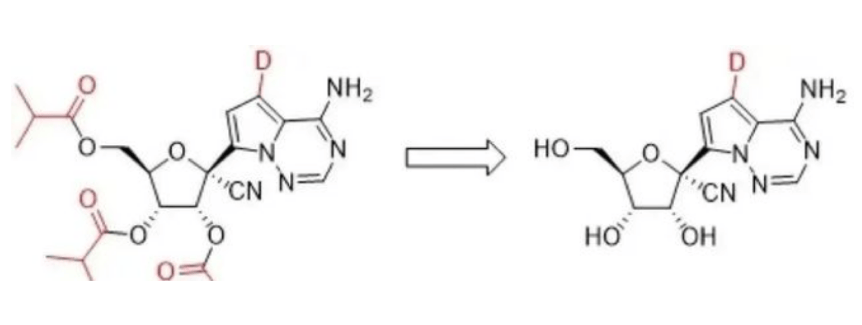
(注:上圖中標紅的地方就是VV116和Remdesivir有區別的地方,前藥設計改為全聚酯化設計,鹼基部分將氫換成D,這種前藥設計主要為了口服給藥將分子遞送進入循環,然後在血漿裏轉化為右側的核苷酸形式進入細胞。)
公開資料顯示,VV116(中文商品名:民得維)是君實生物在2021年9月與蘇州旺山旺水生物醫藥有限公司合作獲得的新藥,屬於RNA聚合(RdRp)酶抑制劑,與吉利德的瑞德西韋、默沙東的Molnupiravir屬於同類藥物。
目前,業內公認的對新冠病毒抑制效果最好的靶點是3CL蛋白酶,不是RNA聚合酶(RdRp)。從安全性到療效,真實世界數據顯示,當下抗新冠最佳的口服藥是Paxlovid,這也是NMPA在今年3月有條件批准Paxlovid在中國上市的最重要原因。
值得一提的是,Paxlovid用來治療具有極高住院風險的輕症患者,但建議人羣為成人,不適用於孕婦、哺乳期婦女及未成年人。多項試驗結果表明,Paxlovid具有一定的毒副作用,主要表現在可能會引起味覺受損、腹瀉、高血壓和肌肉疼痛等副作用,並且不推薦嚴重腎或肝功能損害者使用。
“VV116雖然有專利,但是它沒有全球專利。氘代可以申請專利,但是在藥物行業裏,氘代本質上還是仿製,它並不是一個全新的化合物。VV116跟瑞德西韋的結構相似,改變了給藥途徑,從靜脈輸注改為了口服,進行新冠治療。武漢病毒所申請的是瑞德西韋用途專利,並不是藥物的產品專利,一般認為是很弱的專利,只是新冠治療的用途專利。”常榮山表示。
除了安全性和專利的問題,VV116此次三期臨牀試驗設計中的單盲、沒有重症患者、採用口服給藥方式等方面也都引發較多爭議。
市場空間有多大?
根據我國藥品註冊相關的法律法規要求,藥物需完成臨牀研究並經國家藥監局審評、審批通過後方可生產上市。君實生物在5月23日發佈的公告中披露,公司將於近期與藥物監管部門溝通遞交新藥上市申請事宜。
加速進入市場的背後,在部分券商機構看來,VV116面臨着巨大的市場空間。
國盛證券分析指出,VV116如在國內獲批上市用於新冠肺炎治療,銷售峯值將超過200億元,項目DCF價值超過700億元,且未計入政府採購、提前備貨及海外市場空間。
不過,VV116的生產過程不可避免地面臨諸多難點。比如,民生證券分析指出,vv116合成路徑涉及九步反應,由兩種起始反應物(52-5和43-1)合成關鍵中間體49-1。起始物質2(43-1)為碘化物,化學性質不穩定,向後反應可得到vv116,此過程有一定合成難度,需要-120℃低温以及氘代等反應。
此外,根據ChemicalBook數據顯示,關鍵中間體49-1克級價格達到千元以上,目前整體反應收率較低,未來隨着工藝優化有望大幅提高合成路徑整體收率,進而提高產能以及毛利情況。
據悉,2021年底,君實生物全球總部和全球研發中心建設項目在位於浦東的上海國際醫學園區內正式啓動奠基。根據浦東新區宣傳部透露,目前君實生物位於上海臨港新片區的生產基地已完成藥品生產環境恢復並啓動多款商業化和臨牀階段產品的大規模生產。
此外,今年5月19日,5月19日晚間,海正藥業發佈公告稱,其與上海旺實生物簽訂《戰略合作協議》及《委託生產框架協議》,雙方擬在小分子創新藥VV116的產品加工、生產、國際註冊、市場開發等領域建立戰略合作關係。旺實生物正是君實生物的子公司。
不過,也有專家質疑,在當下新冠病毒感染死亡率(Infection Fatality Rate,縮寫為IFR)大大降低的情況下,君實生物VV116到底能分得多大的蛋糕。
今年4月24日,上海新冠肺炎救治專家組組長、復旦大學附屬華山醫院感染科主任張文宏在接受人民日報專訪時表示,今天,即便把基礎疾病死亡的病例計算在內,上海總病死率維持在0.0178%(87/48.8萬),而其中新冠重症肺炎死亡佔比很低。
張文宏提到的0.0178%指的就是感染死亡率。與病死率(CFR,指某種病毒導致的死亡人數除以已確診人數)不同,感染死亡率指的是某種病毒導致的死亡人數除以所有感染人數。相比之下,季節性流感的感染死亡率介於0.01%和0.05%之間。
“2022年上半年,陸陸續續的真實世界數據,流行病回溯研究都揭示了一個非常重要的信息:新冠病毒的感染死亡率已經跟感冒差不多了,常識裏,一般不會有人用口服藥來預防感冒的死亡。我認為新冠口服藥對疫情防控不會起到特別大的作用了,一老一小打疫苗(老人、兒童要打疫苗)才是重點,壓寶在口服藥上,到頭來將會是一場空。”常榮山表示。
本文系觀察者網獨家稿件,未經授權,不得轉載。