人也能“光合作用”?浙大成果登上《自然》
None
微信公眾號“浙江大學”12月8日消息,菠菜,曾因“大力水手”這個卡通形象給許多70後、80後留下了深刻的童年回憶。如今,菠菜除了每天照常出現在我們餐桌上外,科學家們真正賦予了它“力大無窮”的期待。浙江大學醫學院附屬邵逸夫醫院骨科林賢豐醫師、範順武教授團隊與浙江大學化學系唐睿康教授團隊成功從菠菜中提取了具有光合作用的“生物電池”——類囊體,並通過精密的製備技術,在國際上首次實現植物的類囊體跨物種遞送到動物體衰老病變的細胞內,讓動物細胞也擁有植物光合作用的能量,以此敲開逆轉細胞退變衰老的“時光之門”。
北京時間12月8日,這項原創性科研成果被國際頂級期刊《自然》(Nature)雜誌以長文(Article)形式刊登。論文第一作者為浙江大學醫學院附屬邵逸夫醫院陳鵬飛博士、劉欣特聘研究員和博士生顧辰輝;通訊作者是浙江大學醫學院附屬邵逸夫醫院骨科林賢豐特聘研究員/主治醫師、範順武教授和浙江大學化學系唐睿康教授。
“遵循自然規律、創新性突破向細胞輸送能量的世界難題、開闢了代謝工程的可能性。”《自然》(Nature)雜誌資深編輯和審稿人對浙大科研團隊的這項最新研究成果給予高度評價。據介紹,該項研究最令人興奮之處在於,團隊開發了細胞膜納米塗層技術,將哺乳動物細胞膜包覆在納米化植物類囊體外層,通過細胞膜偽裝包封的方式巧妙地將植物類囊體種間移植到哺乳動物細胞,成功解鎖跨物種間能量傳遞的“密碼”,實現特異性供應能量,並在退行性骨關節炎疾病的治療應用中得以驗證。
巧用植物億年智慧
為動物細胞“充電”
隨着疾病研究的進展,越來越多的研究發現,動物細胞能量不足是組織衰老和退行性疾病發生髮展的關鍵原因。正如人類一日三餐需要補充營養一樣,細胞更新代謝也需要能量和物質補給,而ATP和 NADPH就是細胞再生修復不可或缺的能量貨幣和物質貨幣。然而,向退變細胞提供直接能量和物質卻是個巨大的科學難題。
林賢豐提出了一個設想“我們能否設計一個‘充電’裝置,在細胞內可控地產生ATP和NADPH?” 醫學和化學兩個課題組交叉討論引發的頭腦風暴,開闢出一片研究新天地。 然而,對於如何利用生物材料合成ATP和NADPH,科學家們已經做出了巨大努力,但是如何讓細胞“接受”這樣一種外來裝置,並精準地調控ATP和NADPH的濃度一直是該領域的世界級難題。
基於浙大邵逸夫醫院骨科科研團隊在生物材料領域的長期深耕、化學系唐睿康團隊“材料調控生物”的化學生物學研究思路及“人工細胞器”概念,團隊敏鋭地將目光投向了神奇的自然界——自然界中,植物和動物形成了完美的互補關係,植物通過吸收二氧化碳產生氧氣和糖,而動物恰恰相反。 是否能將這種 宏觀的互補關係延伸至細胞層面 ,通過植入“光合細胞器”讓植物的能量供應系統成為動物細胞補給能量的“生物電池”?
“眾裏尋她千百度,驀然回首,那人卻在,燈火闌珊處”。數十億年來,植物已經進化了出了一個近乎完美的能量供應細胞器——類囊體,正是一個可控、穩定生成ATP和NADPH的能量工廠。研究團隊選擇了在每天都吃的、菜市場中最綠的,也是在研究植物代謝領域較為普遍的菠菜作為原材料,經過不懈努力,成功提取並純化了菠菜綠葉中的類囊體組分。
林賢豐(左)和陳鵬飛(右)在實驗交流中
首次實現跨物種遞送
完美再生修復不是夢
補給能量的“電池”就緒,“接口”在哪?如何將類囊體安全、精準地遞送到動物的衰老退變細胞內,又成為了限制研究團隊向醫療領域應用的巨大難題。 長久以來,跨物種遞送生物活性組分研究進展緩慢。尤其是人體擁有一套複雜的免疫系統,以巨噬細胞為主的各類免疫細胞會對異物進行主動識別和吞噬清除,進而再通過溶酶體降解消化異物。
如何才能克服物種間的屏障?團隊成員陳鵬飛嘗試了脂質體包載等多種遞送方法,但始終沒有取得預期的理想效果 。“用細胞自己的細胞膜來包載怎麼樣?利用同源靶向作用原理,讓細胞以為我們所遞 送的類囊體是‘自己人’,從而避免體內的免疫排斥,實現細胞跨界移植納米植物類囊體。”
大膽假設,小心求證,在範順武、唐睿康的不斷鼓勵下,在林賢豐的啓發下,經過一番摸索,團隊成功用細胞膜“偽裝”了納米類囊體“瞞天過海”,實現了納米類囊體的胞內遞送。
“外源生物材料從溶酶體逃離是實現成功遞送的重要環節,我們通過 多種胞吞抑制試驗反覆驗證 了動物細胞不再將納米類囊體作為‘異物’進行清除,從而使其成為它的一部分。”劉欣補充道,這也就意味着,研究團隊掌握了延緩動物細胞退變衰老的“黑科技”。
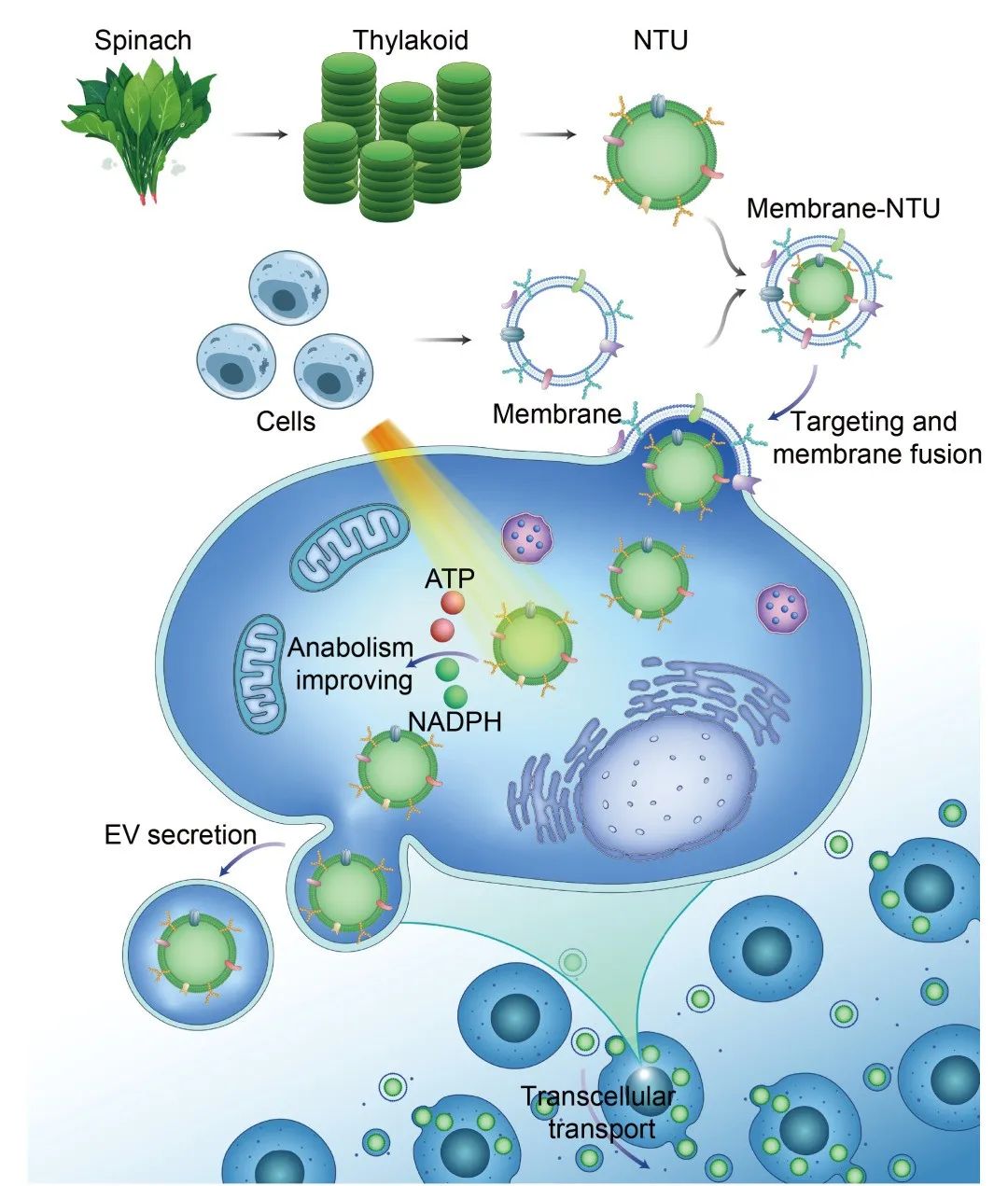
本研究作用機制示意圖
應用領域不可估量
率先在骨關節炎治療上“實現突破”
納米類囊體在細胞內具體發揮了怎樣的關鍵性作用? 在這一研究成果發表的過程中,四位來自生物材料、細胞代謝、臨牀醫學等學科的國際頂尖審稿人圍繞這一核心問題向團隊提出了一系列建議和改進。
團隊通過多種跨學科技術手段的驗證,在經歷了一年多的紮實實驗和測試分析後,驗證了納米化的類囊體可以保留類囊體上光合作用所需的蛋白和其他功能單體,保持足夠的作用時間和降解穩定性,並保證足量的ATP和NADPH的產生,從而系統性地逆轉病變細胞代謝狀態。“驗證過程涉及到精細的建模和計算,特別是對於分析ATP和NADPH的產量和其確切作用濃度水平,讓我們對研究成果有了全新認識。”顧辰輝説。
這種令人振奮的納米類囊體“黑科技”在體內到底能夠發揮多大的作用?這是整個審稿過程中,不同學科領域的國際頂尖審稿人最關心的問題。
為了檢驗這類“生物電池”是否能逆轉病變細胞代謝狀態,團隊首先選擇了骨關節炎的疾病模型對這類“生物電池”進行“概念性驗證”。骨關節炎是目前臨牀上致畸致殘的最主要原因之一,正是由於軟骨細胞的能量代謝失衡,ATP、NADPH耗竭而導致關節軟骨破壞。目前骨關節炎的生物治療還無法系統性地糾正損傷退變軟骨細胞的代謝失衡,因此臨牀預後不佳。
範順武帶領科研團隊歷經一年多的時間,不斷尋求各種跨學科的技術手段, 系統地驗證了軟骨細胞膜包封的納米類囊體不僅可以有效地逃避免疫系統清除,同時還能夠被退變的軟骨細胞選擇性攝取。 通過體外無創化光照治療,實現精確增強退變軟骨細胞內的ATP、NADPH水平並能維持足夠的“續航”能力,從而重塑軟骨細胞的合成代謝,實現退行性骨關節炎疾病的治療。
光照刺激軟骨細胞示意圖
創新研發 未來可期
《自然》(Nature)雜誌資深編輯George Caputa評價道:“如何向細胞輸送能量一直是細胞生物學和臨牀醫學的巨大難題,並且實現特定代謝物含量的正確補給是臨牀治療的持久性挑戰。有什麼能夠比遞送經過數十億年生命進化的工廠——類囊體去解決上述難題更好的辦法呢?”
論文評審專家Francisco Cejudo教授認為:“這項工作的傑出之處在於研究團隊成功地將植物‘微型細胞器’種間移植到了哺乳動物細胞。利用植物光合作用系統以依賴光能的方式在哺乳動物細胞中特異性供應 ATP 和 NADPH 的這一技術,是一項令人興奮的成就,它開闢了代謝工程的可能性。”
同期《自然》(Nature)“研究簡報(Research briefing)”欄目發表了《植物細胞裝置實現了代謝物向哺乳動物細胞轉移》,對該研究成果進行了宣傳報道和積極評價。
唐睿康説:“這項研究展示了將天然植物來源的類囊體跨物種移植到哺乳動物細胞的生物醫學應用,這項研究的關鍵原材料源於天然植物,生物安全性高,同時細胞膜納米塗層技術具備規模化生產潛力,這一創新性技術有望未來在醫學、能源、材料等領域實現應用。”
範順武團隊表示:“這項研究的成功得益於醫院自由探索的氛圍,學校、學院、醫院、科室的一致支持,以及國家自然科學基金、科技部國家重點研發計劃的資助”。據介紹,團隊長期深耕於骨骼肌肉系統退行性疾病的機理研究和天然來源的生物材料的開發研究,並不斷大膽嘗試學科交叉,陸續在Nature, Matter, Developmental Cell, Nature Communications, Science Advances, JACS 等權威期刊發表一系列高影響力的研究成果,實現了對脊柱、關節、骨創傷、創面修復等各類常見和疑難疾病的臨牀新技術應用,深刻踐行“把技術用到臨牀實踐裏,把論文寫在祖國大地上”。
目前,研究團隊已同步遞交了發明專利並着手進行產品轉化。

