國產新冠藥VV116臨牀3期試驗結果積極,稱療效不劣於輝瑞
None
面對迅猛發展的新冠疫情,中國亟需高效抗新冠病毒藥物。儘管美國輝瑞公司的Paxlovid(奈瑪特韋/利托那韋)和國產原研藥阿茲夫定早已獲得應急附條件批准治療新冠病毒感染(Covid-19),但或由於供應不足,或由於缺乏高質量證據,其遠遠不能滿足臨牀需求。
北京時間12月29日凌晨,國際頂級醫學期刊《新英格蘭醫學雜誌》(The New England Journal of Medicine,NEJM,影響因子:176.079)在線發表了一項中國非劣效性Ⅲ期隨機對照臨牀試驗(NCT05341609),其結果表明,對於有高危因素的輕中度Covid-19成人患者,在至持續臨牀康復時間方面,口服核苷類抗新冠病毒藥物VV116非劣於奈瑪特韋片/利托那韋片組合藥物Paxlovid(4天vs. 5天;風險比,1.17;95%置信區間,1.02~1.36),且不良事件更少。

論文截圖。圖片來源:《新英格蘭醫學雜誌》
這項試驗由上海交通大學醫學院附屬瑞金醫院趙任教授,上海交大醫學院附屬仁濟醫院皋源教授和中國工程院院士、上海瑞金醫院院長寧光牽頭,在7家上海醫院開展,這是奧密克戎(Omicron)變異株流行期間首個針對Covid-19患者開展的國產口服抗病毒藥物“頭對頭”Ⅲ期臨牀試驗。
據NEJM獨家授權的“NEJM醫學前沿”微信公眾號稱,這是《新英格蘭醫學雜誌》發表的首箇中國自主研發的新冠創新藥臨牀試驗,其“在今年3-5月的上海極度困難時期高質量完成,尤為難能可貴”。
此次發表由上海交通大學醫學院附屬瑞金醫院趙任教授,上海交通大學醫學院附屬仁濟醫院皋源教授,瑞金醫院寧光院士、徐懿萍教授、謝青教授作為共同通訊作者,以及瑞金醫院曹竹君、高衞益,復旦大學附屬浦東醫院包紅、上海公共衞生臨牀中心馮海燕、仁濟醫院梅舒雅作為共同第一作者。
據瑞金醫院副院長趙任介紹,入組的新冠病人來自於瑞金醫院北部院區定點醫院以及瑞金醫院負責運營管理的各大方艙。
12月29日,上海交通大學醫學院附屬瑞金醫院發文稱,“瑞金醫院寧光院長領銜指揮團隊,連續3個多月駐守醫院運管指揮中心,白天進行全院人員、物資、設備、空間等所有醫療資源的統籌調配;每天晚上8點雷打不動地開展VV116臨牀試驗進展線上會議。”
中國科學院大學藥學院丁健教授表示,“抗新冠病毒藥物是有效應對疫情的重要手段之一,尤其是我國在疫情有效防控取得積極重大成果的基礎上,出台二十條優化措施和疫情防控新十條,實施疫情更加科學精準防控,更加需要加強抗新冠藥物的研發、生產和儲備。口服小分子抗新冠病毒藥物具有使用方便、可及性好等方面的優勢,將在當前和今後疫情防控中發揮重要作用。”
首個國產靶向新冠病毒RdRp的小分子藥物抑制劑
據君實生物介紹,VV116是中國首個國產靶向新冠病毒核糖核酸聚合酶(RdRp)的小分子藥物抑制劑,可抑制新冠病毒在人體內的複製。VV116基於瑞德西韋(Remdesivir)的母體核苷(GS-441524)結構改造而來。瑞德西韋源自美國吉利德科學公司,是美國首個正式獲批用於治療新冠的藥物。但其最初的開發目標是針對丙肝病毒,具有肝臟靶向性,而肺部才是新冠治療的關鍵。因此,中國科學院上海藥物研究所沈敬山研究員帶領團隊對GS-441524進行了結構修飾,並最終篩選出VV116(編者注:2021年9月在《自然》子刊Cell Research上發文)。
VV116由中國科學院上海藥物研究所、中國科學院武漢病毒研究所、中國科學院新疆理化技術研究所、中國科學院中亞藥物研發中心/中烏醫藥科技城(科技部“一帶一路”聯合實驗室)、上海臨港實驗室、蘇州旺山旺水生物醫藥有限公司和上海君實生物醫藥科技股份有限公司(688180.SH,01877.HK)共同研發。君實生物與旺山旺水共同承擔該藥物在全球層面的臨牀開發和產業化工作。
君實生物12月29日發文稱,臨牀前研究顯示,VV116對新冠病毒原始株和已知突變株都表現出顯著的抗病毒作用,並在I期臨牀研究中表現出令人滿意的安全性、耐受性和藥代動力學性質。一項初步的小規模研究證實,與常規治療相比,在新冠病毒(SARS-CoV-2)首次檢測為陽性後5天內接受VV116治療的患者的核酸轉陰時間更短。據其介紹,2021年,VV116已在烏茲別克斯坦獲得批准用於中/重度Covid-19患者的治療。
此前,2022年3月16日,藥學領域知名期刊《Acta Pharmacologica Sinica》發表了VV116的3項I期臨牀研究結果。復旦大學附屬華山醫院張文宏教授、中國科學院上海藥物研究所王震研究員、上海市徐彙區中心醫院劉罡一主任為共同通訊作者。
其中,研究1(NCT05227768)和研究2(NCT05201690)為隨機、雙盲、安慰劑對照、單劑量和多劑量遞增研究,旨在評估在健康受試者中單次和多次遞增口服VV116的安全性、耐受性和藥代動力學特徵;研究3(NCT05221138)是一項隨機、開放、3週期、交叉研究,旨在觀察飲食對健康受試者口服VV116後藥代動力學和安全性的影響。
在2021年11月至2022年1月間,3項研究共納入86名符合標準的成年健康受試者,研究1納入38名受試者,研究2納入36名受試者,研究3納入12名受試者。研究結果顯示,VV116口服後吸收迅速,重複給藥可維持有效抗病毒濃度,可在空腹或普通飲食條件下口服用藥。
多項指標對照顯示效果不劣於Paxlovid
此次NEJM上發表的研究,是一項多中心、單盲(研究者保持盲態)、隨機、對照的III期臨牀試驗(NCT05341609),該試驗於2022年4月4日至5月2日期間,在上海的7家新冠病毒定點醫院聯合開展,共納入822例確診為伴有進展為高風險的輕度至中度COVID-19成人患者,最終,共有771例患者接受了VV116或Paxlovid的治療。
研究將這些患者按照1:1 的比例分配至——
1.VV116 治療組:
口服,第1天600mg,每12小時給藥一次,第2~5天300mg,每12小時給藥一次,持續治療5天;
2.奈瑪特韋片/利托那韋片組合藥物治療組:
口服,第1~5天,奈瑪特韋片300mg和利托那韋片100mg,每12小時給藥一次,持續治療5天。
這些患者的中位年齡為53歲(範圍:18-94),其中女性佔比50.2%,輕症患者佔比92.1%,75.7%的患者全程接種新冠疫苗或接種過加強針,77.3%的患者在症狀出現5天內接受了VV116或Paxlovid治療。患者中最常見的高風險因素包括:年齡≥60歲(37.7%)、心血管疾病(包括高血壓)(35.1%)、肥胖或超重BMI≥25(32.9%)、目前吸煙(12.5%)和糖尿病(10.1%)。
該研究的主要終點是從隨機分組至持續臨牀恢復的時間,“持續臨牀恢復”被定義為連續2天緩解所有與Covid-19相關的症狀。次要療效終點包括截至第28天進展為重度/危重COVID-19或任何原因的死亡的患者比例,COVID-19相關症狀評分和世界衞生組織(WHO)臨牀進展量表評分變化、至目標症狀持續消失的時間、SARS-CoV-2核酸檢測陰性的時間等。安全性終點包括不良事件和嚴重不良事件。
根據最終分析結果(截至2022年8月18日),VV116組的377名受試者和Paxlovid組的378名受試者都發生了持續的臨牀恢復,表明VV116在持續臨牀恢復方面的效果不劣於Paxlovid,且VV116組比Paxlovid組的中位恢復時間更短(前者為4天,後者為5天)。
在“至持續症狀消失的時間”、“至首次SARS-CoV-2核酸陰性時間”方面,VV116組和Paxlovid組表現類似,中位時間均為7天。在每一個預設時間點(第5、7、10、14、28天),VV116組症狀緩解的患者比例均高於Paxlovid組。兩組患者均未發生進展為重度/危重COVID-19或死亡的情況。
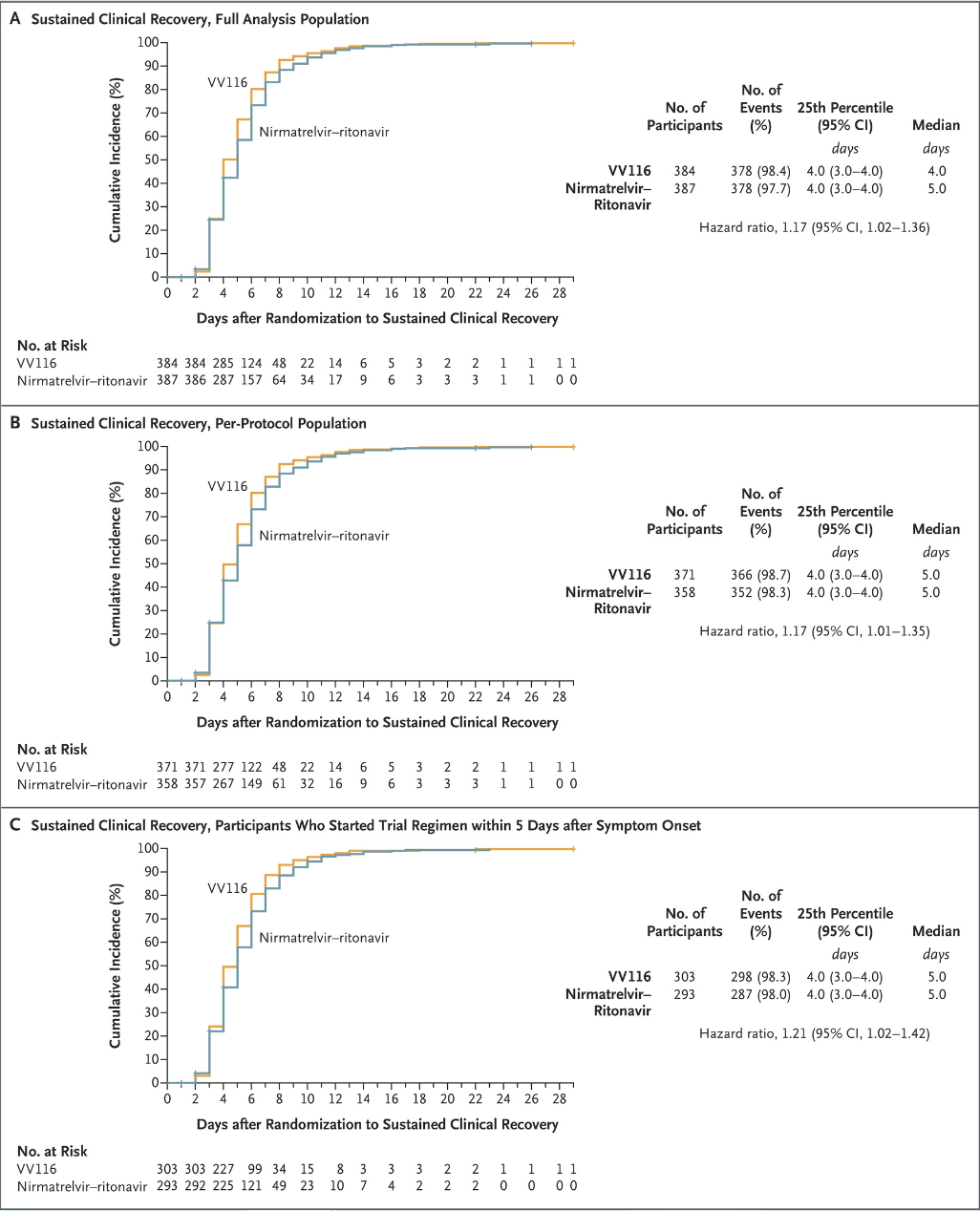
持續臨牀恢復的時間的最終分析結果(數據截止日期,2022 年8月18日),完整分析人羣(771 名受試者)(小組 A)、每個方案人羣(729 名受試者)(小組 B)和症狀發作後5天內開始試驗方案的參與者(596 名參與者)(小組 C)。圖片來源:《新英格蘭醫學雜誌》
在安全性方面,VV116比Paxlovid的安全性顧慮更少。“尤其是味覺障礙”,中日友好醫院呼吸與危重症醫學科曹彬教授説。研究結果顯示,VV116組的不良事件發生率低於Paxlovid組(前者所有級別不良事件發生率為67.4%,後者為77.3%)。此外,Paxlovid與多種藥物存在相互作用,而VV116不會抑制或誘導主要藥物代謝酶,或者抑制主要藥物轉運蛋白,因此與合併用藥發生相互作用可能性小。
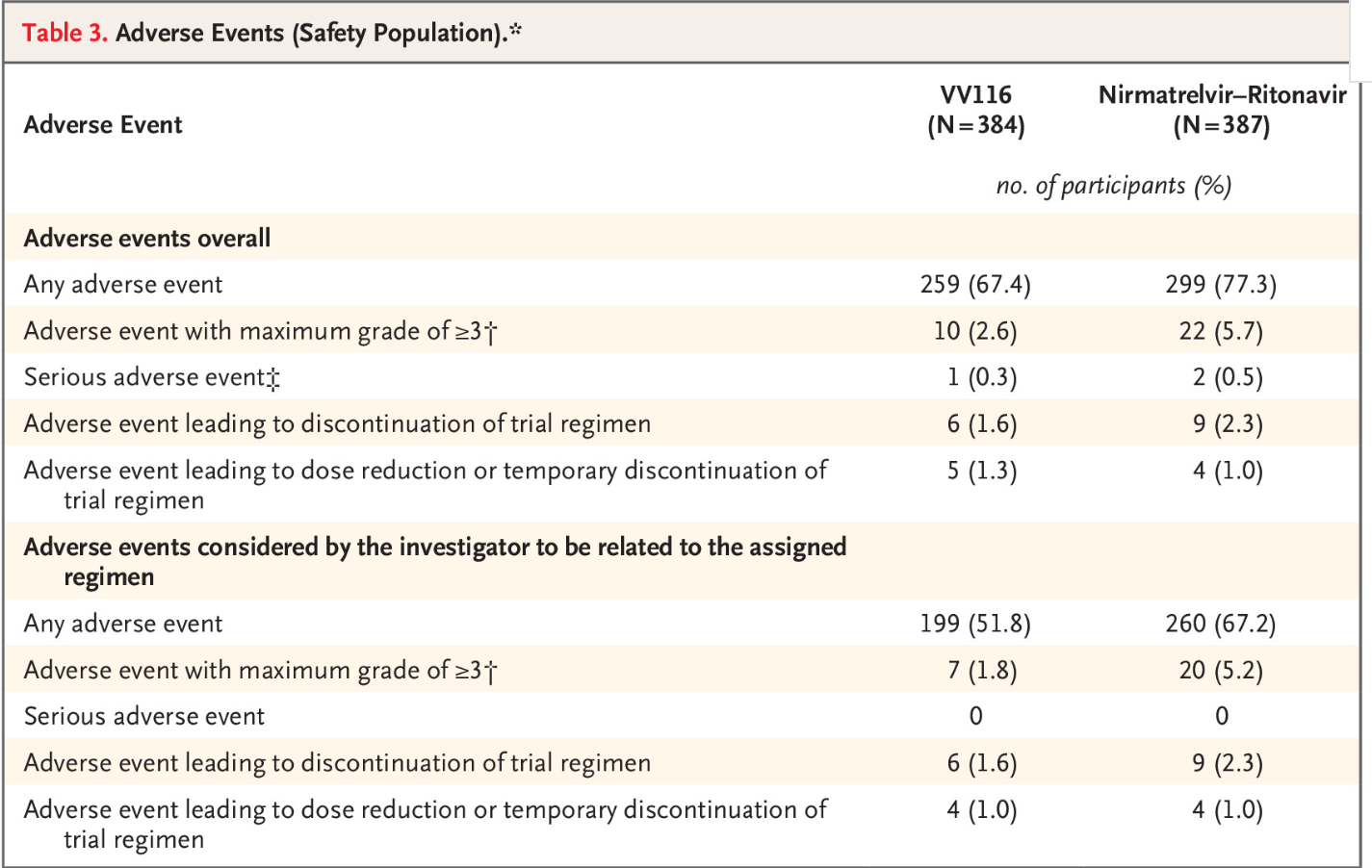
不良事件報告。圖片來源:《新英格蘭醫學雜誌》
研究人員特別指出,在試驗期間,對129名患者的標本進行的SARS-CoV-2基因組分析顯示,所有患者的標本都具有BA.2.2亞譜系,這表明該試驗涉及的主要變體是奧密克戎。另一個特點是,75.7%的試驗參與者接種了疫苗,反映了當前人羣免疫的現實。鑑於Covid-19應對措施的迅速變化,接種疫苗的人已被排除在大多數試驗之外。研究人員根據疫苗接種狀況預先進行了亞組分析,結果顯示,VV116和Paxlovid在接種或未接種疫苗人羣中的治療結果無統計學差異。
研究人員也指出了該試驗存在的六點侷限性。首先,研究團隊無法用雙盲雙模擬法進行這項試驗。其次,該試驗涉及的是單一地理區域內感染了奧密克戎亞變體的中國成年人,因此結果需要在具有病毒變異多樣性的異質人羣中進行驗證。第三,目標症狀消退連續2天后,可能復發。第四,世衞組織分級量表對於檢測輕症Covid-19受試者之間的差異並不理想。第五,無法評估VV116對於預防進展為重症或死亡的效果,因為兩組均未發生任何事件。研究人員計劃在一項單獨的試驗中對此進行評估(NCT05242042)。第六,直到2022年5月24日美國疾病控制和預防中心發佈公告後,研究人員才發現Paxlovid存在的反彈情況。因數據非常有限,不適合在試驗中進行分析。
“在感染早期給予口服抗病毒藥物是可行的。如果及時給予此類療法,可以幫助減輕住院負擔,促進暴露後預防,並可能最大限度地減少家庭傳播。”研究人員表示。
曹彬指出,“從目前的情況來看,靶向減少重症發生這一適應證已經基本不可能完成。針對新冠門診輕症患者的症狀改善適應證,是目前尚未被滿足的臨牀需求。由於流行毒株始終在發生變化,相應的臨牀症狀也出現了不同程度改變。美國FDA在2020年9月公佈的Covid-19藥物臨牀試驗指導原則將14項症狀作為主要終點,這是針對早期的新冠毒株症狀。VV116研究所採用的臨牀症狀緩解修改為11個症狀的緩解,未包含味覺障礙、嗅覺障礙、乏力/疲勞。不斷變化的外部環境不僅是VV116研究團隊需要面臨的,對其他新藥臨牀試驗團隊也是一個重大考驗。”