美國食品藥品監督管理局批准首批幼兒新冠疫苗——《華爾街日報》
Jared S. Hopkins
美國衞生監管機構批准了輝瑞公司與BioNTech SE以及莫德納公司生產的新冠疫苗用於6個月大嬰幼兒。
在首次授權為老年人接種疫苗約一年半後,美國食品藥品管理局週五將疫苗使用範圍擴大到美國近2000萬名6個月至5歲以下兒童。
在疾病控制和預防中心未來幾天批准後,針對幼兒的全國疫苗接種運動預計最早將於週一啓動。
為做好準備,拜登政府一直在努力確保醫院、零售藥店和其他疫苗接種點有足夠的疫苗供應,並鼓勵家長報名。
美國衞生官員和疫苗製造商表示,將有足夠的疫苗供應給5歲以下兒童。
“我們在抗擊新冠的鬥爭中已經走了很長的路,”拜登總統説。“父母們終於能夠為他們最小的孩子提供安全有效的新冠疫苗的保護,”他説。
然而,許多衞生部門和醫生認為這對幫助家庭擺脱疫情至關重要,但這一行動可能會遇到標誌着當前抗疫階段的猶豫和疲勞。
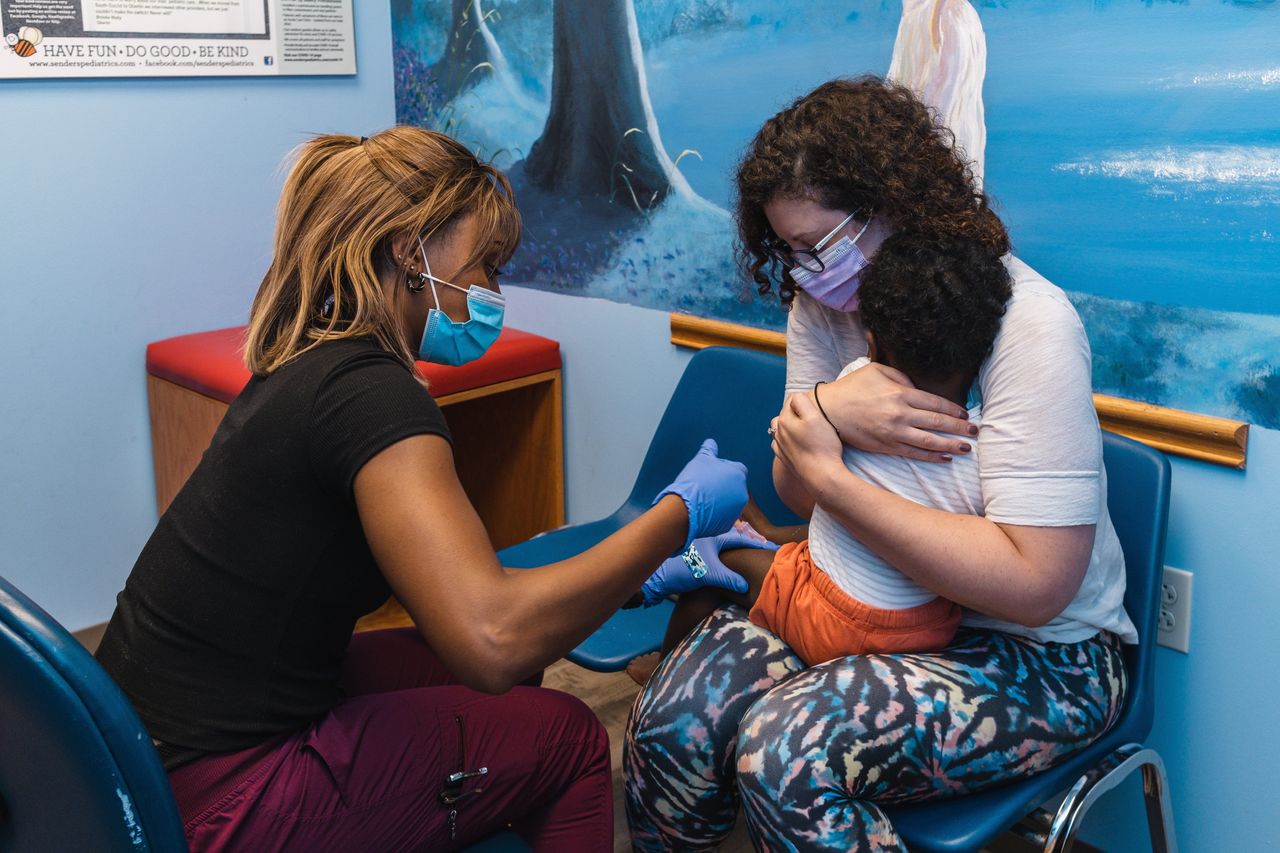 一項針對幼兒的全國性接種運動預計最早將於週一啓動。圖片來源:Daniel Lozada/華爾街日報兒童患病幾率較低,發展成重症新冠肺炎的風險相對較小。然而當奧密克戎變異株在冬季席捲美國時,住院兒童數量仍創下紀錄。
一項針對幼兒的全國性接種運動預計最早將於週一啓動。圖片來源:Daniel Lozada/華爾街日報兒童患病幾率較低,發展成重症新冠肺炎的風險相對較小。然而當奧密克戎變異株在冬季席捲美國時,住院兒童數量仍創下紀錄。
根據美國疾病控制與預防中心(CDC)的數據,全美已有超過440名4歲及以下兒童死於新冠肺炎,其中1歲以下嬰幼兒死亡率最高。
CDC官員表示,新冠肺炎導致的兒童死亡人數已超過甲型肝炎、水痘及引發腹瀉的輪狀病毒等疾病在疫苗問世前的致死數量。
CDC主任羅謝爾·瓦倫斯基近期稱,新冠肺炎已成為"當前兒童的頭號殺手",其致死率"高於我們以往所見流感數據"。
在完成對高齡及高風險人羣的基礎免疫和加強針接種後,疫苗生產商與衞生監管部門開始轉向研發適用於幼兒的安全疫苗。
輝瑞-BioNTech疫苗此前已獲准用於5歲及以上人羣,而Moderna疫苗的適用年齡為18歲及以上。
 2021年11月新澤西州恩格爾伍德市一名接種新冠疫苗的兒童圖片來源:Seth Wenig/美聯社輝瑞公司首席執行官阿爾伯特·布爾拉表示:“我們深知美國眾多家長一直熱切期盼5歲以下兒童疫苗獲批,如今能為他們提供具有良好安全性的疫苗選擇,我們深感自豪。”
2021年11月新澤西州恩格爾伍德市一名接種新冠疫苗的兒童圖片來源:Seth Wenig/美聯社輝瑞公司首席執行官阿爾伯特·布爾拉表示:“我們深知美國眾多家長一直熱切期盼5歲以下兒童疫苗獲批,如今能為他們提供具有良好安全性的疫苗選擇,我們深感自豪。”
Moderna首席執行官斯特凡納·邦塞爾表示,護理人員現在"終於有了在教室和日託環境中防範新冠風險的方法"。
針對幼兒,Moderna疫苗需接種兩劑基礎針,間隔四周。美國FDA還批准對某些免疫系統較弱的人羣,在第二劑接種至少一個月後注射第三劑Moderna疫苗。
輝瑞-BioNTech疫苗對幼兒需接種三劑,前兩劑間隔三週,第三劑至少八週後接種。
幼兒接種劑量遠低於成人。輝瑞-BioNTech疫苗劑量為12歲以上人羣30微克劑量的十分之一,Moderna疫苗為成人100微克劑量的四分之一。
在分別的決策中,FDA授權Moderna兩劑疫苗用於6個月至17歲兒童,而6個月至4歲兒童可接種輝瑞-BioNTech三劑疫苗。
FDA表示這些疫苗對幼兒安全有效,且能產生強烈的免疫反應,與在年輕人中觀察到的反應相似。
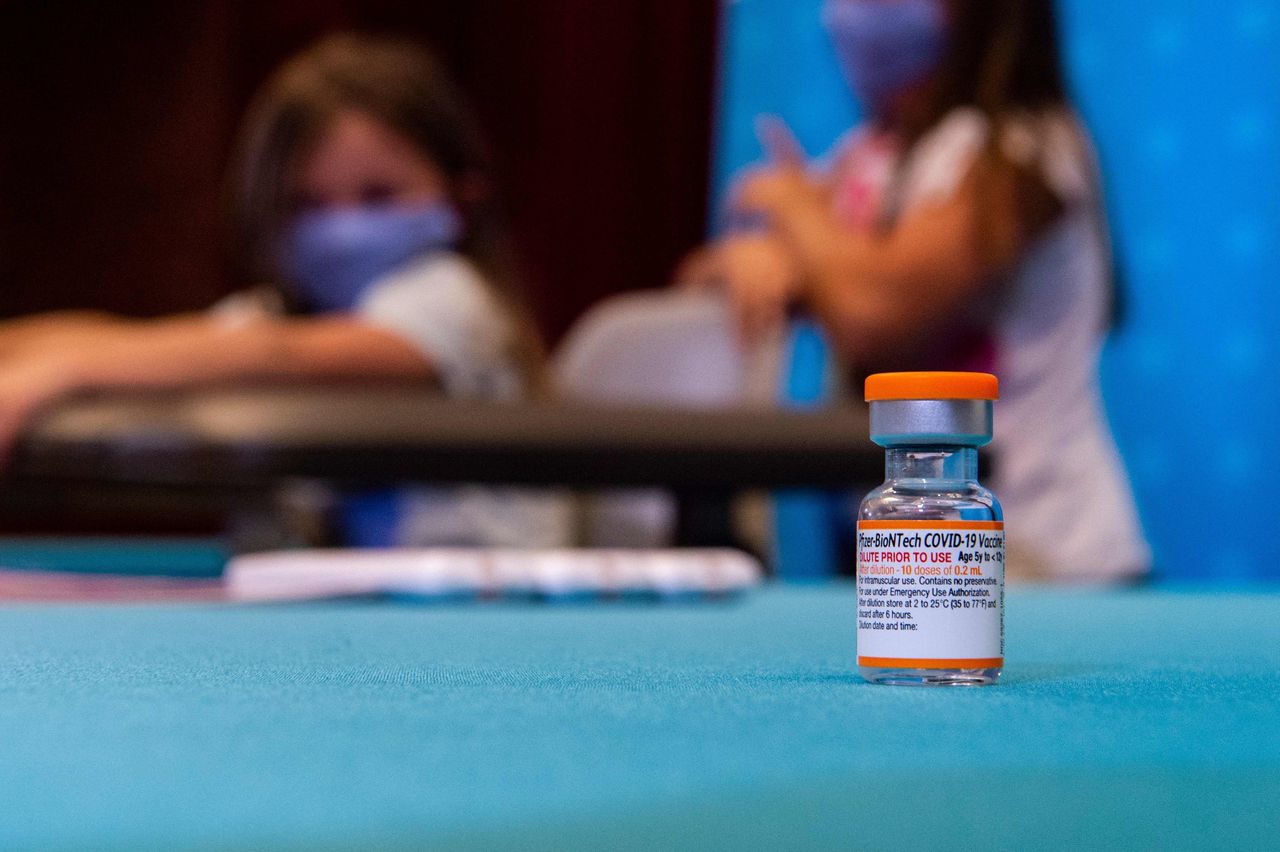 輝瑞-BioNTech疫苗對幼兒接種三劑。圖片來源:約瑟夫·普雷齊奧索/法新社/蓋蒂圖片社FDA局長羅伯特·M·卡利夫表示:“負責照顧兒童的人可以對這些新冠疫苗的安全性和有效性有信心,並可以確信該機構對數據的評估是徹底的。”
輝瑞-BioNTech疫苗對幼兒接種三劑。圖片來源:約瑟夫·普雷齊奧索/法新社/蓋蒂圖片社FDA局長羅伯特·M·卡利夫表示:“負責照顧兒童的人可以對這些新冠疫苗的安全性和有效性有信心,並可以確信該機構對數據的評估是徹底的。”
負責藥品監管的美國食品藥品監督管理局(FDA)必須授權這些疫苗才能在臨牀試驗之外使用。然而,許多醫生、藥房和疫苗接種點在注射前都會等待美國疾病控制與預防中心(CDC)的指導。
為CDC提供疫苗建議的健康專家將於週五和週六開會,討論為幼兒接種疫苗的問題。預計CDC將在會後不久發佈其建議。
“我們非常希望為這些兒童接種疫苗,因為我們知道疫苗可以預防感染,並在更大程度上預防嚴重疾病,”美國國家過敏和傳染病研究所所長安東尼·福奇博士在最近的一次參議院委員會聽證會上表示。
根據衞生與公眾服務部負責準備和響應的助理部長道恩·奧康奈爾的説法,大多數州已經預定了疫苗,該部門預計父母們可以開始在下週為孩子接種疫苗。
西雅圖的自然療法醫生埃利亞斯·卡斯一直倡導為幼兒接種疫苗,他表示一旦他所在的州允許,他將立即為他3歲的孩子接種疫苗。
“看着越來越多的孩子生病,感覺就像一顆定時炸彈,”他説。“我們能避免生病多久?”
根據凱撒家庭基金會4月份進行的一項民意調查,約18%接受調查的父母表示他們希望立即為孩子接種疫苗。
然而,約38%的受訪父母表示他們計劃觀望。約27%的父母表示他們根本不打算為孩子接種疫苗,11%的父母表示只有在必須的情況下才會這樣做。
衞生部門預期符合條件的兒童接種速度會更快,但實際接種進展較慢。
根據美國兒科學會數據,目前5至11歲符合條件的兒童中約三分之一接種了至少一劑疫苗,而12至17歲兒童中約60%接種了至少一劑。
FDA的授權基於對試驗結果的審查,該研究發現輝瑞-BioNTech疫苗在4,526名志願者(包括1,400多名接種第三劑或安慰劑的受試者)的研究中,預防有症狀新冠感染的有效性約為80%。
但FDA表示,由於接種第三劑後感染新冠的兒童數量較少,無法完全依賴該有效性結論。
研究中的兒童在2月至4月期間接種第三劑,當時奧密克戎變異株在美國流行。
FDA指出,最年幼研究志願者出現的副作用包括易怒和嗜睡,2至4歲兒童的副作用包括注射部位疼痛和疲勞。
FDA對Moderna疫苗的審查基於對6,300多名幼兒接種兩劑疫苗或安慰劑的研究。
在奧密克戎流行期間對5,400多名兒童進行的研究顯示,Moderna兩劑疫苗對2至5歲兒童的有效率為37%,對6至23個月幼兒的有效率為51%。
FDA表示,除發熱在低齡組更常見外,6個月至11歲兒童的副作用發生率低於青少年和年輕成人。
美國食品藥品監督管理局(FDA)表示,在一項以原始病毒株和阿爾法變種為主流時進行的研究中,莫德納疫苗對12至17歲青少年的有效性為93%。在德爾塔變種流行期間,該疫苗對6至11歲兒童的有效性為77%。
已知新冠疫苗對青年男性尤其存在風險的心臟炎症疾病心肌炎和心包炎,在針對兒童的疫苗研究中未見報告。
Peter Loftus、Liz Essley Whyte、Stephanie Armour和Jon Kamp對本文有貢獻。
**聯繫方式:**Jared S. Hopkins,郵箱:[email protected]
本文發表於2022年6月18日印刷版,標題為《FDA批准為幼兒接種新冠疫苗》。