國產新冠口服藥加速圍剿Paxlovid_風聞
新行情-01-30 17:00
兩款口服小分子新冠病毒治療藥物同日獲批上市。
1月29日,國家藥品監督管理局官網顯示,按照藥品特別審批程序,附條件批准先聲藥業1類創新藥先諾特韋片/利托那韋片組合包裝(商品名稱:先諾欣)、旺實生物1類創新藥氫溴酸氘瑞米德韋片(商品名稱:民得維)上市。
 上述兩款藥物均用於治療輕中度新冠病毒感染的成年患者。國家藥監局要求上市許可持有人繼續開展相關研究工作,限期完成附條件的要求,及時提交後續研究結果。
上述兩款藥物均用於治療輕中度新冠病毒感染的成年患者。國家藥監局要求上市許可持有人繼續開展相關研究工作,限期完成附條件的要求,及時提交後續研究結果。
截至目前,我國已有五款口服小分子新冠病毒治療藥物獲批上市,分別是輝瑞的Paxlovid、默沙東的莫諾拉韋、真實生物的阿茲夫定、先諾欣和民得維。
先諾欣是一款口服小分子抗新冠病毒創新藥,其中先諾特韋針對SARS-CoV-2病毒複製必須的3CL蛋白酶,與低劑量利托那韋聯用有助於減緩先諾特韋在體內的代謝或分解,提高抗病毒效果。
2021年11月17日,港股公司先聲藥業與中國科學院上海藥物研究所、武漢病毒研究所訂立技術轉讓合同,獲得先諾特韋(SIM0417)在全球開發、生產及商業化的獨家權利。
先聲藥業介紹,先諾欣III期註冊臨牀研究是迄今覆蓋最廣泛感染新冠奧密克戎毒株的中國患者人羣下,第一個進入III期註冊性臨牀試驗並完成全部計劃入組病例數的註冊臨牀。該研究也是按照國際標準設計,全球首個達成以11種症狀持續恢復為主要終點的III期註冊臨牀研究。
 研究納入有症狀的輕中度新型冠狀病毒感染(COVID-19)患者、年齡≥18歲、SARS-CoV-2首次感染≤5天且COVID-19症狀發作≤3天的受試者。主要終點為從首次給藥至11種目標COVID-19症狀首次持續恢復(症狀評分均為0且持續2天)的時間,次要終點包括病毒學指標等。
研究納入有症狀的輕中度新型冠狀病毒感染(COVID-19)患者、年齡≥18歲、SARS-CoV-2首次感染≤5天且COVID-19症狀發作≤3天的受試者。主要終點為從首次給藥至11種目標COVID-19症狀首次持續恢復(症狀評分均為0且持續2天)的時間,次要終點包括病毒學指標等。
11種目標COVID-19症狀包括:咳嗽、鼻塞或流涕、咽痛或咽乾、呼吸短促或呼吸困難、頭痛、感覺發熱或發熱等。
在臨牀療效方面,先聲藥業稱,先諾欣組病毒載量呈現快速、大幅的下降;用藥後第5天,病毒載量對比安慰劑最大下降超96%。先諾欣組核酸轉陰時間較安慰劑組縮短約2.2天。
“推薦劑量為先諾特韋0.750g(0.375gx2片)聯用利托那韋0.1g(0.1gx1片),每12小時一次口服給藥,連續服用5天。”先聲藥業表示,作為首款具有自主知識產權的國產3CL抗新冠創新藥,先諾欣的成功上市,有望為中國患者帶來更有效的治療選擇。
安信證券1月2日研報曾預計,今年H1將迎來多個國產新冠藥上市。目前,眾生藥業RAY1216、前沿生物FB2001、廣生堂GST-HG171、開拓藥業普克魯胺均處於3期臨牀階段。
 從臨牀數據上看,截至目前,輝瑞Paxlovid仍被看作是最有效的小分子口服藥物,而輝瑞醫保國談的失敗無疑讓國產藥得到了發展的絕佳機會。
從臨牀數據上看,截至目前,輝瑞Paxlovid仍被看作是最有效的小分子口服藥物,而輝瑞醫保國談的失敗無疑讓國產藥得到了發展的絕佳機會。
作為國內獲批的第一款國產新冠藥,阿茲夫定勢必有自身的優勢。
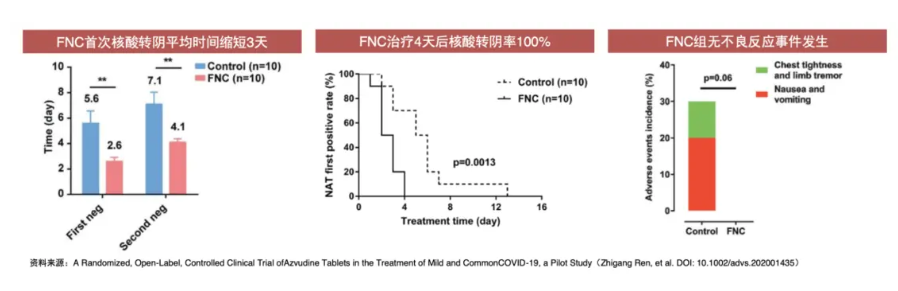
根據真實生物此前披露的臨牀數據顯示,首次給藥後第7天臨牀症狀改善的受試者比例阿茲夫定組40.43%,安慰劑組10.87%;病毒清除時間為5天左右。
安全性方面,總體耐受性良好,不良事件發生率阿茲夫定組與安慰劑組無統計學差異。
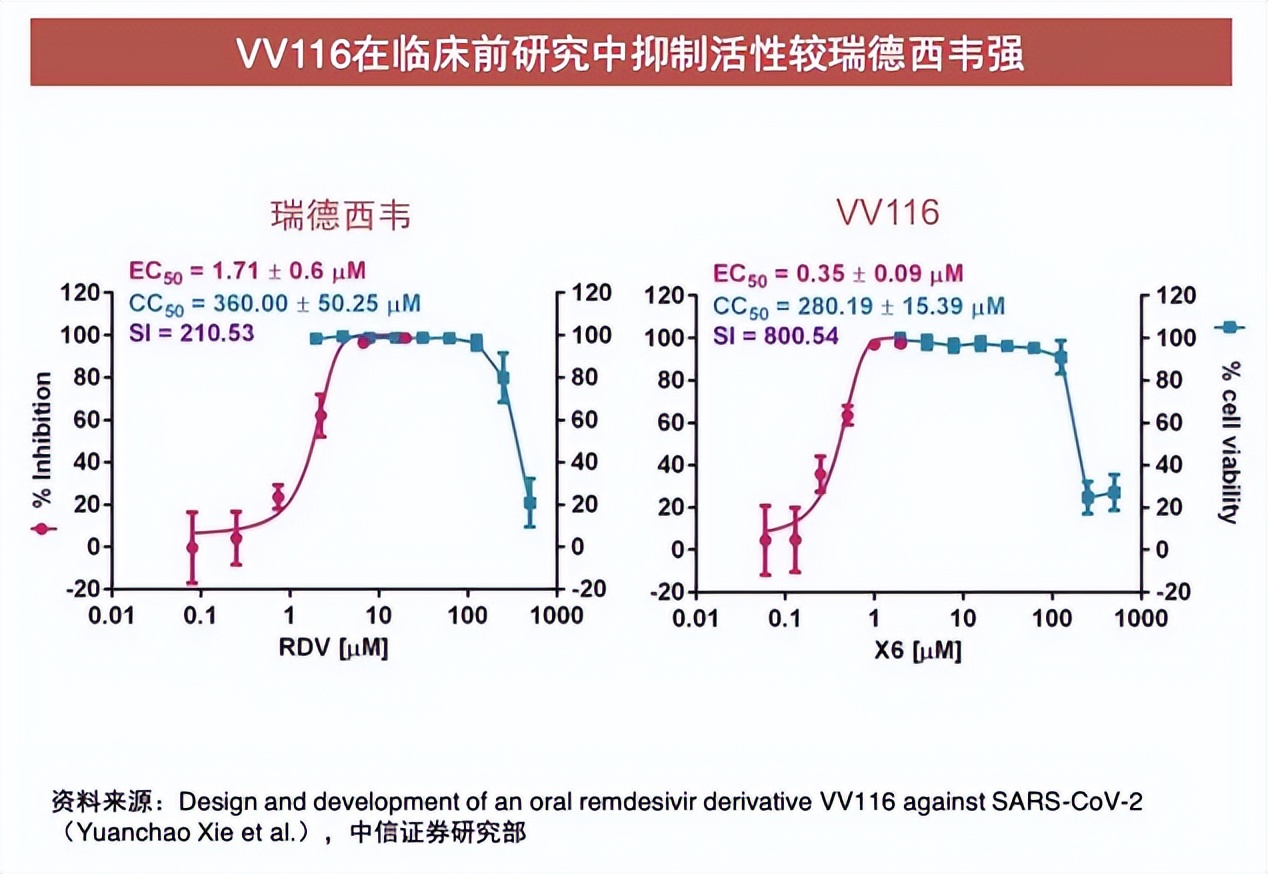
 資料顯示,君實生物的VV116是全球第3款口服新冠小分子藥物。中信證券去年4月16日研報表示,其是全球首款新冠藥瑞德西韋的衍生物,臨牀數據顯示,瑞德西韋能夠將新冠患者的住院或死亡風險降低87%,VV116作為升級版瑞德西韋,臨牀效果非常值得期待。
資料顯示,君實生物的VV116是全球第3款口服新冠小分子藥物。中信證券去年4月16日研報表示,其是全球首款新冠藥瑞德西韋的衍生物,臨牀數據顯示,瑞德西韋能夠將新冠患者的住院或死亡風險降低87%,VV116作為升級版瑞德西韋,臨牀效果非常值得期待。
 廣生堂於1月10日公告披露新冠口服藥泰中定(泰阿特韋GST-HG171片/利托那韋片)的IIT研究數據,顯示在縮短新冠患者核酸轉陰時間上明顯優於陽性對照Paxlovid和安慰劑對照,泰中定(試驗組)中位轉陰時間為8.4天,Paxlovid(陽性對照組)中位轉陰時間為9.5天,安慰劑組中位轉陰時間為10.3天。
廣生堂於1月10日公告披露新冠口服藥泰中定(泰阿特韋GST-HG171片/利托那韋片)的IIT研究數據,顯示在縮短新冠患者核酸轉陰時間上明顯優於陽性對照Paxlovid和安慰劑對照,泰中定(試驗組)中位轉陰時間為8.4天,Paxlovid(陽性對照組)中位轉陰時間為9.5天,安慰劑組中位轉陰時間為10.3天。
眾生藥業RAY1216為同是3CL靶點的國產新冠藥,1月2日公司公告III期臨牀研究完成全部病例數入組。
此前研究顯示,公告顯示,RAY1216在野生株、阿爾法、貝塔、德爾塔、奧密克戎等多種新冠病毒感染的細胞模型中,可以有效抑制新冠病毒複製,展現了廣譜抗新冠病毒的能力。
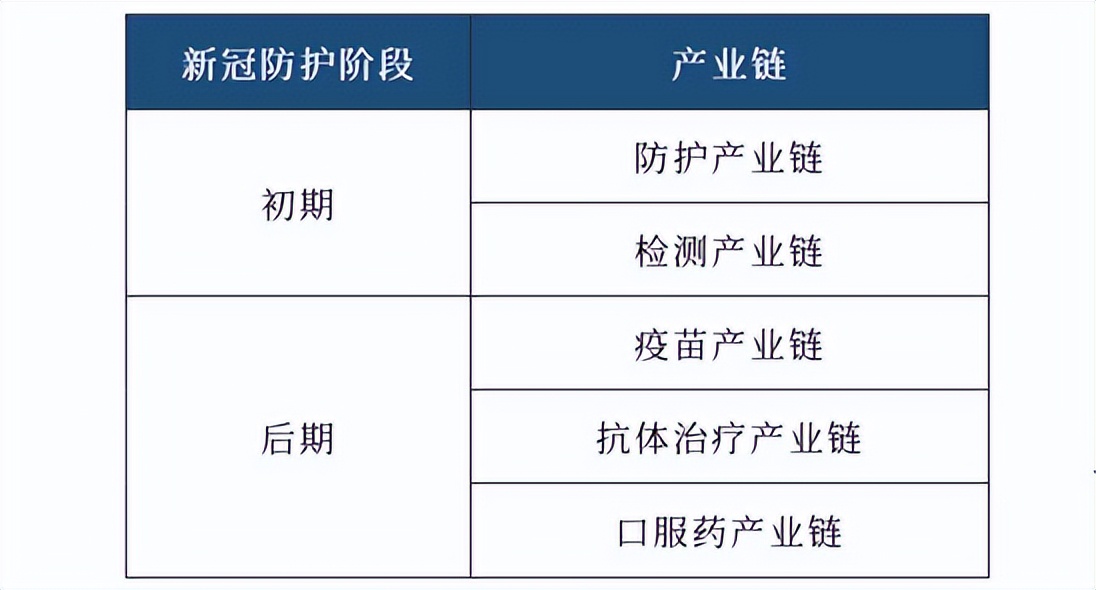 中航證券沈文文在近日研報表示,當前防疫重心從防控感染轉到醫療救治,除對大多數人羣進行對症治療外,對於高風險人羣,如何降低重症、死亡風險成為重中之重。
中航證券沈文文在近日研報表示,當前防疫重心從防控感染轉到醫療救治,除對大多數人羣進行對症治療外,對於高風險人羣,如何降低重症、死亡風險成為重中之重。
上市的新冠小分子口服藥在降低重症率、死亡率方面具有確定證據,在大規模感染的背景下仍是未來產業鏈投資機會中的重要一環。