基因編輯峯會驚人宣佈:兩隻公鼠“生下”後代_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。03-11 10:17
CRISPR基因編輯讓“定製嬰兒”“超人類”不再只是科幻小説裏的天方夜譚。委員會稱,這些新技術,讓科學家比以往任何時候都更容易操縱基因。
**撰文 |**凌駿
3月8日,在倫敦舉行的第三屆人類基因組編輯國際峯會上,日本生殖生物學家Katsuhiko Hayashi宣佈,他成功將雄性小鼠的皮膚細胞改造成了卵子,使其與正常精子受精,最終培育出了7只幼鼠。
“純就技術而言,即使只在10年內,它也有可能用在人類身上。”相關研究已提交《自然》申請發表,Katsuhiko Hayashi表示,他贊成將這項技術推向臨牀,如果它最終被證明可以“安全地”讓同性生育。

但包括他本人在內,不少專家對這項技術能否被全社會接受表示疑慮。由於2018年第二屆峯會“基因編輯嬰兒事件”投下的陰影延續至今,除了基因工程領域的最新進展,倫理問題也是本屆會議討論的重點,主要集中在可遺傳基因編輯上。
將雄鼠皮膚細胞變成卵子
儘管還未經正式期刊發佈,但Katsuhiko Hayashi的最新研究仍在本屆峯會上賺足了眼球。
依靠一系列複雜的操作,Katsuhiko Hayashi教授將攜帶XY染色體的雄鼠皮膚細胞,轉化成了母鼠 XX 版本的卵子。“這是全球第一個將哺乳動物雄性細胞改造成卵母細胞的案例。”Katsuhiko Hayashi教授説。
具體的,團隊先取得了雄性小鼠的皮膚細胞,將其編程為幹細胞樣狀態,以進一步產生誘導多能幹細胞 (iPS)——一種可以轉化為其他類型細胞的細胞。
隨後,團隊在培養物中培養這些細胞,直到其中一些自發地失去了Y染色體,並用另外細胞中“借”來新的X染色體取代,最終產生了具有2條相同X染色體的的iPS細胞。
“這其中最大的技巧就是X染色體的複製,”Katsuhiko Hayashi説,團隊建立了一個系統來實現這一過程。在此前的實驗中,他們對X 染色體進行了基因編輯,以便挑選出有兩個X的幹細胞。
緊接着,團隊將全新的iPS細胞放入卵巢類器官中培養,使iPS細胞發育成了卵子,再讓它們與正常精子進行體外受精,獲得了約600個胚胎。植入代孕小鼠體內後,最終成功誕生了7只壽命正常、健康並擁有生育能力的小鼠。
目前,Katsuhiko Hayashi和團隊已開始研究能否在人類細胞中複製這一過程,希望該技術能用於治療不孕症,包括患有特納綜合症的女性——她們的X染色體完全或部分缺失。另一方面,該技術也可以提供給性少數羣體。
“‘雄鼠卵子’品質欠佳,技術上也不夠安全。”Katsuhiko Hayashi表示。試驗中小鼠胚胎誕生的成功率只有約1%,而母鼠卵子正常受精的胚胎則通常為5%,但他預測,這些技術性問題約在10年內就能被克服,並用於人體。
但多數專家認為這一時間表過於樂觀,相較把男性細胞改造成卵子,目前即便是女性細胞也尚未實現。“科學家已經創造出女性卵子的前體,但它們均在減數分裂前就停止發育。”加州大學洛杉磯分校Amander Clark教授稱,克服一系列技術難關需要10到20年。
基因改造接連進入臨牀試驗
除了Katsuhiko Hayashi教授的動物試驗,遺傳病、血液病、癌症、心臟病……峯會還分享了基因編輯技術用於臨牀的重大突破。最引人注目的進展,包括針對兩種常見的β血紅蛋白病——β地中海貧血和鐮狀細胞病的療法。
來自美國的Victoria Gray是全球首個接受CRISPR基因編輯治療鐮狀細胞病的患者,她在會議上稱,由於紅細胞畸形,這種毀滅性的血液病讓她的前半身在劇烈疼痛中度過,幾乎失去了日常的活動能力,需定期前往醫院接受輸血和止痛治療。
基於CRISPR -Cas9基因編輯技術的產品CTX001改變了她的人生,研究人員體外改造了她的造血幹細胞,靶向沉默致病基因,再將數十億改造後的自體骨髓細胞回輸到Victoria Gray體內,使她產生足量的正常血紅蛋白。
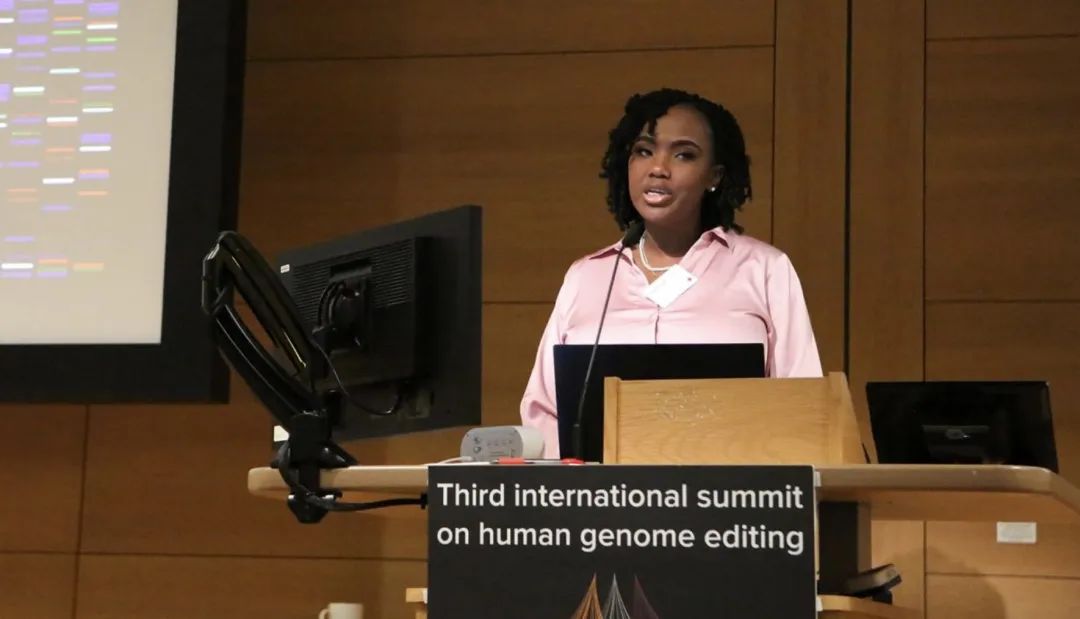
鐮狀細胞病患者Victoria Gray在峯會上發言(圖源:CNN)
相同的原理也可以用於治療β地中海貧血,包括CTX001在內,該疾病領域目前進入臨牀研究階段的基因編輯治療產品至少有6個,其中5個採用CRISPR技術。CTX001去年公佈的臨牀試驗結果顯示,44名接受治療的β型地中海貧血患者中,有42人不再需要定期輸血。
據悉,CTX001預計將在本月底向FDA提交批准文件,如獲批准,它將是全球首個上市的CRISPR -Cas9基因編輯療法。
與此同時,峯會還介紹了新的、更復雜的基因編輯技術,如“鹼基編輯”和“先導編輯”,其中華裔科學家劉如謙分享了精準醫學基因組編輯的現狀和機遇。
劉如謙被Nature評為“2017年影響世界十大科學人物”,相比CRISPR -Cas9需要依賴DNA雙鏈斷裂,他相繼開發的“鹼基編輯”和“先導編輯”被譽為“CRISPR 2.0”,能在不斷裂DNA雙鏈的情況下,實現單個遺傳字母互換,因此更加精準與安全。
去年7月,全球首個鹼基編輯臨牀試驗完成患者給藥,通過修改相關基因,促進患者體內“壞膽固醇”的降解,用於“一勞永逸”預防心血管疾病。
同期,來自倫敦大學學院的科學家定向修飾了健康供體T細胞的基因,為其添加了識別和攻擊癌性細胞的方法,同時規避免疫排斥的影響,成功治療了一名患有難治性白血病的青年。
“這些技術讓人類在基因組序列中擁有了一些發言權,我們不再受制於DNA裏的拼寫錯誤。”劉如謙稱,目前全球有50多項基因編輯相關研究正在進行。在基礎研究中,由於CRISPR能系統地改變癌細胞中的每一個基因,科學家們可以調查哪些基因與癌症發生有關。
與此同時,CRISPR的影響甚至遠超醫學領域。進化生物學家正在使用這項技術研究人猿類祖先的大腦,植物生物學家對種子進行編輯,以生產出含有“新維生素”或具有抗病能力的作物,其中一些可能會在未來幾年內進入超市。
CRISPR發展如此迅速,以至於法規的制定和倫理的討論顯得滯後,“鑑於這項技術只有 10年曆史,已經是非凡的進步。”CRISPR系統開拓者,諾貝爾化學獎得主Doudna教授在峯會上表示,“但使用這樣強大的技術,需要迎接對於責任的挑戰。”
可及性是一方面因素,以CTX001為例,即便它最終獲批,單個患者的治療費用可能超過200萬美元,學界擔憂基因編輯療法將成為“富人專屬”。
更重要的是,CRISPR讓“定製嬰兒”“超人類”不再只是科幻小説裏的天方夜譚。“這些新技術,讓科學家比以往任何時候都更容易操縱基因。”委員會在總結聲明中稱。
“胎兒編輯”陰雲
如果説Katsuhiko Hayashi的“同性生育”只是遊走在不同文化倫理間的模糊地帶,且仍處於動物階段,那關於“胚胎和生殖細胞編輯”的爭論,則是如今全球學界無可迴避的問題。
根據學界主流共識,基因編輯胎兒和生殖細胞仍是不可開啓的潘多拉魔盒。相應的擔憂包括安全性問題、“人造基因”流入人類基因庫、“定製嬰兒”興起、以及富人更可能獲得“優生”的機會等。
由於目前仍缺乏規範人類基因組編輯的國際法,主要依據各國法律以及倫理共識進行約束,大會指出,包括美國在內的許多國家,缺乏足夠強大的監管框架阻止“不道德”的基因編輯行為。
通過捆綁FDA等相應官方機構,在美國任何與胚胎編輯相關的療法/藥物都無法得到官方資助,也沒有資格獲批進入臨牀試驗,但私有資金資助的相關研究活動則無法完全禁止。
中國科學院動物研究所副研究員彭耀進也參與了本屆基因編輯大會,稱在中國申請基因編輯研究要先向政府申請,隨後會組織一系列討論和倫理審查。但他同樣表示,司法管轄權是有限的,法律法規只能控制某些部分,不能避免所有壞事的發生。
2021年,我國在《刑法修正案(十一)》中將“基因編輯人類胚胎並植入人體”明確定義為犯罪。 今年2月27日,衞健委等四部門進一步印發《涉及人的生命科學和醫學研究倫理審查辦法》。
但也有專家對胚胎編輯持相對開放態度,“當病人患有危及生命的疾病時,他們希望自己的聲音能被聽到,此時抽象地批評‘定製嬰兒’,已經偏離了倫理討論的軌道。”劍橋大學Anna Middleton教授稱,她負責對接了一個由21人組成的英國公民陪審團。
就在峯會召開前幾天,該公民陪審團發佈了一份報告,敦促英國政府考慮修改法律,針對嚴重遺傳病,允許科學家對人類胚胎進行基因組編輯。該陪審團由受遺傳病影響的人組成,有些是死於遺傳病孩子的父母,有些則是患者,如身患囊性纖維化、努南綜合症等。
俄勒岡健康與科學大學生物學家Shoukhrat Mitalipov一直在尋找基因編輯胚胎的安全方法,他在接受採訪時稱,“有上萬個單基因突變,影響了全球數億人,我們本可以解決。”另一些專家也表示,這可能會帶來巨大獲益,包括根除數以千計、困擾家族幾代人的可怕遺傳病。
他們認為,當下不應該“一票否決”胚胎編輯,而是要討論如何安全、合規地進行此類研究。一個證明是,在本次峯會上,與會專家報告的基因編輯技術發展,已讓編輯人類胚胎和生殖細胞變得相對更安全。
儘管存在一些爭論,峯會委員會在閉幕聲明中依舊錶示,“目前可遺傳的人類基因組編輯仍是不可接受的。”
解釋型新聞網“the conversation”發表評論稱,修改基因以防止嬰兒死亡,或許可以接受,但用來預防生命後期的疾病,則不可接受。其中的界限依舊模糊,哪些疾病適合作為胚胎編輯的目標,並未達成共識。
委員會強調,除非胚胎編輯至少符合合理的安全性和有效性標準,並且在負責任治理的嚴格監督體系下開發和測試。但目前這些條件還沒有被滿足。
墨西哥國立自治大學人權律師Arellano則表示,“我們需要改變執法方式,(對基因編輯的監管)應被視為國際管轄權。”