Nectin-4 ADC:一場剛剛起跑的競賽_風聞
氨基观察-生物医药新时代的商业智库和价值灯塔07-31 11:24
在這個ADC大爆炸時代,風險沒有消失,但機遇也始終存在。Nectin-4 ADC領域的機遇,就在浮現。
儘管ADC領域已經十分火熱,但Nectin-4 ADC的研發可以説尚處於剛剛起步階段。該領域已經有Seagen/安斯泰來開發的Padcev(Enfortumab Vedotin,EV)於2019年獲批上市上市。
市場對其充滿極高的預期,Nature Reviews預測,其2026年銷售額將達到34億美元,將是排名第二的ADC藥物。
但對於其它後來者來説,Padcev並非不可超越,況且Nectin-4靶點還有很大的適應症探索空間。這也引發了國內藥企的關注。當前,邁威生物、科倫博泰等國內藥企紛紛入局。
一場競逐賽,悄悄在Nectin-4 ADC領域打響了。
/ 01 / 極具潛力的Nectin-4
一款ADC的前景如何主要取決於靶點,而Nectin-4正是一個極具潛力的靶點。
Nectin-4又稱脊髓灰質炎病毒受體相關蛋白4 (PVRL4),是免疫球蛋白樣分子Nectin家族的一員。該家族位於細胞的粘附連接處,參與細胞間的粘附,對細胞分化、增殖、遷移和免疫調節信號傳導等過程具有重要作用。
不過,與家族的其他成員不同,Nectin-4在成人正常組織細胞中弱表達,在多種腫瘤細胞中高表達,如膀胱癌、乳腺癌、胰腺癌等。
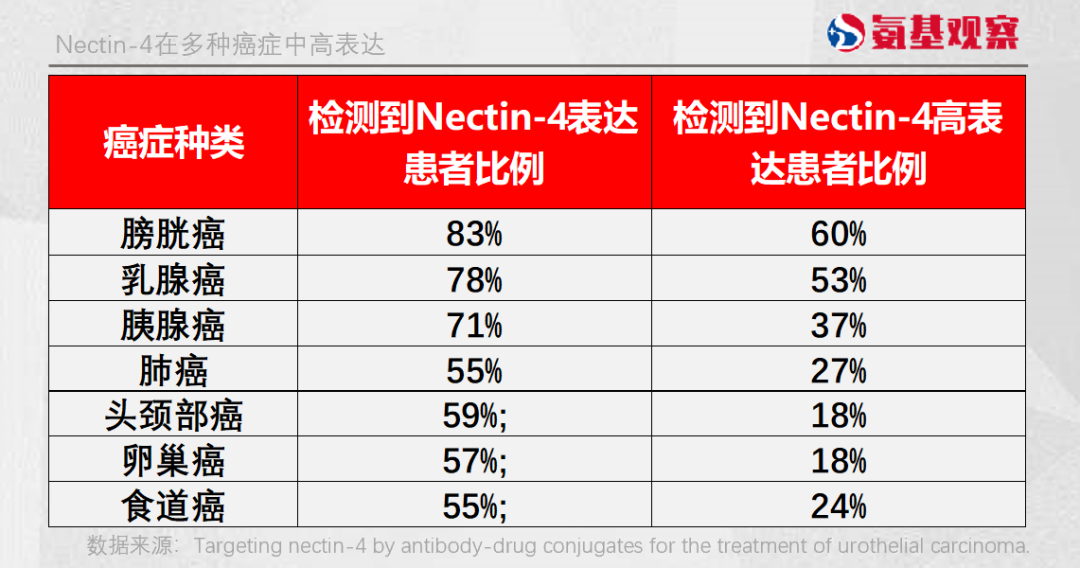 由於其大多數癌症中均可以被檢測到,所以靶向Nectin-4 ADC被認為可以廣泛用於治療各種癌症。不過,其第一站是膀胱癌。正如上文所説,Padcev已經上市。
由於其大多數癌症中均可以被檢測到,所以靶向Nectin-4 ADC被認為可以廣泛用於治療各種癌症。不過,其第一站是膀胱癌。正如上文所説,Padcev已經上市。
這並不讓人感到意外。一方面,膀胱癌是Nectin-4比例最高的領域;另一方面,膀胱癌有着較大的患者羣體,治療手段又極為稀缺。
人數方面,據報告,全球膀胱癌每年新發病例約57.3萬例,死亡21.2萬例,其中約90%患者為尿路上皮癌(UC)。大約12%的患者在確診時已進展為局部晚期或腫瘤發生轉移,而轉移性UC患者的5年生存率僅為5%。
目前,順鉑類化療是局部晚期或轉移性疾病的標準治療方案,但其中位總生存期僅為約14個月。
但是,一半以上的患者由於腎功能不全、表現不佳或其他重大合併症(包括心力衰竭、神經病變或聽力損失)而無法接受順鉑類化療,只能接受卡鉑治療,而卡鉑治療的患者中位總生存期更低,只有9個月。
儘管靶向PD-1/L1治療藥物為這些患者提供了新選擇,但只有少數患者會出現持久反應,轉移後患者對PD-1/L1反應率較低。
所以,靶向Nectin-4 ADC藥物Padcev的出現,成為了UC患者新的希望。
/ 02 / Padcev帶來的希望與存在的問題
Padcev並沒有辜負人們對它的期待。
在Ⅰ期和Ⅱ期臨牀試驗中,對既往接受過PD-1/L1抑制劑且不適合接受含順鉑化療的局部晚期或轉移性尿路上皮癌患者具有明顯的療效,患者的客觀緩解率為51%,22%的患者達到完全緩解,中位緩解持續時間為13.8個月。
Ⅲ期臨牀試驗數據顯示,對既往接受鉑類化療和ICI治療的局部晚期或轉移性尿路上皮癌患者,與化療相比,Padcev(EV)可顯著改善患者中位總生存期和無進展生存期(PFS)。
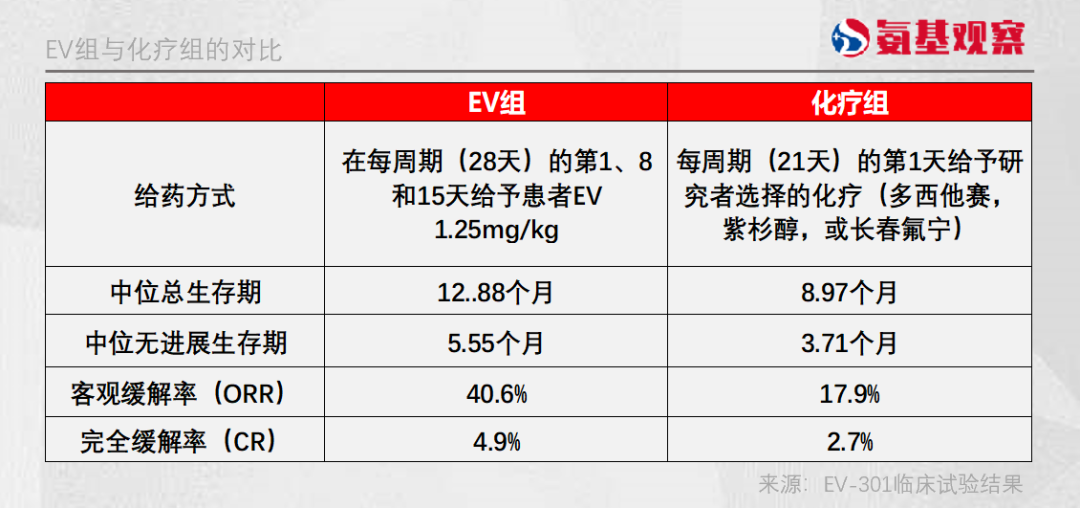 基於這些優秀的臨牀數據,2019年12月,FDA迅速通過了對Padcev的審批,用於先前接受過PD-1 / L1抑制劑和含鉑化療的局部晚期或轉移性尿路上皮癌成年患者。
基於這些優秀的臨牀數據,2019年12月,FDA迅速通過了對Padcev的審批,用於先前接受過PD-1 / L1抑制劑和含鉑化療的局部晚期或轉移性尿路上皮癌成年患者。
之後,Padcev治療尿路上皮癌的適應症進一步擴大。
2022年9月,默沙東公佈了聯合帕博利珠單抗(Keytruda,K藥)聯合EV的Ⅰ/Ⅱ期臨牀試驗數據,用於一線治療不適合順鉑治療的晚期尿路上皮癌患者時,客觀緩解率為68%,12%的患者實現完全緩解,
今年4月,該聯合療法獲FDA突破性療法認定,用於不適合順鉑治療的晚期尿路上皮癌的一線治療。
根據Seagen官網,其目前還有7項臨牀試驗正在推進。
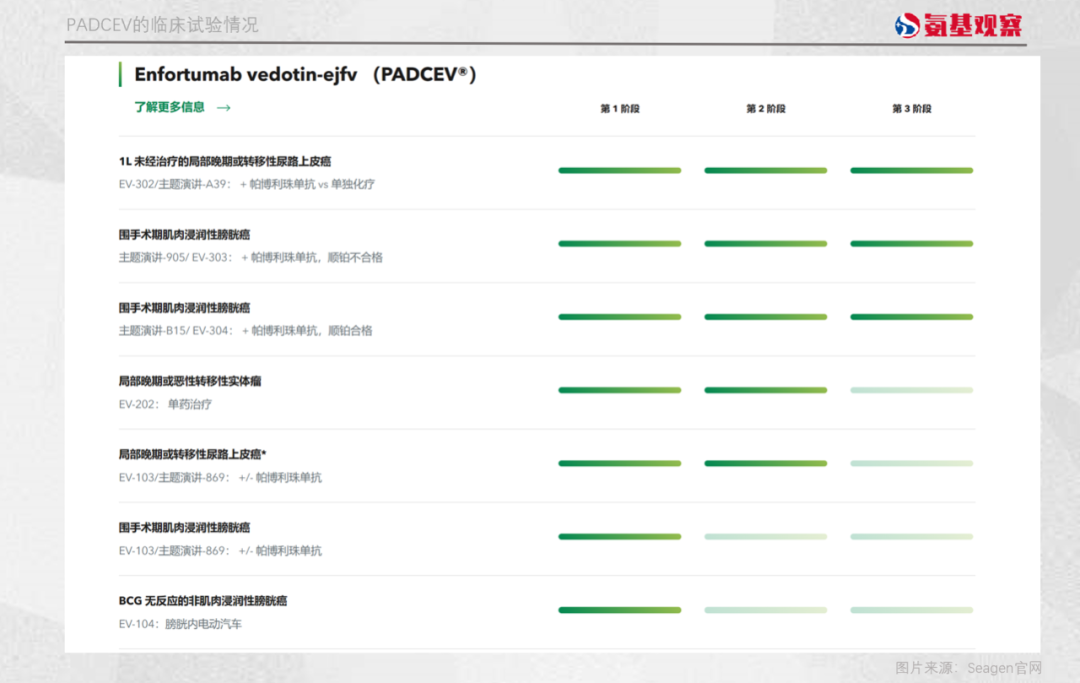 但可以發現,這些臨牀試驗主要的應用範圍集中在膀胱癌領域,對於此前提到的其他癌症應用較少,只有一項治療局部晚期或惡性轉移性實體瘤處於Ⅱ期臨牀試驗階段,尚未有數據公佈。
但可以發現,這些臨牀試驗主要的應用範圍集中在膀胱癌領域,對於此前提到的其他癌症應用較少,只有一項治療局部晚期或惡性轉移性實體瘤處於Ⅱ期臨牀試驗階段,尚未有數據公佈。
此外,由於Nectin-4在角質形成細胞、汗腺和毛囊中低表達,Padcev可能引起嚴重和致命的皮膚不良反應,包括史蒂文斯-約翰遜綜合徵(SJS)和中毒性表皮壞死鬆解(TEN),被FDA黑框警告。
這些缺陷成為了後來者想要突破的關口。
/ 03 / 競賽還在繼續
儘管相較於Padcev,其他企業的產品都尚處於臨牀早期階段,但這也為這些後來者設計更優化的ADC形式提供了機會。
後來者針對Padcev現有的毒性問題和臨牀療效方面均在進行改善。
比如,以環形雙肽設計平台為主的Bicycle Therapeutics公司開發的BT8009,是雙環肽與MMAE毒素偶聯藥物。
由於其為雙環肽,分子量比傳統的ADC小,更容易進入腫瘤微環境內釋放毒素,對腫瘤細胞的殺傷效果,並且不需要通過胞吞進入細胞內發揮作用,可以有效避免患者對ADC的耐藥性。同時,它在血漿中的半衰期很短,對其他組織的毒副作用降低。
BT8009在尿路上皮癌患者也有明顯療效,2022年公佈的中期1期研究結果顯示,8名接受劑量為每週5.0 mg/m2的BT8009治療的尿路上皮癌患者中,4名患者獲得確認緩解,其中一名患者獲得完全緩解,未出現皮膚和眼部毒性問題。
Bicycle Therapeutics公司的臨牀前試驗顯示,在多種其他腫瘤模型,BT8009對腫瘤的殺傷效果也與Padcev相當甚至更優。
由Emergence公司設計的ETx-22則是對抗體進行了改良,使其不結合皮膚表達的Nectin-4。儘管尚處於臨牀階段,但據其創始投資者Herdelberg Pharma的説法,禮來十分看好這款產品,將收購Emergence公司。
不過正如之前所提到的,在Nectin-4 ADC領域,國內藥企的進度並不落後。目前已經有4家國內藥企的Nectin-4 ADC進入臨牀試驗階段,還有部分藥企,如君實生物正在進行臨牀前試驗。
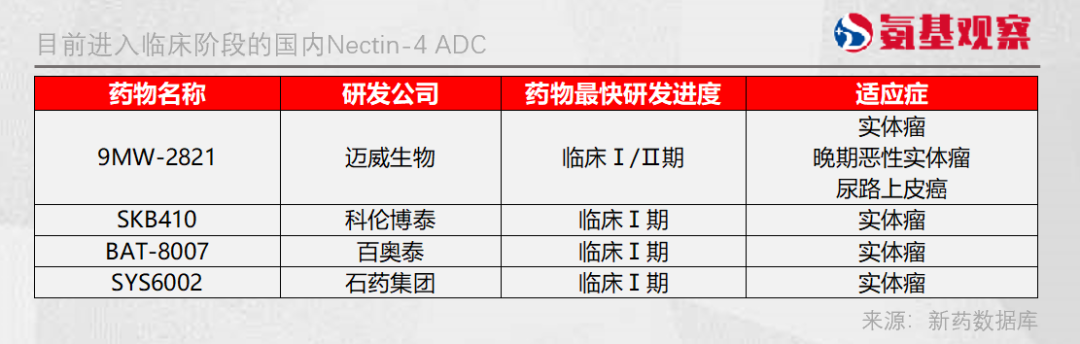 其中,進展最快的是邁威生物的9MW2821,已處於Ⅰ/Ⅱ期臨牀試驗階段,與BT8009進度相當。
其中,進展最快的是邁威生物的9MW2821,已處於Ⅰ/Ⅱ期臨牀試驗階段,與BT8009進度相當。
根據邁威生物公開的信息顯示,9MW2821的偶聯產物更加均一,反應後經純化獲得的抗體偶聯物終產品碎片峯低於3%,優於其他橋連定點技術開發的ADC藥物。
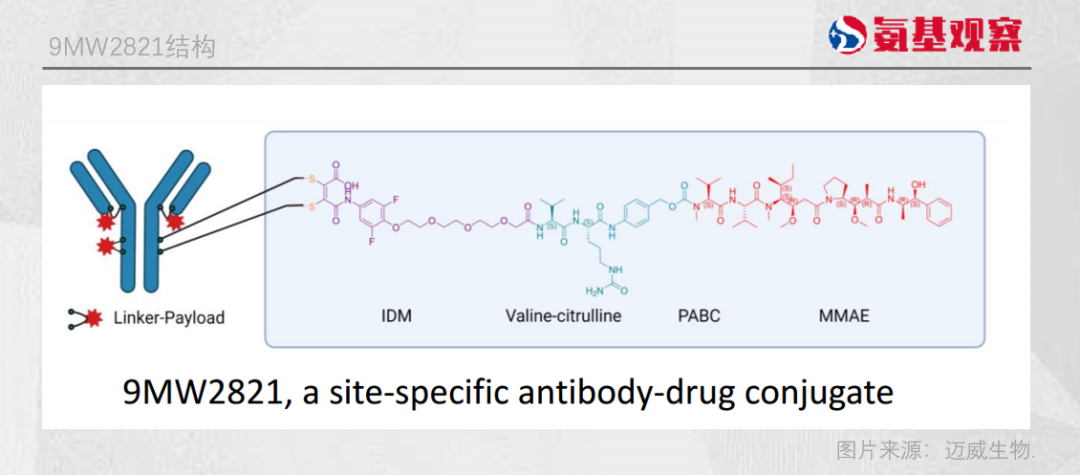 早期的臨牀試驗結果顯示,接受9MW2821的12例尿路上皮癌受試者中,客觀緩解率為50%; 6例宮頸癌受試者中也有一半的患者症狀緩解,並且安全性良好。
早期的臨牀試驗結果顯示,接受9MW2821的12例尿路上皮癌受試者中,客觀緩解率為50%; 6例宮頸癌受試者中也有一半的患者症狀緩解,並且安全性良好。
其在宮頸癌、前列腺癌、HER-2 陰性乳腺癌、非小細胞肺癌等適應症的臨牀試驗也正在推進。
7月22日,邁威生物宣佈將在2023 年歐洲腫瘤內科學會公佈9MW2821的最新臨牀試驗數據。
科倫博泰、百奧泰、石藥集團等企業產品目前處於Ⅰ期臨牀試驗階段,尚未有數據公佈。
這次,在Nectin-4 ADC領域的競爭,海外藥企與國內藥企處於同一起跑線上,誰能成為Padcev之後的BIC還有待揭曉。
