手機電池為何越用越不耐用_風聞
中科院物理所-中科院物理所官方账号-08-20 15:00
原創:中科院物理所
小編在摸魚把玩手機時
發現小編的手機電量轉瞬即逝
這讓我不得不感慨一聲
轉身尋找充電器了

為什麼我們的手機越來越不經用呢?
這還得從我們的電池説起。
01
手機電池的早期產品
1973年,世界上第一部手機在摩托羅拉實驗室誕生[1]。這一款手機非常笨重,但是得益於手機內置的鎳鎘電池,這部手機能夠脱離繁雜的電子線路,實現實時的移動通話。
鎳鎘電池作為第一個內置在手機的電池,本身較為笨重。在上個世紀流行的“大哥大電話”,大多采用鎳鎘電池。鎳鎘電池的容量低,而且含有毒害性較強的鎘,不利於生態環境的保護。並且鎳鎘電池還具有非常明顯的記憶效應:在充電前如果電量沒有被完全放盡,久而久之將會引起電池容量的降低。
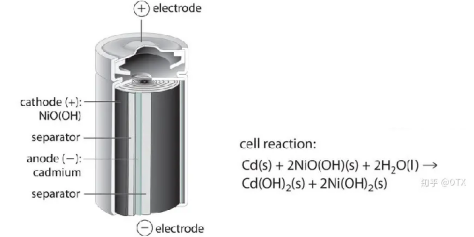
鎳鎘電池的基本結構[2]
1990年,日本索尼公司最早研發出鎳氫電池。相比於它的老前輩,鎳氫電池不僅能夠做的更加輕薄、容量也得到有效提升[3]。鎳氫電池的出現使手機變得更為便攜,手機也能夠支撐更長時間的通話。因此,隨着鎳氫電池的出現,笨重的鎳鎘電池被逐步取代,小巧的移動手機得以流行。但是鎳氫電池仍然存在記憶效應,這也是上一代的手機需要完全放電後再充電的原因。並且,由於鎳鎘電池的能量密度有限,因此當時的手機只能支持撥打電話等較為簡單的任務,離現在我們的智能手機形態還有較大的差距。
02
鋰電池的崛起
金屬鋰於十九世紀被發現。由於鋰具有相對較低的密度、較高的容量以及相對較低的電勢,因此作為原電池有得天獨厚的優勢。但是,鋰是非常活潑的鹼金屬元素,導致金屬鋰的保存、使用或是加工對環境要求非常高,並且都比其他金屬要複雜得多。因此,在研究以鋰作為電極材料的鋰電池的過程中,科學家們通過對鋰電池不斷發展、改進,克服了諸多研究難題,經過了很多階段,才最終讓它成為如今的模樣。
採用金屬鋰作為負極的鋰電池首先實現了商業化。1970年日本松下公司發明了氟碳化物鋰電池,這類電池的理論容量大,並且放電功率穩定,自放電現象小。但是這類電池無法進行充電,屬於一次鋰電池[2]。
20世紀70年代,來自埃克森美孚公司(ExxonMobil)的研發人員斯坦利·惠廷厄姆(M. Stanley Whittingham)提出了離子插層的電池充放電原理,並在1975年發表了二硫化鈦鋰電池的專利。在1977年,供職於埃克森公司的惠廷厄姆團隊開發出了以鋁鋰合金Li-Al為負極、二硫化鈦TiS₂為正極的二次電池,其中鋁鋰合金可以提高金屬鋰的穩定性增強電池的安全性[2]。在放電過程中,電池發生的電化學過程為:
負極:Li - e- → Li+
正極:xLi+ + TiS₂+ xe- → LixTiS₂
其中TiS₂為層狀化合物,層與層之間為相互作用較弱的範德華力(Van der Waals Force),體積較小的鋰離子能夠進入TiS₂的層間併發生電荷轉移,並貯存鋰離子,類似於將果醬擠入三明治中,這個過程為離子的插層[4][5]。在放電過程中,正極的TiS₂層間插入電解液中的Li+離子,接受電荷並形成LixTiS₂。

TiS₂的結構以及放電過程中發生插層反應的原理[6]
這一階段的二次鋰電池主要都採用了金屬鋰作為負極材料,通過改進正極材料提高電池的壽命和安全性。作為最早實現商業化的二次鋰電池,採用金屬鋰作為負極材料具有較低的負極電勢,電池的能量密度高,並且較為便攜,但是它的安全性也受到了廣泛的質疑。1989年春末加拿大公司Moli Energy生產的第一代金屬鋰電池發生了爆炸事件,這也使得金屬鋰電池的商業化一度陷入了停滯[2]。
為了提升鋰電池的安全性,研發新型電極材料對鋰電池非常重要。但是,使用其他鋰的化合物作為負極代替鋰,會提升負極電勢,降低鋰電池的能量密度,使電池容量降低。因此,尋找合適的新型電極材料也成為鋰電池研究領域的一道難題。
1980年前後,任教於英國牛津大學的約翰·班尼斯特·古迪納夫(John Bannister Goodenough)等人發現了能夠容納鋰離子的化合物鈷酸鋰LiCoO₂(LCO)。LiCoO₂相比於當時其他各類正極材料都具有更高的電勢。這使得采用LiCoO₂作為正極的鋰電池能夠提供更高電壓,具有更高的電池容量。[7][8]
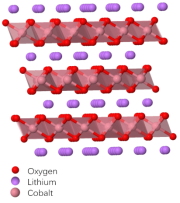
鈷酸鋰晶體結構示意圖[9]
鈷酸鋰晶體為層狀結構,屬於六方晶系。其中,O與Co原子構成的八面體格子在平面上排列成CoO₂層,並且CoO₂層之間被鋰離子相互間隔,並形成一個平面狀的鋰離子傳輸通道。這使鈷酸鋰能夠通過平面狀的鋰離子通道較快地傳輸鋰離子。鋰離子在鈷酸鋰中的脱離與嵌入過程類似一個插層過程。在輕度充放電過程中,鈷酸鋰能夠保持晶體結構的穩定。但是隨着鋰離子的逐漸脱出,鈷酸鋰具有向單斜晶系轉變的傾向[2]。以鈷酸鋰作為正極的鋰電池中,在放電過程中,正極發生的反應為:
正極:Li1-xCoO₂ + xLi+ + xe- → LiCoO₂
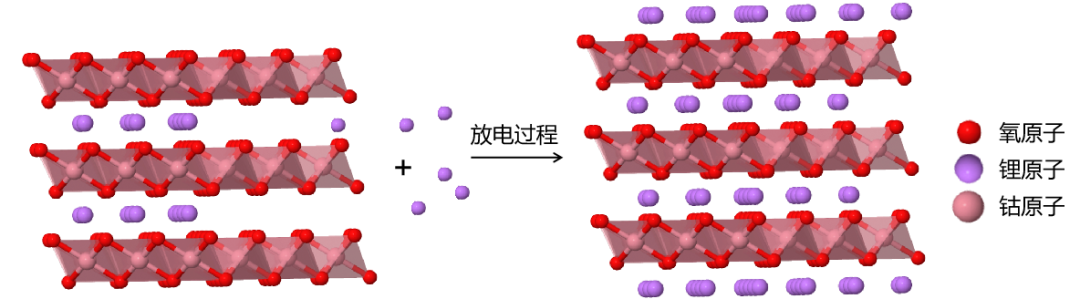
放電過程鈷酸鋰中鋰離子脱出示意圖[9]
相比於二硫化鈦,鈷酸鋰正極材料具有較****高的正極電勢,同時層狀結構鈷酸鋰能夠較快地傳輸鋰離子,是一種優良的鋰離子電池正極材料。
就在同一年,拉奇德·雅扎米(Rachid Yazami)發現了鋰離子在石墨中的可循環的離子插層現象,並驗證了石墨作為鋰電池正極的可行性[10]。石墨具有層片狀結構,並且與TiS₂類似,石墨中層與層之間由微弱的範德華力連接,這使得體積較小的鋰離子能夠進入石墨層間併發生電荷轉移。
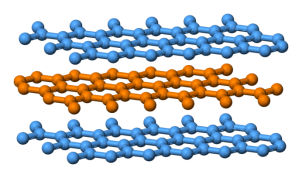
石墨具有層狀結構,層與層之間由範德華力相互連接 [11]
在1983年的論文中[12],雅扎米採用聚環氧乙烷-高氯酸鋰固態電解,並且以金屬鋰為負極,石墨為正極組成原電池。在放電過程中,作為正極的石墨髮生了如下反應:
nC + e- + Li+ → (nC, Li)
隨後發生:(nC, Li) → LiCn
在石墨作為正極的原電池放電過程中,鋰離子在石墨層中發生插層反應,發生電荷轉移並形成化合物LiCn。
03
鋰離子電池的到來
1982年,就職於日本旭化成公司的(Asahi Kasei Corporation)吉野·彰(Yoshino Akira)採用鈷酸鋰作為正極,聚乙炔(C2H2)n作為負極構建了鋰離子電池的樣品[13]。在鈷酸鋰電池的放電過程中,鋰離子從電池正極通過電解液遷移至鈷酸鋰中,實現電池放電。
但是,鈷酸鋰電池仍然存在許多問題。電池的負極聚乙炔的能量密度低,並且穩定性也較低。因此,吉野·彰採用了一種**新****型類石墨材料"soft carbon"**代替聚乙炔作為電池的負極材料,並且在1985年製備了第一塊鋰離子電池原型,並申請了專利[10]。由吉野·彰設計的鋰離子電池原型成為許多現代電池的雛形。
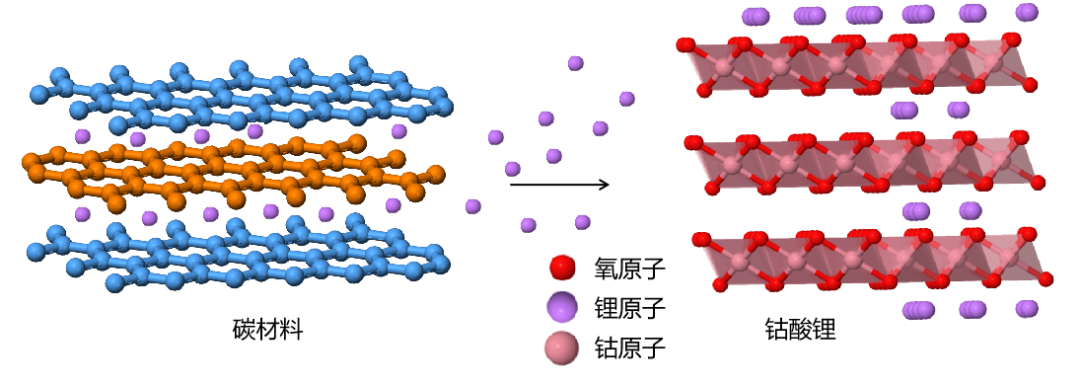
鋰離子電池放電,鋰離子遷移過程示意圖
與鋰電池相比,吉野·彰設計的以碳質材料為負極,鈷酸鋰為正極的原電池擺脱了金屬鋰,因此這一類電池也被稱為**“鋰離子電池”**。由於鈷酸鋰鋰離子電池中,鋰離子在正負極都發生插層反應,通過鋰離子的快速插層實現電荷的快速轉移,因此這一電池結構也被形象地稱為搖椅電池。
2019年,諾貝爾化學獎頒發給了美國籍科學家約翰·B·古迪納夫(John B. Goodenough)、英國籍科學家斯坦利·惠廷厄姆**(M. Stanley Whittingham)和日本籍科學家吉野·彰**(Akira Yoshino),以表彰他們對鋰離子電池方面的研究貢獻[4]。

諾貝爾獎獲得者:從左到右依次為美國籍科學家約翰·B·古迪納夫(John B. Goodenough)、英國籍科學家斯坦利·惠廷厄姆(M. Stanley Whittingham)和日本籍科學家吉野彰(Akira Yoshino) [4]
以碳材料為負極、鈷酸鋰為正極的鋰離子電池的出現推動了鋰離子電池的發展。隨着科研人員對鋰離子電池的研究逐漸深入,鋰離子電池的正極材料發展出了三種體系:**鈷酸鋰(LCO),磷酸鐵鋰(LFP)以及三元鎳鈷錳(NMC/NCM)**體系。其中,鈷酸鋰體系擁有相對更高的電池容量,在我們平常使用的手機、電腦等3C電子產品領域有着舉足輕重的地位。磷酸鐵鋰體系和三元鋰體系擁有更高的穩定性,因此在新能源汽車中擁有較為廣泛的應用。[14]
鋰離子電池的出現徹底改變了我們的生活方式。與鎳鎘電池和鎳氫電池相比,鋰離子電池的能量密度更高,相同電池容量的鋰離子電池更為便攜,能夠支撐集成豐富功能的智能手機的高功耗。同時,大部分的鋰離子電池沒有記憶效應,不需要完全放電後再充電,因此鋰離子電池能夠實現隨需隨充。與鋰電池相比,鋰離子電池的充電速率顯著提升。並且鋰離子電池的充電速率快,極大地方便了我們的生活。因此,在手機、移動電腦、新能源汽車等應用場景中,鋰離子電池憑藉其優異的性能逐步代替了部分場景中的鎳鎘電池和鎳氫電池。
04
為什麼手機電池壽命越用越短?
鎳鎘電池的傷痛——記憶效應
對於鎳鉻電池而言,燒結制備的鎳鉻電池的負極鎘的晶粒較粗,當鎳鉻電池長期不徹底充電、放電,鎘晶粒容易發生聚集,集合成塊。此時,電池放電時形成次級放電平台。電池會以這一次級放電平台作為電池放電的終點,電池的容量變低,並且在以後的放電進程中電池將只記住這一低容量[15]。這也是為什麼舊一代採用鎳鉻電池的手機經常被建議需要完全放電後再進行充電的原因。但是隨着鎳鉻電池與鎳氫電池加工工藝的不斷提升,記憶效應對電池容量的影響被不斷降低,完全充放電對電池壽命的危害逐漸顯現出來。

鎳鉻電池具有明顯的記憶效應,而鋰離子電池幾乎沒有記憶效應。並且由於鋰離子電池的能量密度高於鎳鉻電池,因此在我們的手機、電腦等一種產品中主要還是採用鋰離子電池。所以,我們日常使用裝載鋰離子電池的智能手機或電腦的時候,不需要擔心電池的記憶效應。
鋰離子電池過度充放電導致壽命衰減
鈷酸鋰擁有較高的理論電容量,但是我們在使用過程中鈷酸鋰的實際容量遠達不到理論容量。因為我們在對鋰離子電池進行超過了這個容量後的充放電後,鈷酸鋰就會發生不可逆充放電過程,也就是我們常説的電池過充電或過放電。這個過程中伴隨了鈷酸鋰的結構相變,使電池的容量降低。
鈷酸鋰六方向單斜相轉變的示意圖[16]
當電池發生過充電時,鋰離子電池負極鈷酸鋰脱出大量鋰離子,剩下的鋰離子不足以支撐起鈷酸鋰原本的結構,導致Li1-xCoO₂晶體由六方晶系向單斜晶系轉變,原本的六方結構缺少離子支撐而崩塌。在這個過程中,鈷酸鋰相變並非完全可逆,鈷酸鋰的晶胞參數發生變化、應力變化、鋰離子空位被壓縮導致鋰離子電池容量衰減。[17][18]
高電壓鋰離子電池的不穩定性
除了鈷酸鋰發生結構相變導致電池容量的不可逆變化,鋰離子電池輸出電壓的提高也導致了鋰離子電池中易發生其他副反應,鋰離子電池壽命衰減。目前,市場上的智能手機通常採用的是4.4V左右的充放電電壓[14]。高電壓能夠提高鋰離子電池的容量,加快鋰離子電池的充放電速率。但是隨之而來的就是鋰離子電池電極表面的副反應的增大,電解液在高電壓下的不穩定等一系列副作用。
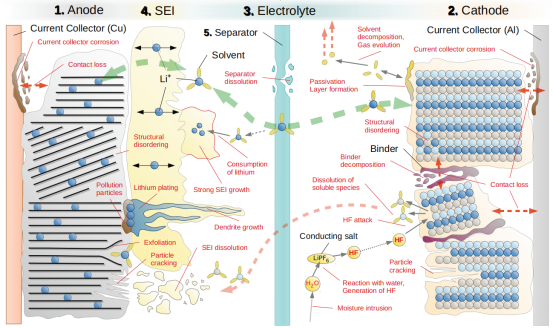
高電壓鋰離子電池的壽命衰減的影響機制[18]
鋰離子電池電解液在與正負極的固液相界面上發生反應,形成一層覆蓋於電極表面的鈍化層。這種鈍化層具有固體電解質的特徵,Li離子可以經過該鈍化層自由地嵌入和脱出,因此這層鈍化膜被稱為“固體電解質界面膜”( solid electrolyte interface),簡稱SEI膜[19]。形成SEI膜的過程會消耗部分鋰離子,使鋰離子電池容量發生不可逆損耗。在高電壓的作用下,這類電極表面的副反應嚴重,使電池容量逐漸下降。
05
使用手機時需要注意什麼
高温不充電
在平時遇到手機過熱或者温度極低的情況下,不要對手機充電。當手機過熱時,在高温條件下給鋰離子電池充電,也會使鋰離子電池的正負極結構改變,從而導致電池容量不可逆的衰減。因此,儘量避免在過冷或過熱條件下給手機充電,也能夠有效延長其使用壽命。
及時更換電池
在我們使用手機、筆記本電腦或是平板電腦等數碼產品的過程中,發現電池後蓋發生變形、電池出現鼓包等異常情況時,要及時停止使用並向生產廠商更換電池,儘可能避免因電池使用不當留下的安全隱患。
參考文獻
[1] 馬丁·庫帕_百度百科
https://baike.baidu.com/item/%E9%A9%AC%E4%B8%81%C2%B7%E5%BA%93%E5%B8%95/3066905?fr=ge_ala
[2] 鋰電池的發展歷史 知乎 https://zhuanlan.zhihu.com/p/146768161
[3] 鎳氫(MH-Ni)電池-知乎 https://zhuanlan.zhihu.com/p/630028868
[4] The Nobel Prize in Chemistry 2019. NobelPrize.org. Nobel Prize Outreach AB 2023. Sun. 13 Aug 2023.