全球第2例豬心移植完成,國內走到哪一步了?_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。09-26 21:13
專家推測,還需要約3到5年,能看到人類進入異種移植的新時代。萬里長征的第一步已經邁出,後面還有很長的路要走。
**撰文 |**凌駿
9月20日週三,經歷了一場萬眾矚目的手術後,58歲的勞倫斯·福賽特獲得了一顆全新的動物心臟。
勞倫斯·福賽特是全球第二例接受轉基因豬心移植的患者。22日,美國馬里蘭大學醫學中心(UMMC)宣佈,他已可以自主呼吸,機體功能良好,新心臟無需任何幫助即可工作。
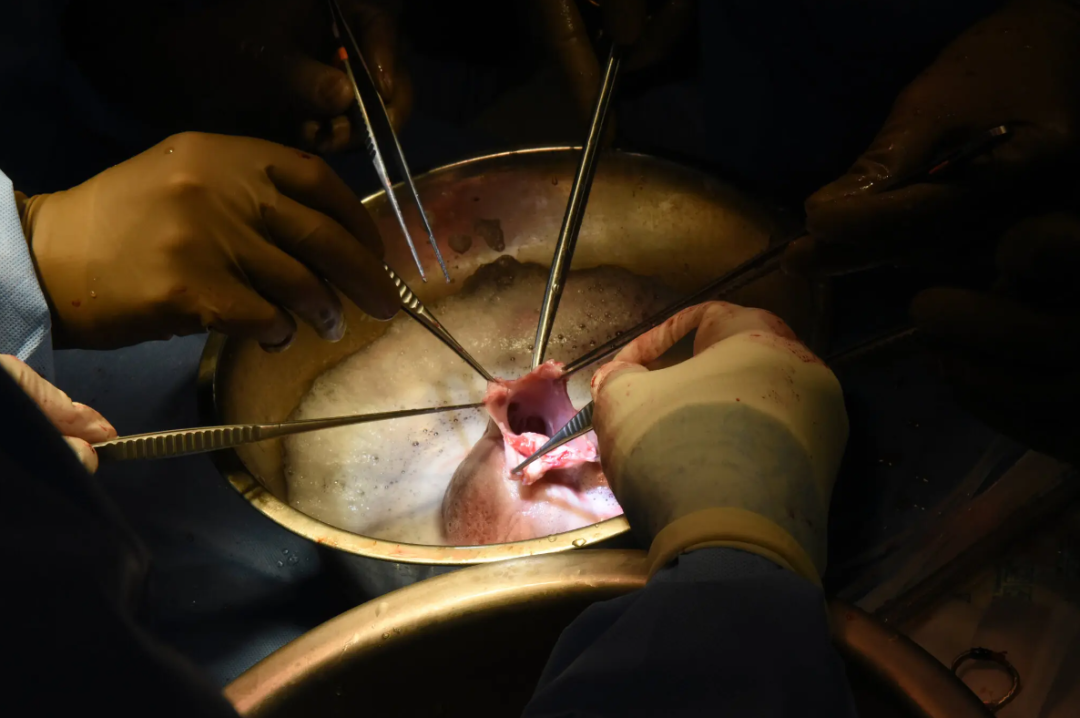
外科醫生在勞倫斯·福塞特的移植手術中檢查豬心臟(圖源:美聯社)
一年半前,UMMC曾完成了全球首例轉基因豬心移植,當時患者術後存活了兩個月。根據今年6月29日發佈於《柳葉刀》的報告,推測可能的死亡原因包括抗體介導的排斥反應、供體豬心臟存在潛在病毒等。
UMMC的手術團隊改進了本次移植方案。
勞倫斯·福賽特也沒有任何選擇,他患有終末期心臟病,基礎身體情況不符合任何常規心臟移植計劃的要求。“我唯一生存的希望就是採用豬心臟移植。”他在術前接受採訪時稱。異種器官移植至今還未獲批臨牀試驗,手術的開展是基於美國FDA的“同情使用”, 旨在授權身患重疾的生命垂危患者獲得可能有效的潛在治療方式。
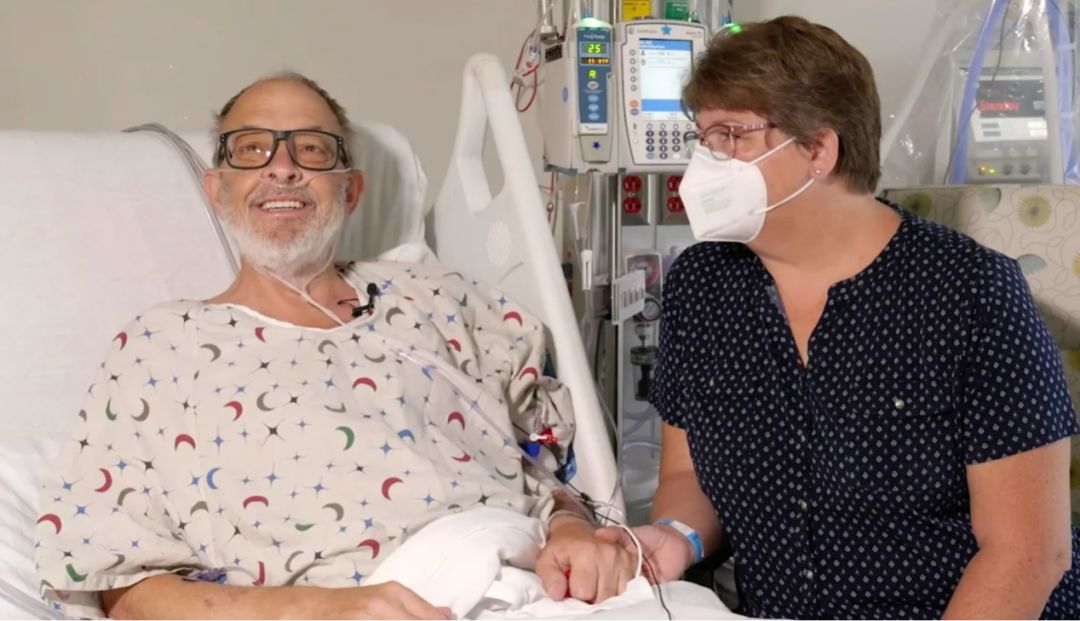
手術前患者和他的妻子(圖源:馬里蘭大學醫學中心)
9月14日,勞倫斯·福賽特因心力衰竭住進了醫院。此時供體轉基因豬心已準備就緒,這是於2020年獲批的全球首個基因修飾豬產品,相關公司Revivicor曾因創造出全球第一隻克隆羊“多莉”而聲名大噪。
為了讓移植順利進行,供體豬需要經過基因編輯的改造,包括敲除3個會引起人體免疫排斥的基因,加入 6個允許人體免疫系統接受豬心的基因。還有1個負責豬心生長的基因也被敲除,這是為了防止豬心在人體內繼續長大,超過人承受範圍。
同時,團隊還引入新型的實驗性抗體療法,結合傳統抗排斥藥物聯用,以進一步避免潛在的免疫排斥風險。9月20日,手術在馬里蘭大學醫學院進行,主刀醫生團隊有着30餘年異種器官移植的研究經驗,手術歷經8個小時,他們摘除勞倫斯·福賽特已經衰竭的心臟,放入豬心,縫合血管。
手術非常成功,沒有出現任何併發症。術後兩天,勞倫斯·福賽特已經可以脱離輔助呼吸設備的支持,坐着與他人自如地交流。
為什麼是豬?
“越來越多異種器官移植案例的出現,證明了學界在突破異種移植的超急性排斥和加速性排斥反應上,取得了比較大的成功。”復旦大學上海醫學院副院長、上海市器官移植重點實驗室主任朱同玉對“醫學界”表示。
2003年,Revivicor公司創造性地在克隆豬身上進行基因修飾,培育出第一代轉基因豬,試圖克服移植時豬器官與人的“生物障礙”,這被美國《發現》雜誌列為當年百項重大科學發現之一,成為了全球範圍內公認的供體基礎。
為什麼是豬?最早,學界嘗試過使用更接近人類的物種。1984年、1992年,醫生們分別用狒狒的心臟、肝臟進行過人體移植。但術後數週內,患者便死於排斥反應。
後來的研究發現,豬和人在食性、代謝水平等方面接近,體温、心率,一些器官的“性能參數”也和人類相近。更重要的是,猩猩、狒狒等人類“近親”體內存在一些病毒,如猴免疫缺陷病毒等,易傳染給人類,豬器官則相對不易發生。
但不容易不代表不會,由於豬內源性反轉錄病毒(PERV),豬鉅細胞病毒等病毒的存在,移植依舊存在感染病毒的風險。2015年,美國哈佛大學研究團隊曾通過基因編輯技術,敲除豬種羣基因組的PERV,進一步排除豬器官移植的感染隱患。
為解決跨物種疾病傳播問題,必須對供體豬進行淨化病原微生物。四川省人民醫院器官移植研究所副所長、基因工程豬專家潘登科告訴“醫學界”,新生豬通過剖腹產,一出生就被送入超潔淨豬舍斷奶接受人工飼養。“豬鉅細胞病毒可以通過養殖環境控制無菌,以及靈敏的檢測手段實現豬源器官的生物安全。”
“免疫排斥和生物安全,是異種器官移植面臨的兩大障礙。”潘登科説。
本次手術前,UMMC團隊事先對供體進行了多種豬病毒、細菌和寄生蟲的常規篩查,團隊負責人表示,他們採用了一種新研發的檢測手段排查豬鉅細胞病毒,這種病毒被認為可能導致了去年全球首例豬心移植患者的死亡。
據報道,本次手術最初的檢測並沒有發現病毒存在的跡象,包括後期是否還會出現慢性排斥反應,勞倫斯·福賽將持續接受密切的檢測。“看到豬心臟在人身上發揮作用是一種奇妙的感覺,”移植團隊負責人,異種器官移植專家莫希丁博士接受媒體採訪時表示,但未來的情況還無法預測。
首例豬心移植患者死亡後
勞倫斯·福賽特暫時獲得了新生,但接下去的幾周至關重要,他的生存期成為全球器官移植界關注的焦點。
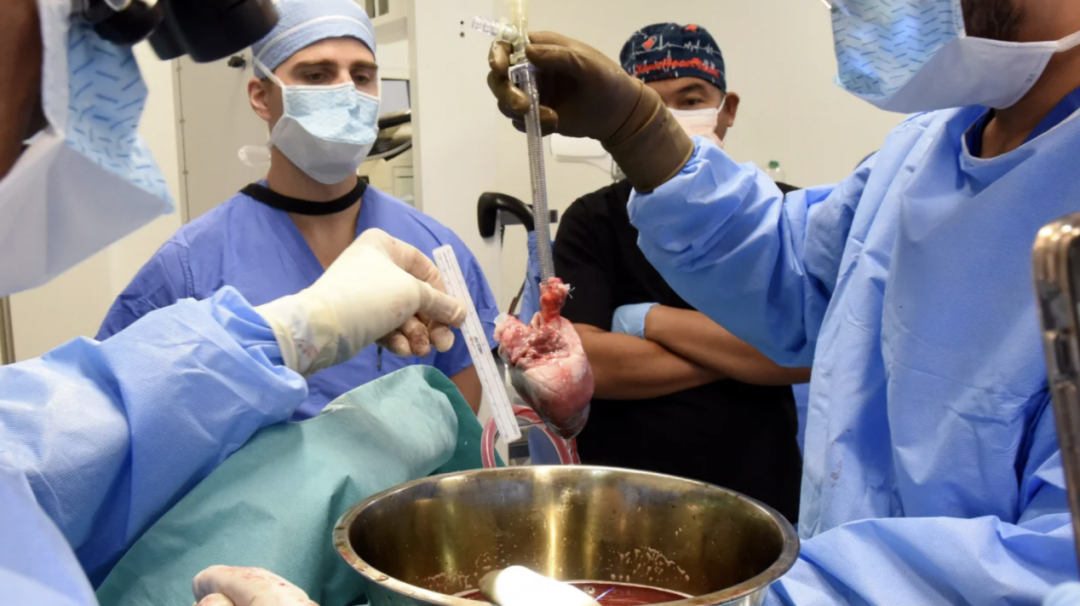
2023年9月,醫生準備好供體豬心,將移植到患者身上。(圖源:馬里蘭大學醫學中心)
去年開始,全球幾家異種移植研究機構都有意將“豬器官到人”推向臨牀試驗,以最終緩解移植器官長期稀缺的困境。“一個共識是,至少要有60%的患者術後存活期超過半年,才能推動異種器官移植正式進入臨牀試驗階段。”朱同玉告訴“醫學界”。
2022年1月7日,UMMC首次對一名57歲的終末期患者進行豬心移植,術後第5天便實現撤除ECMO,患者總體情況穩定,沒有發生超急性免疫反應。但兩個月後, UMMC突然宣佈患者死亡。初步的屍檢結果發現,患者死亡與典型的異種移植排斥並不相符。
經過了約1年調查,今年6月29日,團隊在《柳葉刀》發佈詳細的報告,推測由幾個因素疊加導致了患者心力衰竭,包括他在移植前的健康狀況不佳,免疫系統嚴重受損。這限制了移植後抗排斥治療的強度,因此患者的器官可能更容易受到免疫系統的攻擊。
使用的免疫球蛋白(IVIG)也可能導致心肌細胞受損。在移植後的第二個月,患者曾接受了兩次IVIG注射,用於預防病毒感染——但抗體同樣可能攻擊已植入的豬心臟。
此外,屍檢發現豬鉅細胞病毒檢測呈陽性。團隊認為,該病毒可能最早處於“潛伏”狀態,在患者減少抗病毒治療方案後被重新激活,引發了導致細胞損傷的炎症反應。不過,沒有確定證據表明該病毒感染了患者,或擴散到心臟以外的器官。
“患者去世時,移植的心臟擴大了一倍。雖然還不能證明死亡是由傳統的排斥反應導致,但相關的症狀也提示,可能有一些免疫排斥的類型還並沒有被醫學界所熟知,這對異種移植來説仍是重大挑戰。”朱同玉分析,內源性病毒感染也依舊是需要解決的問題。
“檢測常見的病毒沒問題,但豬體內的病毒還有很多種,有些病毒是否會在後期被激活,目前還不清楚。前期豬的培育、基因編輯,手術前的病毒檢測篩查等,有很成熟的技術手段,但對內源性病毒是否在人體內的不同環境中被激活,還有很多未知需要研究。”朱同玉説。
在第二例移植開始之前,UMMC的研究團隊向FDA專家團提供了超300頁的審查資料,包括在非人類靈長類動物中持續研究的數據,他們表示已從首例患者身上汲取了足夠的經驗,再試一次是有意義的。
團隊負責人在一篇綜述中寫道,自2005年以來,我們一直在動物中測試基因工程豬心,並優化抗排斥方案。在動物試驗中,3例移植案例的豬心存活時長共達到945天。首例人體試驗患者生存了60天,證明了臨牀前研究從實驗室到臨牀的轉化。最終死亡原因是一個研究課題,FDA專家團隊審查了我們的研究經驗和數據,允許我們繼續前行。
走向臨牀試驗,還有多遠?
“雖然首例患者在術後兩個月死亡,但它是異種器官移植史上的一次突破。”潘登科對“醫學界”表示,“1967年人類歷史首次心臟移植,患者僅存活了18天。”
據世界衞生組織統計,全球每年有約200萬人需要器官移植,但平均器官供需比為1∶20至1∶30。科學家試圖通過多種途徑解決移植器官的短缺問題,而異種器官移植就是其中最前沿並具有應用前景的方式之一。
除了UMMC團隊,本月14日,美國紐約大學朗格健康中心(NYU Lounge)宣佈基因編輯的豬腎人體移植觀察期結束。在一位腦死亡患者的移植試驗中,轉基因豬腎保持了61天的良好運轉,創下全球異種器官移植新紀錄。
這也是NYU Lounge中心完成的第5例腦死亡患者異種器官移植,包括3例豬腎移植和2例豬心移植。根據美聯社日前報道,美國食品和藥物管理局(FDA)正在考慮,或將授權醫療機構在非生命終末期患者中,展開小規模且嚴格的跨物種器官移植研究。
豬腎和豬心移植各有迫切性。朱同玉表示,一方面,心臟的結構和運作方式更接近於“機械”,因此人工心臟目前發展相對較快,彌補了很大一部分稀缺的器官供給,而人工腎臟的發展則滯後。“但從另外一個角度,雖然造成生活不便,但腎衰竭等患者仍能通過透析手段維持生命。心臟停止了功能,長期替代方式沒有腎臟透析那麼成熟。”
由於捐贈心臟的稀缺,全球每年僅有約5500例心臟移植手術。異種器官移植迅速發展提供了可能的解決方式,但朱同玉認為仍需理性看待。
“供體豬經過基因編輯,但它和人的基因組差異畢竟不在一個數量級上,仍有可能存在排斥。過多的基因編輯也會使得豬本身難以存活。”朱同玉説,“最終到底需要編輯豬的多少基因?編輯哪些基因?內源性病毒方面,如何進一步建立完善的人畜共患病和免疫學評價體系?都還要進一步的臨牀研究。”
潘登科則表示,雖然不同物種之間差異巨大,“通過基因改造,可以讓豬更接近人,克服異種間的主要排斥反應,另外,隨着近年新型免疫抑制劑的出現,異種移植免疫基礎研究的最新成果,異種移植的免疫治療方案越來越完善。”
據介紹,潘登科團隊培育的基因編輯豬已在全國各地參與了幾十起動物試驗,2022年10月,團隊與西京醫院竇科峯院士團隊等合作開展的國際首例“六基因編輯豬-猴多器官、多組織同期聯合移植”成功實施。
“異種器官移植的臨牀轉化研究是一個系統工程,堪比‘登月計劃’,需要器官移植、基因工程、畜牧學、免疫學、倫理等各方面專家配合完成,建立我國異種器官移植的技術平台和監管體系。”潘登科説,“美國已有的案例為我們提供了很好的借鑑。”
2022年6月,《新英格蘭醫學雜誌》在首例豬心移植病例報告的評論文章中寫道,無論這次異種移植是否開啓了新未來,研究都提供了一種新的觀察——研究人員利用基因生物工程和細胞發育生物學,迅速而深刻地解決醫學問題。
朱同玉認為,在進入人體前,醫學試驗不可能做到萬事具備,答案還得在真實世界研究中尋找。從近年來醫學科研領域的相關進展看出,一旦通過倫理學等嚴格審批程序,人類已經具備了探索的條件。
“推測還需要約3到5年,能看到人類進入異種移植的新時代。”朱同玉説。萬里長征的第一步已經邁出,後面還有很長的路要走。
參考文獻:
1: Genetically Modified Pig’s Heart Is Transplanted Into a Second Patient,https://www.nytimes.com/2023/09/22/health/pig-heart-transplant-faucette.html
2: Navy veteran in Maryland is second patient to undergo pig heart transplant,https://www.wbaltv.com/article/pig-heart-transplant-lawrence-faucette-maryland/45268548#
3: 首例患者死亡 1 年半後,全球第 2 例豬心移植剛剛完成,https://mp.weixin.qq.com/s/O8yKtht8DgrU_cfLMpLuEg
4: 關注中國異種移植丨豬器官“變”人器官,真的只有一步之遙?https://baijiahao.baidu.com/s?id=1758222928612318055&wfr=spider&for=pc