人造子宮養大了羊胎,你支持將它用到人類身上嗎?_風聞
酷玩实验室-酷玩实验室官方账号-10-07 07:51
2017年4月,《自然》雜誌發表了一篇名為《支撐極端早產羔羊生長的外部子宮系統》的論文。
論文的作者——美國費城兒童醫院的研究人員,將8只在母體內孕育了107天的羊胎人工取出後,又利用研發的人造子宮,將其繼續培育了四周。
實驗很成功,因為被泡在培養液中的羊胎肉眼可見的長大了。
它們長出了羊毛,肺部和大腦也逐漸成熟。

該研究也成了人類目前為止,在人造子宮領域最為顯著的成果。
而這一切,和其他所有的生物醫學實驗一樣:
以動物開頭,但最終是為了能夠移植應用到人類身上。
或者再準確一點,是為了用到早產兒身上。
時隔6年多後的今年9月14日,《自然》雜誌又刊發了一篇承接上述研究的文章。
題目名為《人造子宮的人體試驗可能很快就會開始》。
因為幾天後,美國食品藥品監督管理局FDA就將針對該議題進行討論:
決定是否進行臨牀實驗。
01
早產是個大問題
世界衞生組織將早產定義為妊娠37周之前的生產。
足月生產則需要約40周。
如今,早產已成了威脅新生兒,及五歲以下兒童健康甚至生命的最大問題。
根據《美國醫學會雜誌》2022年的一項覆蓋約11000名嬰兒的研究,
孕28周的早產兒存活率為94%,孕24周的早產兒約有一半能存活,而孕22周的存活率僅有6 %。
此外,即便這些嬰兒活了下來,由於呼吸受損、餵養困難、體温調節不良和感染風險高,也極有可能患上其他併發症。
例如一項針對瑞典250萬人的研究表明,妊娠28周前出生的人中,
78% 在成年時患有某種疾病,包括但不限於哮喘、高血壓、腦癱和癲癇!
妊娠22周出生的人中,33% 患有嚴重殘疾。
僅在2019年,與早產相關的併發症就導致了約90萬人死亡。
可即便如此,直到今天,針對女性早產的原因以及如何預防的研究還不夠。
總體來説,它可能是自然發生的,也可能是因為某些情況,
例如感染、激素失衡、高血壓或糖尿病等問題,使子宮環境不再適合胎兒生存,被迫進行早產。
但無論出於何種原因,早產已成為人類一個必須正視、儘快解決的問題。
2020年,全球約有1340萬例早產事件。
根據美國疾病控制與預防中心(CDC)的研究,美國的早產率在2020年至2021年間上升了4%。
同時,中國的早產兒約佔新生兒數量的7—10%。
能避免早產當然是最好的,但假如真的不幸遇到了呢?人們當然還是希望能得到有效的醫療救助。
挽救嬰兒,同時也是“拯救”懷胎數月的母親,以及整個心力交瘁的家庭。
02
新生兒重症監護室的侷限
1960年,美國耶魯紐黑文醫院開設了世界上第一家新生兒重症監護室(NICU),專門護理患病或早產新生兒。
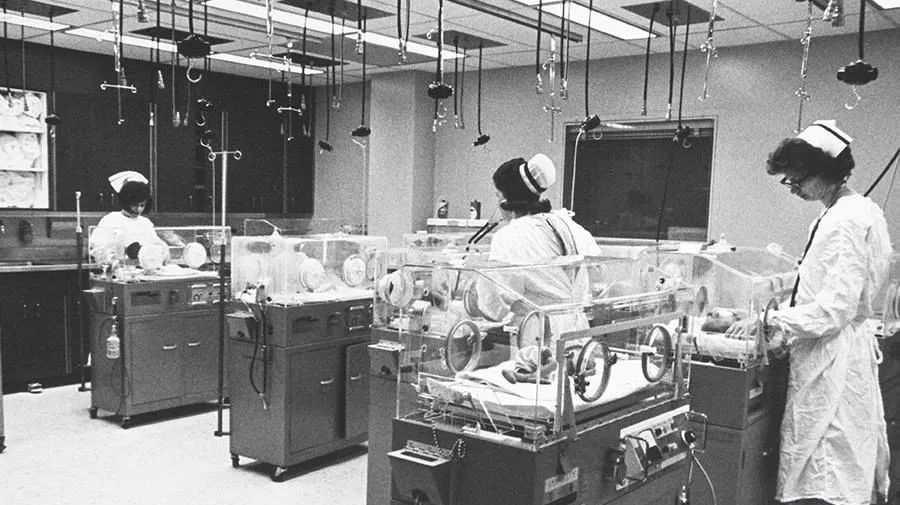
進入NICU的早產兒會被放置在一個塑料保温箱內,其中配有氣候控制設備並能隔離外部細菌。
在監護期間,嬰兒的身體狀況被時刻監控,涉及體温、呼吸、心臟功能、氧合及大腦活動等指標。
與此同時,還會通過靜脈導管為嬰兒補充液體和營養,或者通過機械裝置通氣、給藥等。
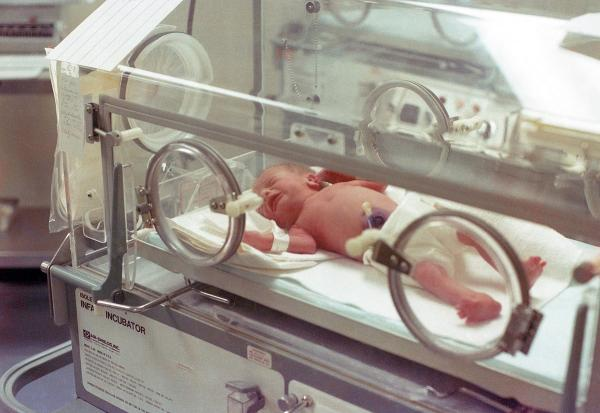
NICU大大提高了極端早產兒(孕期小於28周)的存活率。
在它出現之前,孕期不大於30周的嬰兒幾乎無法存活。如今,在不考慮後期病症的情況下,孕期28周的嬰兒有相當大的生存機會(94%)。
截止到2022 年,新生兒存活最低胎齡的世界紀錄是一名叫米恩斯(Curtis Zy-Keith Means)的男嬰。
他於2020年7月5日出生於美國。胎齡21周零1天,出生體重420克。
然而,這些顯著的成就並不意味着NICU能保障早產兒健康的萬無一失。
歸根結底,還是因為早產兒的身體並未發育成熟。
例如,由於肺部結構和功能的不完善,嬰兒自主的氣體交換會導致器官受損,並最終引發呼吸衰竭。
這種情況被稱為支氣管肺發育不良,被認為與從液體(羊水)通氣中過早過渡到氣體通氣繼發的肺部發育停滯有關。
如果不讓早產兒的肺過早啓用呢?可以是可以,但後果更嚴重!
體外膜肺氧合(ECMO)是一種用於對重症心肺功能衰竭患者提供持續的體外呼吸與循環的技術,同時也被應用在NICU中。
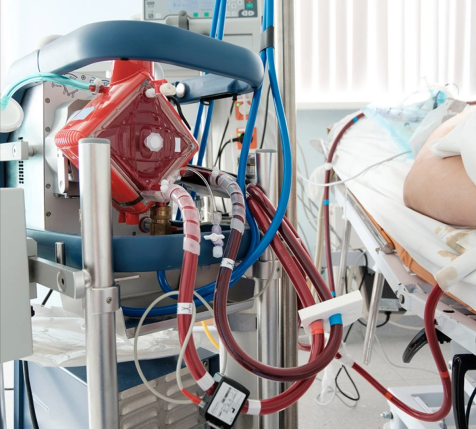
ECMO的工作原理是暫時從體內抽取血液,對紅細胞進行人工充氧並去除二氧化碳。因此,它能為無法進行肺部氣體交換的嬰兒提供生命支持。
但是,它適用的對象是足月出生的嬰兒。
如果對胎齡小於32周的嬰兒使用ECMO,由於他們的腦血管系統和生髮基質發育不良,腦出血的風險極高!
除了以上問題外,早產還可能使嬰兒的的不同器官系統受損。
例如缺氧缺血性腦病、早產兒視網膜病、動脈導管未能閉合引起的心血管併發症。
此外,胃腸道和代謝問題可能導致佝僂病、低鈣血癥,以及壞死性小腸結腸炎等。而貧血、血小板減少症、黃疸,以及敗血症等血液併發症更是會接踵而來。

總之,麻煩大了!
因此,只有創造出一種能支撐早產兒繼續生長發育的環境,才是解決問題的根本。
而這,便是人們研究人造子宮的源頭。
人造子宮的目的是模擬子宮環境,讓早產嬰兒在其中繼續發育,從而度過危險期。
早在1954 年,美國人伊曼紐爾(Emanuel M. Greenberg)就申請了世界上首個人造子宮的專利——沒有實物,只有張設計圖。
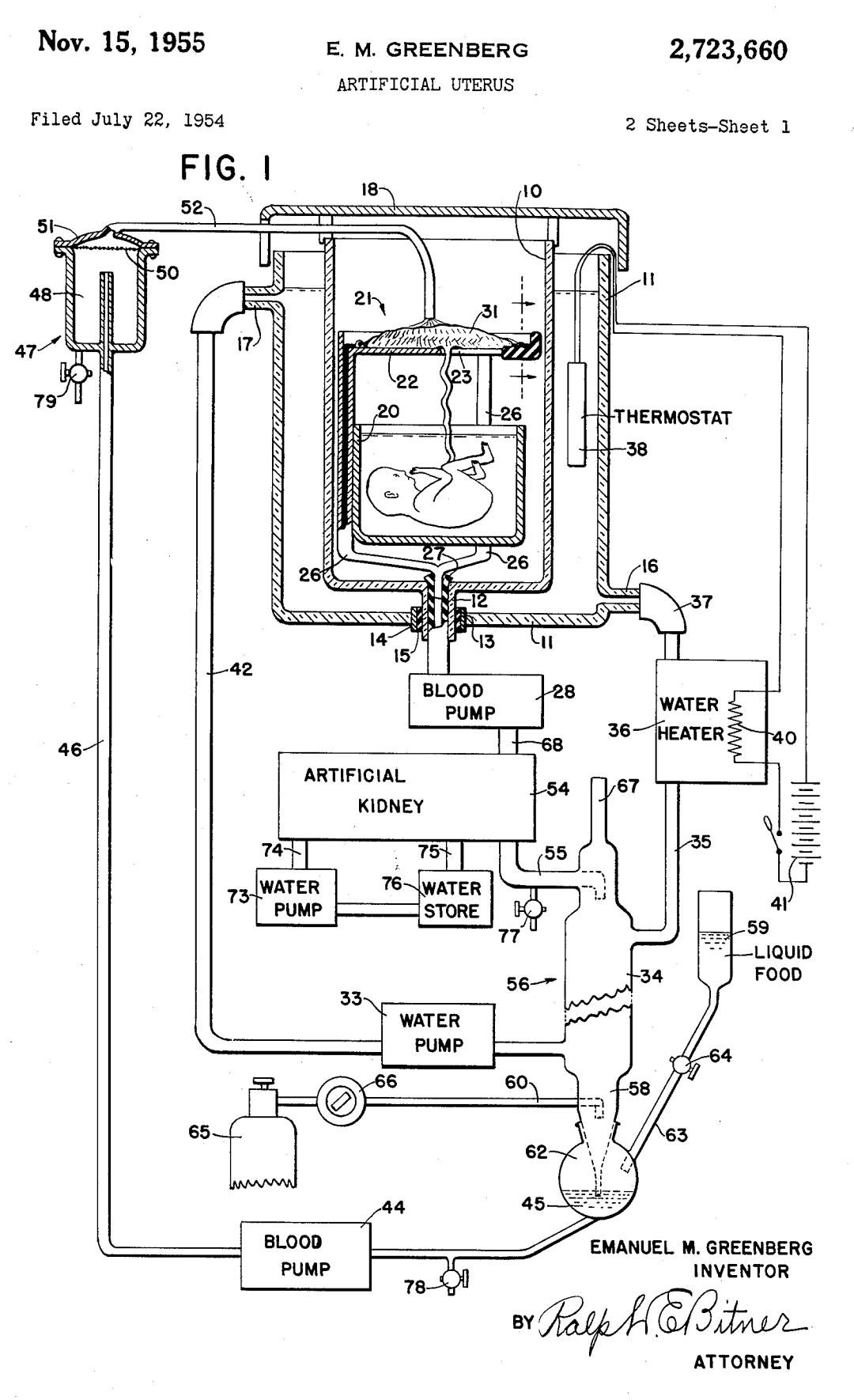
其中包括一個用於放置充滿羊水的胎兒的水箱、一台連接臍帶的機器、血泵、人工腎和熱水器。
1955年11月,該專利通過了審查,代號為US 2723660。
你是否會以為這開啓了一項生物醫學技術的新紀元?
遺憾的是,並沒有。
雖然一直有少數學者在研究體外孵育(動物)胚胎的技術,但直到30多年後的1987年,東京大學醫學院的研究人員才開發出了一種基於ECMO的子宮外孵育羊胎系統——也就是真正意義上的首個人造子宮。
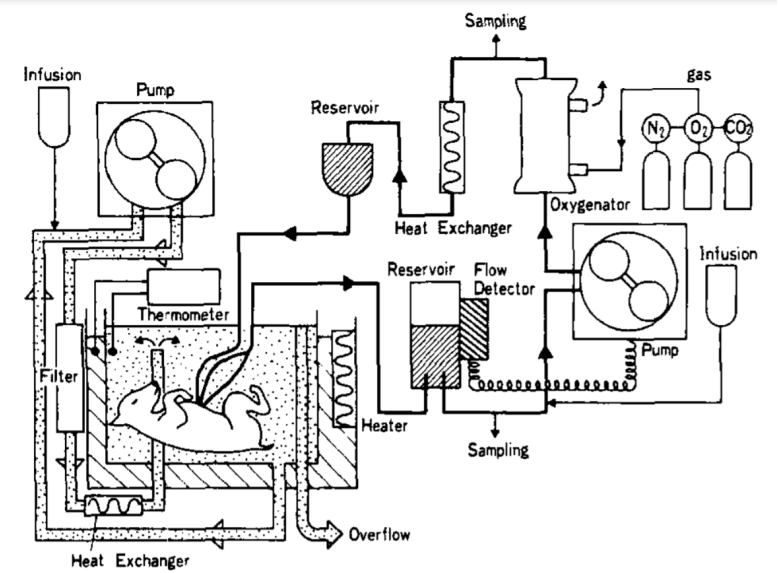
實驗對象是14個山羊幼胎,它們被浸入在人造羊水裏,血液由聚乙烯導管從臍動脈中導出,經過ECMO 注氧後再泵回臍靜脈。
同時,它們的心率,血壓,腦電圖等參數也被時刻監測着。
實驗結果是,這14只羊胎中,最“長壽”的一隻活了165小時(胎齡119天),最短命的只活了30分鐘(胎齡136天)。
造成它們死亡的最大原因是心理衰竭。
根源則在於ECMO對心臟功能的干擾。除此之外,還有腹膜內出血、缺氧等其他致命問題。
在此之後,時間匆匆又劃過三十年,科學家在人造子宮領域的研究卻依舊進展甚微。
直到2017年,美國費城兒童醫院的研究橫空出世。

03
孵育羊胎的人造子宮
與過往研究最大的不同在於,費城兒童醫院的方案採用了無泵動靜脈迴路(血流完全由胎兒心臟驅動)和極低阻力的氧合器取代了ECMO。
這避免了ECMO的泵機對胎兒心臟施加的不平衡的壓力所導致的循環衰竭。
同時,最大限度地模擬了羊胎體內的自然循環,實現了血流的穩定和氣體的高效交換。
該研究中的人造子宮系統有三個技術核心,除了上述的無泵動靜脈迴路外,
還包括能連續交換液體(類似於羊水的生理週轉)的封閉環境——Biobag,以及新的臍帶血管通路技術。
Biobag是一種由透明的聚乙烯薄膜組成的、一次性的封閉系統,可以定製出真實子宮的尺寸和形狀。
它避免了開放式液體培養箱所導致的污染和胎兒敗血症。
而且,即使由於開袋而引入少量污染源,也可以通過提高液體交換率,及注入抗生素來清除。
更為重要的是,未成熟的肺處在類似於天然子宮的環境中:
充滿液體(胎兒與外界之間的第一層保護屏障)、正常的氣道壓力,以及肺部生長發育所需的正常聲門阻力。
在臍帶技術方面,為了更接近子宮內的血流動力學,研究人員放棄了頸動脈插管,轉而採用了雙臍動脈和單臍靜脈插管。
同時,他們開發了一種臍帶血管插管技術,
可在插管尖端和腹壁之間保持一定長度的原生臍帶(5-10釐米),最大程度地減少拔管操作和機械阻塞的風險。
然後,結合局部罌粟鹼給藥、無創傷手術技術,以及在迴路流動開始時維持臍靜脈的温度和生理氧飽和度,可以減輕臍帶痙攣的出現。
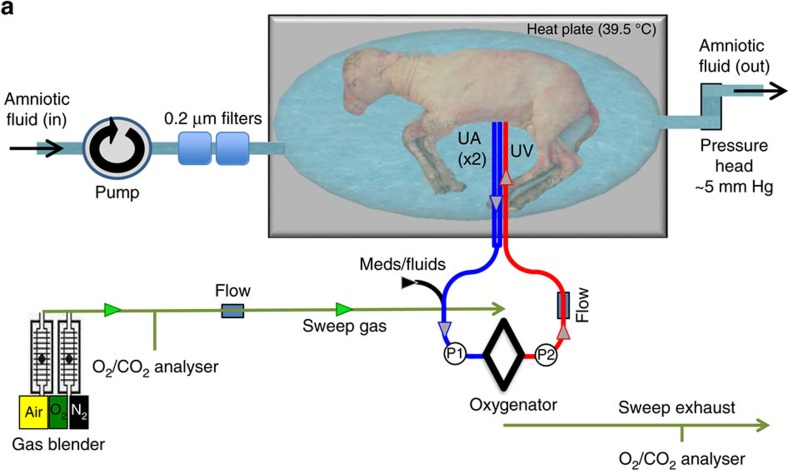
該研究的實驗對象是五隻胎齡110天左右(極端早產)的羔羊,從肺部發育的角度來看,其生物等效性相當於妊娠 22-24 周的人類早產嬰兒。
Biobag中的液體是主要由碳水化合物和氨基酸組成的電解質溶液,並含有微量脂質。
雖然無法完全與含有許多營養因子和其他可能對胎兒有益成分(例如抗體、激素)的天然羊水相比,但也正常發揮了作用。
最終,這些羊胎穩定發育了19—28天,沒有出現明顯的生理紊亂或器官衰竭。
而且,它們睜開了眼睛,變得更加活躍,呼吸和吞嚥動作明顯正常,長出了羊毛,以及——長大了。

該實驗是人造子宮領域最成功的一次嘗試,標誌着人類在解決早產問題方面邁出了一大步!
倘若它對人類有用的話,則意味着23-25周的極端早產兒能得到有效的治療。
同時還有其它潛在的應用。
例如治療與胎盤功能不全相關的胎兒生長遲緩,為患有心臟、肺和膈肌先天畸形的嬰兒進行早期矯正或治療等。
後來,這些“表現優異”的羊胎被實施了安樂死,以供人們繼續研究該系統對器官發育的影響。
該研究團隊則一鼓作氣,組建了一個名為Vitara Biomedical的初創公司。
目標是開發一個支持早產兒的治療平台。

那個成功孵育羊胎四周的人造子宮系統,被命名為EXTEND。
全稱是“為了新生兒發育的外部子宮環境(EXTra-uterine Environment for Neonatal Development)”。
其最終的服務對象是妊娠28周以下出生的嬰兒——倘若美國藥監局FDA能批准他們進行臨牀實驗的話。
04
依然不可臨牀
在《自然》雜誌刊發出那篇名為《人造子宮的人體試驗可能很快就會開始》的文章5天后,也就是9月19日。
FDA的兒科諮詢委員會召開了一場會議,討論如何更好地評估人造子宮技術的安全性和有效性。
不過,遺憾的是,結果並未如這些研究人員的願。
與會成員表示,根據當前的動物數據,這項技術還沒有做好人類實驗的準備。
需要在更多動物模型中進行研究,以確保該技術的安全性。
當然啦,這個結果也能被理解。
畢竟,羊和人之間還是有很大的區別的。
而且,並沒有一種完美的、接近人類的物種來替人類做實驗:靈長類的胎兒太小,豬的血液流動方式與人類不同。
如果直接將人造子宮系統應用到早產兒身上的話,誰又能承擔那些未知的風險與後果呢?
談到這裏,我突然想起1923年,英國生物學家霍爾丹(J.B.S. Haldane,提出了術語“克隆”)在劍橋大學異端協會(Heretics Society)做的一場演講。
該協會旨在成為持不同政見知識分子的避風港,為質疑傳統權威和宗教教條的思想提供空間。
會上的霍爾丹對未來提出了一種預測:
人類可以通過引導變異和體外繁殖來控制自身的進化,並首次提出了“人造子宮”這個術語。
如今看來,那已經是整整100年前的往事了……
參考文獻:
[1]An extra-uterine system to physiologically support the extreme premature lamb, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5414058/
**[2]體外胚胎髮育或將成為現實?美國FDA評估人造子宮技術,**https://news.sciencenet.cn/htmlnews/2023/9/509300.shtm
[3]Human trials of artificial wombs could start soon. Here’s what you need to know, https://www.nature.com/articles/d41586-023-02901-1
[4]Development of extrauterine fetal incubation system using extracorporeal membrane oxygenator, https://pubmed.ncbi.nlm.nih.gov/3619696/
[5]Artificial womb, https://en.wikipedia.org/wiki/Artificial_womb
[6]Artificial placenta and womb technology: Past, current, and future challenges towards clinical translation, https://pubmed.ncbi.nlm.nih.gov/32875581/