不治之症有救了!英國批准全球首個CRISPR基因編輯療法_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。昨天 20:45
Casgevy的獲批“打開了門”,但基因編輯和絕大多數療法不同,它是一針“無法反悔的藥”。
**撰文 |**凌駿 燕小六
在革命性的基因編輯工具CRISPR/Cas9被髮明11年後,英國成為了全球首個授予該技術醫療許可的國家。當地時間11月16日,英國藥監局 (MHRA)宣佈,批准CRISPR/Cas9基因編輯療法Casgevy上市,用於治療鐮狀細胞病(SCD)和輸血依賴性β地中海貧血(β地貧)。
“我非常興奮,有點不知所措。”美國生物學家、加州大學伯克利分校生物學教授詹妮弗·杜德納第一時間在博客中寫道。2012年她發明了該技術的原型,並在2020年斬獲諾貝爾化學獎。CRISPR/Cas9基因編輯讓科學家能精準地對人類DNA進行改造,一勞永逸抵禦基因性疾病。
美國食品和藥物管理局(FDA)和歐洲藥品管理局(EMA)也將在隨後跟進,美國FDA預計將在12月8日做出是否允許上市的裁決。因為涉及倫理、安全性等問題,多年來基因編輯療法一直受到嚴格的上市監管。
近年來國內也湧現出不少基因療法創新企業。在今年5月的2023年全球華人遺傳學大會上,中國科學院院士陳潤生教授對“醫學界”表示:“尤其是在遺傳性疾病的診治中,還有很多沒打開的‘窗户’,我國發展新的基因編輯系統,依然有很多原始創新的機會。”
基因編輯療法Casgevy是什麼?
Casgevy療法由美國生物科技公司CRISPR Therapeutics開發,在2019年首次展開體外試驗,提出將利用基因編輯工具,治療血紅蛋白缺陷引起的SCD和β地貧。
根據公司在11月16日的聲明,此次獲批後,或有2000名英國患者符合Casgevy用藥條件。
SCD和β地貧都屬於遺傳性血液疾病,患者體內紅細胞無法正常地攜帶氧氣。前者被視為最常見的嚴重單基因疾病之一,若缺少醫療護理和社區支持,50%-80%的SCD患兒會在5歲前夭折。後者曾被列入WHO的“危害人類健康的6種常見病”。
目前,SCD和β地貧主要依賴輸血等維持治療,部分患者可以通過造血幹細胞移植獲得根治,但配型成功率低、費用高、年齡限制是普遍問題。有數據顯示,英國SCD和β地貧患者的平均死亡年齡分別為40歲、55歲。
而基於基因編輯工具CRISPR/Cas9系統開發的Casgevy,能在體外改造、修飾患者的自體造血幹細胞,恢復能攜帶氧氣的血紅蛋白。再輸回患者體內,以實現疾病的徹底扭轉。
根據MHRA的公告,Casgevy獲批上市源於兩項臨牀研究,均達到了臨牀終點,即減少SCD患者疼痛和血管閉塞性危象,緩解β地貧患者的輸血需求。
針對SCD的臨牀研究共納入45名受試者。在完成全程療效觀察的29人中,97%(28)的人至少12個月未出現嚴重疼痛。所有人連續12個月無嚴重複發性血管閉塞危象。而在β地貧相關研究中,42名受試者提供了可評估數據。其中39人(93%)治療後的至少12個月內不用再輸血。另有3人的輸血需求下降70%。
上述研究還顯示,Casgevy的安全性良好,不良反應與自體造血幹細胞移植基本一致。主要表現為疲勞、發燒、噁心、感染風險增加等。
在今年3月召開的“第三屆人類基因組編輯國際峯會”上,首位接受Casgevy治療的SCD患者維多利亞·格雷(Victoria Gray)做主題演講。在接受治療近1年後,她沒有做過輸血治療,疼痛幾乎消失。骨髓細胞活檢顯示,超過81%的細胞產生了預期的遺傳變化。這説明基因編輯治療在其體內持續生效。

維多利亞·格雷(Victoria Gray)分享自己的經歷。/CNN
目前,藥物研發方沒有公佈Casgevy售價。2022年8月,美國食藥監局(FDA)批准基因療法Zynteglo用於治療β地貧,定價為280萬美元(約合人民幣2028萬元)。按此推算,Casgevy大概率也是“天價藥”。
基因編輯十年
“這是里程碑式的時刻,基因編輯的發展讓遺傳性罕見病、各類慢病等的治癒看到希望。”中國科學院神經科學研究所研究員楊輝告訴“醫學界”。
2012年,CRISPR/Cas9發明者詹妮弗·杜德納首次在《科學》雜誌發佈了體外基因編輯的結果。研究一開始並沒有引發關注,她認為這和文章標題“適應性細菌免疫中可編程、雙RNA引導的DNA核酸內切酶”有關。不少人不明白到底是在説什麼。
但這不妨礙CRISPR隨後成為現代生物學中最著名的發明之一。在2020年的諾貝爾獎頒獎現場,委員會評價道,“這是一項劃時代的實驗”。
CRISPR的靈感來源於細菌。上世紀80年代,科學家發現細菌體內有一段特殊的DNA片段,它最終會轉錄翻譯成一種類似“剪刀”作用的蛋白質,切掉病毒的基因防止被入侵。詹妮弗·杜德納受到了啓發,創造出了能精準切割、粘貼人類基因的CRISPR/Cas9。
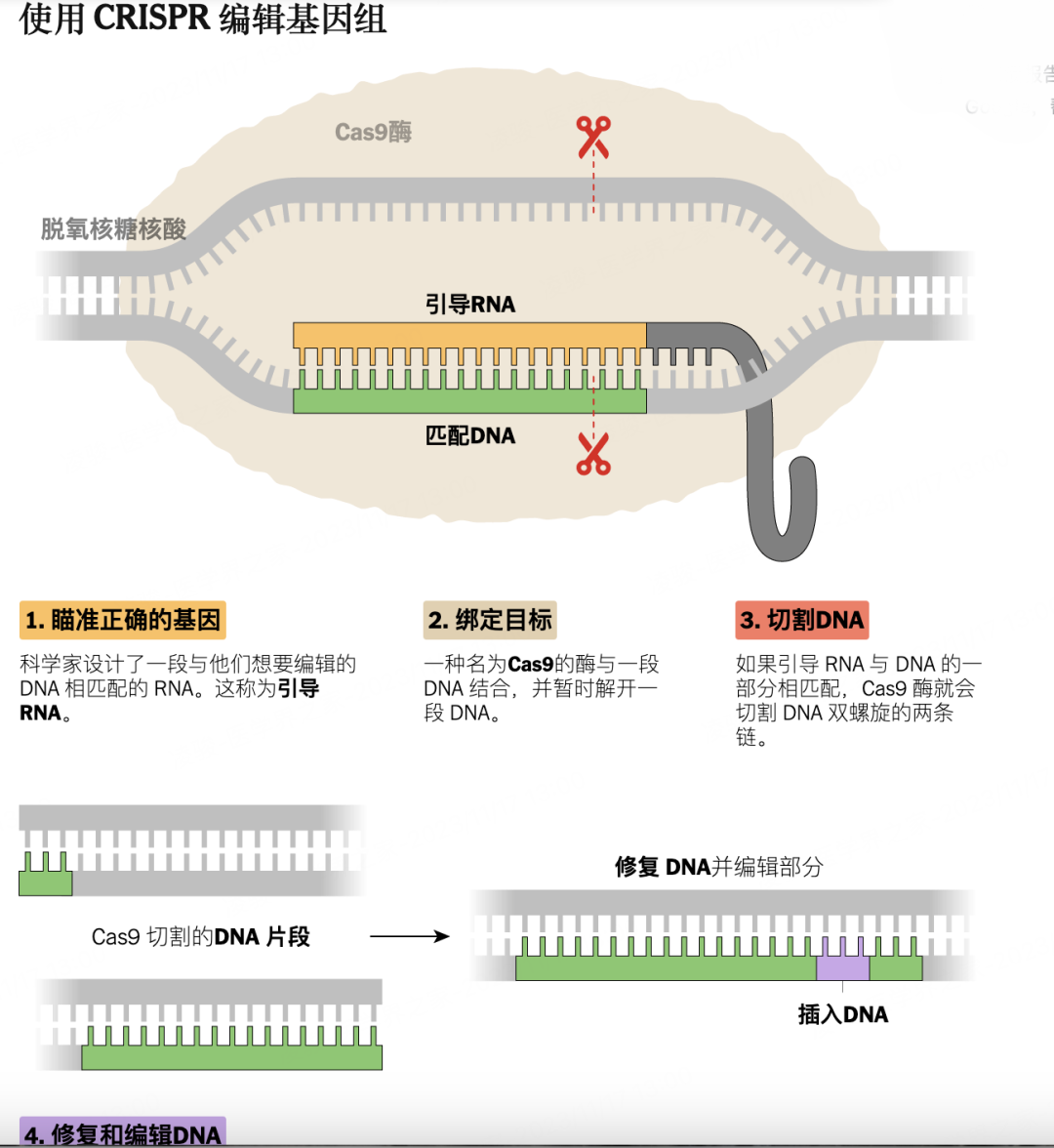
CRISPR基因編輯工作原理
短短十餘年間,這項技術迅速改變了人類研究和治療疾病的方式。癌症學家用其來精準研究腫瘤的基因靶點,慢病專家希望能一次性改變基因,避免患者終身服藥。植物學家也開始對農作物進行改造,試圖培育出更富含營養的產品。
雖然看似科幻,“它離我們並不遙遠。從新技術出現到獲批上市只用了約十年,非常迅速了。”楊輝對“醫學界”表示。而CRISPR/Cas9也只是基因編輯的其中一種工具,除了本次獲批的Casgevy,全球還有大量不同技術路線的管線在研發之中。
“根據不同的遞送載體和編輯方式,基因編輯療法覆蓋的病種也不同。”楊輝説,因新冠mRNA疫苗迅猛發展的脂質納米顆粒LNP遞送系統精確瞄準在肝臟;病毒載體AAV遞送則通向全身,楊輝團隊嘗試用它治療視網膜疾病。
CRISPR有時會產生錯誤的基因修飾,造成無法挽回的後果。華裔科學家劉如謙從2016年起相繼開發了“鹼基編輯”和“先導編輯”,被稱為CRISPR2.0版本,它能在不斷裂DNA雙鏈的情況下實現單個遺傳字母互換,因此更加精準與安全。
2022年,美國一家藥企宣佈完成鹼基編輯療法VERVE-101全球首次給藥,通過修改基因降低膽固醇”,號稱將一針永久預防心血管疾病。“鹼基編輯解決了初代CRISPR 的部分安全性問題。”正序生物首席執行官牟曉盾告訴“醫學界”,“此外慢病往往由多種因素疊加,鹼基編輯還可以進行多靶點編輯,也分擔了脱靶的風險。”
在慢病領域的嘗試,反映了科學家試圖在基因編輯前景的探索上再邁一步。畢竟相比無藥可治的罕見疾病,多數慢病已有高性價比的成熟療法,審批機構對基因編輯的療效和安全性也將提出更高要求。
“技術在不斷革新,但無法籠統地去評價它是否安全。這需要不同研究方向的科學家在實驗中不斷髮現問題,更新策略。”楊輝説。
CRISPR發展得如此迅速,也讓法規的制定和倫理共識顯得滯後,2018年的“基因編輯嬰兒事件”一度讓行業蒙上陰影。今年年初,英國的一個公民陪審團又發佈了一份報告,敦促英國政府考慮修改法律,允許科學家在疾病“最早期”,即人類胚胎時就進行基因編輯。該陪審團由受遺傳病影響的人組成,有些是死於遺傳病孩子的父母。
包括脱靶效應、效率問題、免疫排斥和片段丟失等技術難點,Casgevy的獲批“打開了門”,但基因編輯和絕大多數療法不同,它是一針“無法反悔的藥”。
“鑑於這項技術只有10年曆史,已經是非凡的進步。但使用這樣強大的技術,需要迎接對於責任的挑戰。”詹妮弗·杜德納在年初的人類基因組編輯國際峯會上表示。
國內的進展如何?
數據顯示,2016年我國基因治療市場規模僅約為0.15億元,但隨着近年來基因治療臨牀試驗的大量開展、以及相關利好產業政策的支持等,2021年已快速上升至2.7億元左右,2027年預計將達到約500億元。
陳潤生院士對“醫學界”表示,基因編輯是一個系統,其中的CRISPR/Cas9發展最早,可能最為成熟,“我國的基礎研究也一直在不斷探索,從基因編輯總體系統的設計,到具體工作的蛋白,包括應用到不同病種,都有原始創新的機會。”
“之前是專利權被國外壟斷,包括遞送平台等技術都存在限制。現在這些問題差不多打破了。”楊輝介紹,由於專利保護,在Cas9以及Cas9依賴的基因編輯工具上,國內企業已沒有太多空間。而將方向瞄準在Cas13系統,2022年1月,楊輝所在的輝大基因團隊開發的Cas13X和Cas13Y工具,獲得美國專利局授權。
另一本土基因編輯療法初創公司正序生物,孵化自上海科技大學,其科學創始人團隊開發了變形式鹼基編輯系統tBE,這也是首個獲海外專利授權的本土自研鹼基編輯工具。據瞭解,正序生物據此開發的針對β-地中海貧血症創新鹼基編輯療法,在10餘位健康者和患者捐獻的造血幹細胞中完成有效性和安全性的觀察,在動物模型中有超過6個月的安全性驗證和療效觀察。
據不完全統計,截至2021年國內至少有10家企業開發了基因編輯系統。“本土企業的機會在於,除了像Cas9這類早期技術手段,在‘新型工具’上和海外幾乎處於同一起跑線,應該把勢頭保持下去。當然一些細節的技術難點,涉及多學科,還需要更底層的基礎研究和創新技術去解決,有差距但並沒想象得那麼大,有些細分領域國內甚至領先。”牟曉盾説。
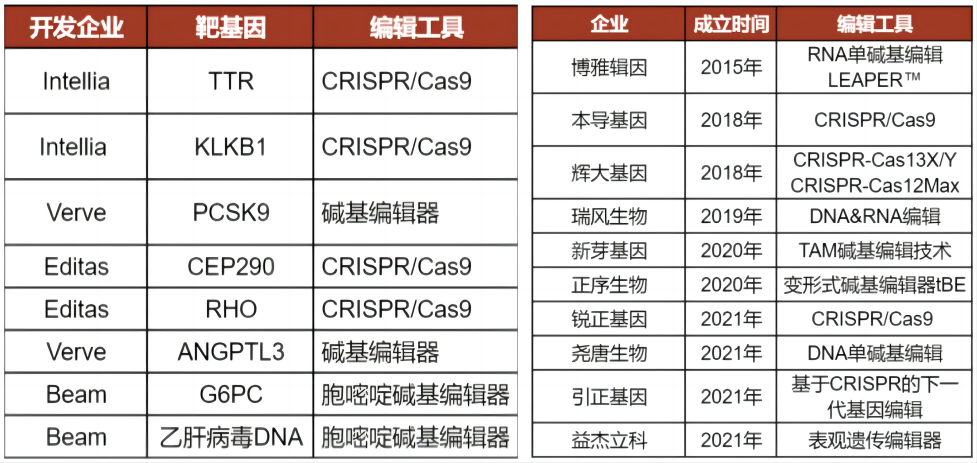
國外(左)、國內(右)的基因編輯管線
楊輝則認為挑戰還在於適應證的選擇,“要麼在靶點上做出差異化,要麼同樣的靶點比海外推得更快,療效和安全性更好。”
“過去常見的是海外先做出有臨牀效果的療法,國內創新企業跟着‘Fast Follow’。但以後會越來越少,投資人也更加理性,這種方式很難融到資金。”楊輝説,在基因編輯領域,依靠基礎研究上的本土創新,以及大量國內患者數據,“去拓展國外進度較慢、或還未涉及的管線,在某個適應證上拿到全球首個數據,這才是發展方向。”
更重要的是,基因編輯並不是單純在彼此間比較,臨牀的療法選擇也不是“越先進越好”,包括衞生經濟學等的考量,陳潤生院士表示,“基因編輯技術主要是為了改變在遺傳密碼水平上,一些影響健康或導致疾病的變異,精準定位是它獨到性的優勢。
“但我認為它也只是整個醫學發展中的一種方法。比方説現在的小分子藥、免疫療法、以及小核酸藥物等,已經對很多疾病的治療起到了重要作用。基因編輯應該是和其他方法相輔相成,協同治癒疾病。”陳潤生院士説。