失敗的新藥與上岸的biotech,誰是接盤俠_風聞
氨基观察-生物医药新时代的商业智库和价值灯塔26分钟前
從商業模式來看,醫藥領域可能並非一個絕佳的市場。從研發開始,這些創新分子就面臨九死一生的局面,而在後期的商業化環節又存在叫好不叫賣的窘境。
失敗是常態,但行業的特殊性,又造就了一份難得的奇觀:產品失敗,但研發藥企卻獲得了成功。
邏輯在於,發散性的創新領域疊加較長的研發週期,讓大藥企有着極強的併購意願。
所以,在一款藥物的風險充分暴露之前,biotech可能已經被大藥廠“接盤”。在biotech獲得成功的同時,大藥企選擇承擔風險,也可能最終承受了風險。
Afferent就是這樣一個例子。雖然上市遇阻,但其卻被默沙東以12.5億美金收入懷中,提前完成退出動作。這筆交易,為公司的創始人和投資人都帶來了豐厚的回報。
然而,Afferent核心管線gefapixant讓默沙東處在一個難堪的境地。因為較為難看的3期臨牀數據,FDA委員會以12:1的姿態反對gefapixant上市。
雖然FDA不完全聽從委員會的意見,但gefapixant糟糕的臨牀數據以及委員會的表態,無疑讓事情變得微妙起來。
科學家們樂此不疲的研發與藥廠們孜孜不倦的引進,註定了Afferent的故事在創新藥領域比比皆是,gefapixant所處的慢性咳嗽領域,未來或許就會繼續上演這樣的故事。
這也進一步告訴市場,不管是誰,都要清晰的認識到,創新藥領域的價值評估是一門技術,更是一門藝術。
/ 01 / 上岸的Afferent
2015年夏天,低調的生物技術公司Afferent Pharmaceuticals,正準備進入IPO隊列。在此之前,其從一羣跨界投資者那裏,籌集了5500萬美元的C輪融資。
然而,突如其來的寒意,讓其IPO計劃從未實現。融資大門的關閉,對於Afferent來説,必然不是好事。這意味着,其後續的發展將會遇到更多阻力。
但命運總是如此奇妙。在IPO大門緊閉的時候,默沙東伸出了橄欖枝:以5億美元現金,以及7.5億美金潛在里程碑款的價格將其收購。
默沙東之所以願意出手,核心在於Afferent的核心管線P2X3抑制劑gefapixant,該藥物在慢性咳嗽領域展現了一定的潛力。
要知道,慢性咳嗽可以説是極為明確的藍海市場。
一方面,全球患者基數極大。通常,咳嗽持續時間超過八週會被定義為慢性咳嗽患者。由於誘因眾多,因此當無法確定慢性咳嗽的原因,或咳嗽在對任何相關疾病進行最佳治療後仍持續存在時,該病症被稱為RCC。數據顯示,美國RCC患者大約是900萬RCC。
另一方面,慢性咳嗽患者存在極為明確的臨牀未滿足需求。美國市場常用的止咳藥,對這類患者要麼效果不足,要麼存在安全性隱患,因此患者亟需一款行之有效的新療法。而RCC患者,甚至是無藥可用,截至目前FDA並未批准專門針對RCC的藥物上市。
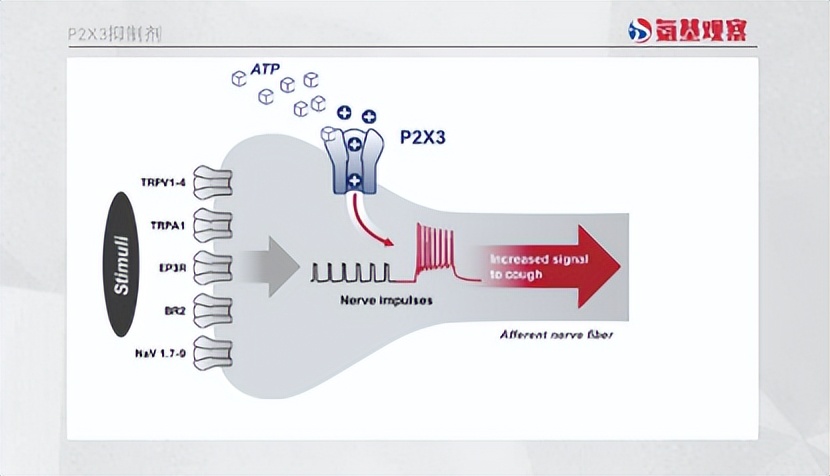
在這一背景下,gefapixant展現出治療潛力。P2X3受體過度活化後與感覺神經元的超敏有關,損傷或感染引發的呼吸道神經元超敏反應可引起過度、持續和頻繁地咳嗽,因而從機制上,拮抗P2X3受體有可能在不涉及中樞神經系統的情況下治療慢性咳嗽。
 當時,gefapixant的IIb期劑量遞增研究的數據顯示,低劑量50毫克組中約有一半的患者表現出至少50%的咳嗽減少。如果能夠保持下去,這一數據在該領域將會極具競爭力。
當時,gefapixant的IIb期劑量遞增研究的數據顯示,低劑量50毫克組中約有一半的患者表現出至少50%的咳嗽減少。如果能夠保持下去,這一數據在該領域將會極具競爭力。
也正因此,雖然IPO此路不通,但默沙東為Afferent創造了併購這一退出渠道。從公司經營層面來説,Afferent無疑是成功的。但對於默沙東來説,如今或許是另外一番滋味。
/ 02 / 失落的默沙東
故事的一開始,默沙東似乎押對了寶。
2022年1月,gefapixant在日本獲批用於治療成人RCC/UCC,成為全球首款P2X3受體抑制劑,彼時其它競爭對手均未進入3期臨牀,可謂遙遙領先。
但在其最期待的美國市場,gefapixant卻吃到了閉門羹。在日本上市一週後,FDA表示,基於療效擔憂,並未批准gefapixant上市。
對此,默沙東的應對方式是,對原有試驗進行了更多分析,期望以此説服FDA。但實際上,默沙東認為“有效”的結果,也並不突出。
在gefapixant的兩項3期臨牀P030、P027中,療效均不顯著。相比安慰劑,P030的咳嗽頻率下降14.6%,P027咳嗽頻率下降17%。而臨牀實驗預設的目標,是降低30%。
實際上,即便是P027的P值為0.057,略超出統計學顯著性邊界,仍意味着治療組有效的結果可能是偶然事件。
這也是為什麼,FDA在11月15日的文件中質疑“治療效果小”的原因。實際上,FDA對於默沙東的統計方式也不是非常認可。
默沙東的統計結果是“受試者24小時裏的咳嗽頻率”,算法是用咳嗽次數÷統計時間。但在FDA看來,這種減少是否具有臨牀意義,理由是“對該計劃中使用的終點經驗有限”。畢竟,FDA過去並未批准該類藥物上市。
也正因此,圍繞着gefapixant的上市問題,FDA委員會進行了討論。在經過7小時的討論後,13名專家進行了投票,其中12名專家投出反對票,認為gefapixant當前的臨牀數據,並不證明其在治療RCC/UCC患者方面具有臨牀意義。
雖然這並不意味着gefapixant將無法在美國上市,但前景的確不容樂觀。相比靠着II期臨牀數據早早上岸的Afferent,默沙東無疑是落寞的。
/ 03 / 循循反覆的故事
對於gefapixant來説,上市局勢不明朗,後來者卻來勢洶洶。
目前,葛蘭素史克的P2X3受體拮抗劑camlipixant,正在進行兩項3期臨牀試驗,有望在2024年下半年和2025年提供數據。葛蘭素史克表示,預計將獲得FDA對camlipixant的批准,並在2026年推出該藥物。
從早期臨牀來看,camlipixant的效果似乎較為明顯。在治療RCC的SOOTHE 2b期試驗中,50mg和200mg BID劑量的camlipixant在主要終點上取得了統計學意義,在第28天觀察到安慰劑調整後的24小時咳嗽頻率降低了34%(p ≤ 0.005)。
在安全性方面,camlipixant也展現出更優秀的潛力。在12.5mg、50mg和200mg BID劑量下,分別有4.8%、6.5%和4.8%的參與者觀察到味覺改變。沒有受試者報告完全或部分味覺喪失,也沒有因味覺相關不良事件而停藥。
而反觀gefapixant,上述提及的兩項3期臨牀,均有超過50%的患者經歷了味覺相關的不良事件,而因為不良事件退出的比例均超過15%。
很顯然,對於gefapixant來説,camlipixant是一個不容忽視的對手。當然,在臨牀成功之前,葛蘭素史克也難言完全上岸,甚至於,其複製默沙東的悲劇也不是不可能。
因為,Camlipixant也是葛蘭素史克通過20億美元收購的藥物,研發者Bellus Health已經實現了完美的退出。在葛蘭素史克伸出橄欖枝之前,Bellus Health不過是一家市值不到10億美金的上市藥企。
科學家們樂此不疲的研發與藥廠們孜孜不倦的引進,註定了Afferent的故事在創新藥領域比比皆是。
沒辦法,在風險較大的製藥行業,總有人要承擔更多。但也正是這些大藥廠的主動承擔,更好地推動了整個行業的正向循環。
正如羅氏CEO所説,“科學的成功不能被規劃,但我們可以創造條件,使之得以實現;我們需要對新想法持開放態度,勇於冒險,並偶爾挑戰大眾普遍持有的觀點;我們的研究人員需要自由地研究他們的想法,給他們充足的時間和持久努力的支援。”
