類器官之父最新論文,為肺部神經內分泌腫瘤帶來治療新靶點_風聞
世界生命科学大会-12-12 17:22
2009年,荷蘭 Hubrecht 研究所的Hans Clevers等人使用來自小鼠腸道的成體幹細胞培育出首個腸道類器官,開創了類器官研究的時代。此後,Hans Clevers 成立了類器官技術孵化公司 Hubrecht Organoid Technology ,併成功孵化了多家類器官研究公司。

自2009年以來,類器官領域研究成果不斷,許多新型類器官和更復雜的類器官不斷湧現,為新藥研發、精準治療、再生醫學等領域帶來了更強大的工具。
神經內分泌腫瘤(NEN)包括高分化的神經內分泌瘤(NET)和低分化的神經內分泌癌(NEC)。由於缺乏準確的研究模型,NEN患者的治療選擇有限。
2023年12月11日,Hans Clevers 團隊在 Cancer Cell 期刊發表了題為:Druggable growth dependencies and tumor evolution analysis in patient-derived organoids of neuroendocrine neoplasms from multiple body sites 的研究論文。
該研究從肺部神經內分泌瘤(NET)建立了患者來源的腫瘤類器官(PDTO),並從NEC的一個未被充分研究的亞型——大細胞神經內分泌癌(LCNEC)中構建了PDTO,這些PDTO保持了來源腫瘤的基因表達模式、瘤內異質性和進化過程。
該研究進一步確定ASCL1是LCNEC對BCL-2抑制劑治療反應的潛在生物標誌物。此外,該研究還發現肺部NET患者來源的腫瘤類器官(PDTO)對EGF的依賴性。與這些發現一致的是,研究團隊在一個獨立隊列中發現,大約50%的肺部NET表達EGFR。該研究確定了一個可成藥的肺部NET亞型的脆弱性,強調了這些患者來源的腫瘤類器官(PDTO)模型的實用性。

神經內分泌腫瘤(NEN)具有神經內分泌分化的特徵,在肺和胃腸胰系統中發病率最高,包括兩種不同的實體:神經內分泌瘤(NET)和神經內分泌癌(NEC),後者是低分化、高級別腫瘤,中位預期壽命不足1年。NEC可進一步細分為小細胞NEC和大細胞NEC。
小細胞NEC最常見於肺部,小細胞肺癌(SCLC)約佔所有肺癌的15%,並且比其他NEC研究得更深入。大細胞NEC(LCNEC)在胃腸胰(GEP)中更為常見。無論組織部位,治療LCNEC患者的指南仍然很初級。SCLC的治療指南是否適用於LCNEC患者,目前尚不清楚。
NET是高分化、低級別腫瘤(G1和G2)。雖然低級別NET通常預後良好,但高達35%的NET患者存在轉移,導致整體生存率顯著下降。轉移性G2期肺部NET患者的10年疾病特異性生存率為18%,目前尚不清楚這些患者的最佳治療策略。
對肺部NET的分子分析將其分為三組:侵襲性較小的A1組和A2組,以及侵襲性更大的B組。之前有發現了一個肺部NET亞組,稱為supra-carcinoids,具有低級別NET的組織病理學特徵,但分子特徵為大細胞NEC(LCNEC)的高侵襲性腫瘤。與G1/G2肺部NET相比,supra-carcinoids的10年總生存率較低,這表明了其臨牀相關性。
其他對肺部NEN的分析已經確定了與supra-carcinoids具有相似特徵的腫瘤亞羣,並且有幾篇已發表的報告顯示了高分化肺部NET的高度疾病特徵。但目前總體對supra-carcinoids的生物學知之甚少。
對於LCNEC或臨牀上侵襲性NET患者缺乏明確的治療標準,這突顯了臨牀上未滿足的需求。對小細胞肺癌(SCLC)研究受益於其多種疾病模型,然而,大細胞NEC(LCNEC)和神經內分泌瘤(NET)研究因缺乏臨牀前模型來測試關於神經內分泌腫瘤(NEN)潛在治療靶點和進展機制的假設而受到阻礙。
患者來源的腫瘤類器官(PDTO)是腫瘤細胞的三維培養物,可以長期擴增,並代表其來源腫瘤組織。迄今為止,只有少數PDTO來自高級別神經內分泌腫瘤(NEN),包括SCLC、肺部LCNEC和G3級胃腸胰NET和NEC。
在這項研究中,研究團隊建立了神經內分泌腫瘤(NEN)患者來源的腫瘤類器官(PDTO)的,包括低級別肺部NET(LNET)和來自多個組織部位的大細胞NEC(LCNEC)患者來源的腫瘤類器官(PDTO),還描述了小腸NET(SINET)患者來源的腫瘤類器官(PDTO)的短期培養。

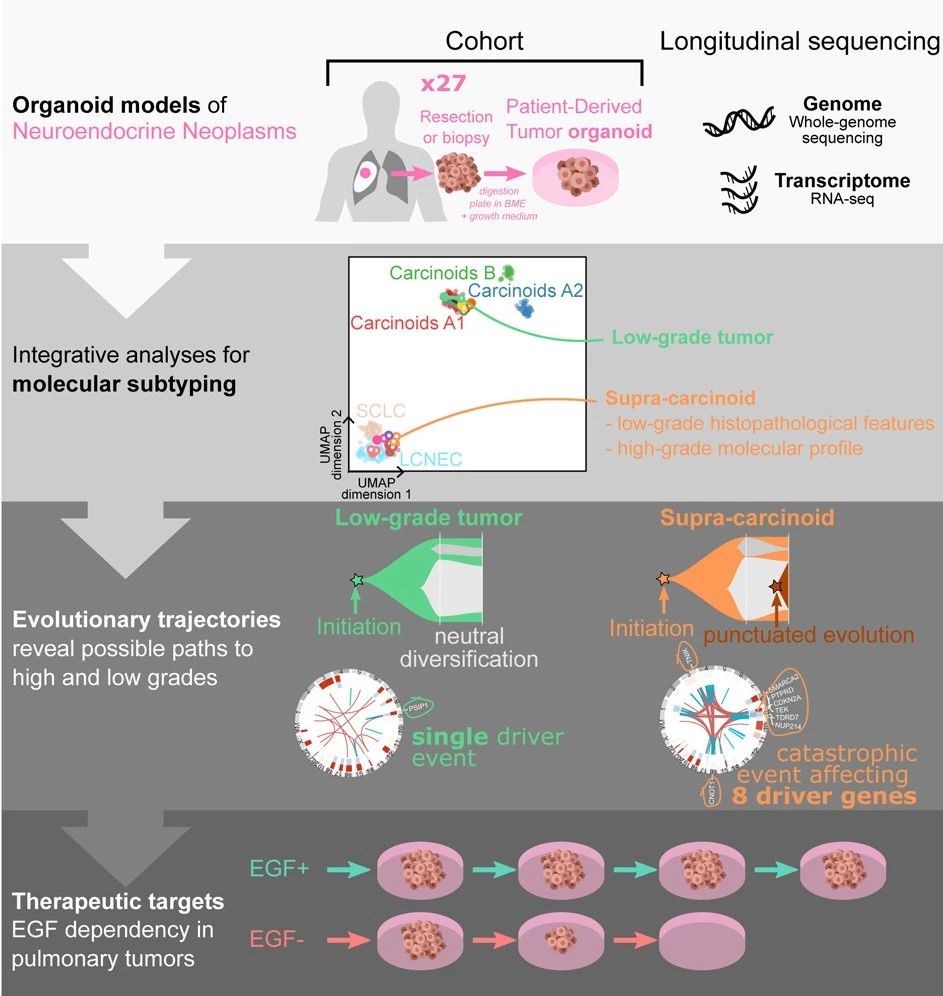
通過多組學和表型分析,研究團隊證實了神經內分泌腫瘤(NEN)患者來源的腫瘤類器官(PDTO)對其來源腫瘤的忠實度,並表明了它們保留了腫瘤內部的異質性和活躍的進化過程。利用這個平台,該研究發現了肺部NET雅興中一個潛在的可成藥治療弱點,表明生長因子依賴可能是這些腫瘤的一個特徵,可以用於治療。