海外BD再下一城,恆瑞醫藥連續三個季度營收淨利雙增
王力联系邮箱:[email protected]
文/王力 編輯/徐喆
10月25日晚間,恆瑞醫藥(600276.SH)發佈2023 年前三季度財務報告,數據顯示前三季度恆瑞醫藥實現營業收入為170.14億元,同比增長6.7%;歸母淨利潤為34.74億元,同比增長9.47%,扣非歸母淨利 33.60 億元,同比增長 10.13%。
從財報數據來看,在營收、淨利潤實現雙增的情況下,此前一直詬病的銷售費用在第三季度得到進一步優化。
機構持股方面,中歐基金作為恆瑞醫藥一直以來忠實的“陪跑者”,號稱“醫藥女神”的明星基金經理葛蘭在三季度公募基金管理規模下降16.79%背景下,再度加倉恆瑞醫藥。
此外,值得注意的是,今年10月17日,恆瑞醫藥自主研發的中國首個獲批的晚期肝細胞癌PD-1 抑制劑“艾瑞卡”成功授權給美國Elevar公司,這是恆瑞醫藥今年內簽署的第四個重要的“出海”協議,合同金額高達6億美元,標誌着恆瑞在國際市場上再下一城。
近年來,隨着醫保制度的改革不斷推進,醫保談判與藥品集中採購制度逐漸成為市場的主要趨勢。對於恆瑞而言,早年間專注於仿製藥領域,而集採下優勢弱化的恆瑞不斷加碼創新藥。
三季度營收、淨利雙增,銷售費用有所縮減
從恆瑞醫藥披露的財報數據來看,今年第三季度單季度,恆瑞醫藥實現營業收入58.45億元,同比增長2.24%;歸母淨利潤為11.66億元,同比增長10.57%。
今年以來,恆瑞醫藥已連續三個季度實現營收、淨利潤同比雙增長。
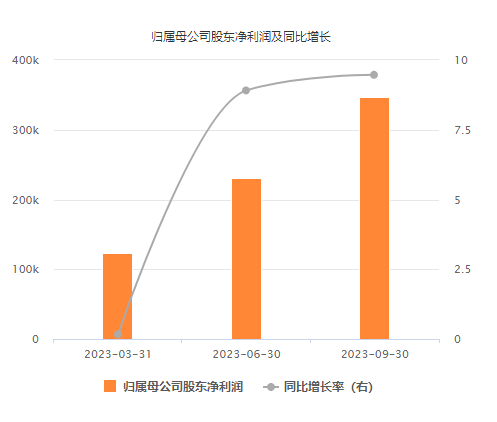
(數據來自恆瑞醫藥)
此外,三季度公司費用率進一步優化。期內,公司的銷售費用為54.09億元,同比增長4.78%;銷售費用率為31.79%,較上年同期的32.37%降低0.58個百分點。
經營活動產生的現金流淨額 43.09 億元, 同比增加 96.97%,主要為公司銷售商品收到的現金增加及支付的其他與經營活動有關的現金減少所致;研發費用方面,2023年前三季度,公司研發費用達37.25億元,同比上升6.52%。
2023年半年報顯示,恆瑞醫藥創新藥業務收入達49.62億元,約佔當期營收比例達44.43%。近年來,恆瑞醫藥一直以其獨特的“仿製+創新”戰略在醫藥行業嶄露頭角。然而,當前公司的“仿轉創”之路仍需面臨一系列的挑戰。
根據藥融雲一致性評價數據庫的數據,迄今為止,恆瑞醫藥及其子公司已獲得了76個仿製藥產品的一致性評價通過,同時有58個產品成功中標藥品集中採購。然而,傳統仿製藥產品的盈利空間在政策的壓力下受到了極大擠壓。2022年,恆瑞醫藥在其年度報告中指出,仿製藥集採政策的衝擊和中選價不斷下降,使公司的利潤空間急劇縮減。
在上一財年中,恆瑞醫藥的多個創新藥品的醫保價格經歷了重新調整,導致醫保銷售價格急劇下滑,進一步加劇了公司收入的下降。
近年來,隨着醫保體系的改革不斷推進,醫保談判和藥品集中採購制度逐漸成為市場的主要趨勢,這導致仿製藥的盈利空間不斷受到擠壓,上年度恆瑞業績出現下滑。如今隨着創新藥品的崛起,將有望填補仿製藥業績下滑的空缺。
在機構持股方面,中歐基金一直是恆瑞醫藥的忠實支持者。在葛蘭管理的公募基金管理規模在第三季度下降了16.79%的背景下,同一季度再次增持恆瑞醫藥。
海外BD加速,“雙艾”美國申報獲FDA受理
為推進創新藥研發進度,一直以來恆瑞醫藥研發投入位居行業前列。
在高強度研發投入加持下,恆瑞醫藥研發成果加速轉化落地,第三季度2類新藥鹽酸右美託咪定鼻噴霧劑兒童適應症獲批上市,該劑型為全球首款鼻噴劑型。
今年上半年,恆瑞醫藥成功推出了三款1類創新藥,分別為阿得貝利單抗、磷酸瑞格列汀、奧特康唑,以及一款改良型新藥,鹽酸右美託咪定鼻噴霧劑。
截至目前,恆瑞醫藥正臨牀開發的自主創新產品超80個,在國內已上市合作創新藥兩個,自研創新藥13個,臨牀試驗超270項目。
同時,恆瑞醫藥在海外研發方面也不斷加碼。從恆瑞醫藥官網獲悉,目前公司有近20項國際臨牀實驗,2022年,恆瑞醫藥的海外研發投入達到12.72億元,佔總體研發投入的20.04%,同時公司還在全球範圍內多國設立了研發中心。
自2018年以來,公司一直在與Elevar合作推進卡瑞利珠單抗(品牌名:艾瑞卡®)與甲磺酸阿帕替尼片(品牌名:艾坦®)的聯合使用研究。最新消息顯示,今年該研究迎來了一項重要的進展。
今年7月,美國FDA正式接受了卡瑞利珠單抗(艾瑞卡®)與甲磺酸阿帕替尼片(艾坦®)的聯合使用申請,這一治療方案被稱為“雙艾組合”,旨在用於一線治療不可切除或轉移性肝細胞癌患者。此次FDA的受理進一步推動了該研究的發展。
值得特別關注的是,恆瑞醫藥的“雙艾”研究成果近日登上了國際醫學期刊《柳葉刀》的主刊,這標誌着中國學者在腫瘤學領域首次主導並發表在《柳葉刀》主刊上的國際性III期臨牀研究成果。這一里程碑事件將有望進一步提升恆瑞醫藥在生物製品領域的國際聲譽。
而今年以來,恆瑞醫藥海外BD業務已實現四單。
不久前10月17日,恆瑞醫藥宣佈與美國Elevar Therapeutics公司達成合作,涉及注射用卡瑞利珠單抗(又稱抗PD-1單抗)的授權許可協議,交易規模高達6億美元。
根據此協議,恆瑞醫藥將授權Elevar使用其自主研發並擁有知識產權的卡瑞利珠單抗,允許Elevar在除大中華區和韓國以外的全球範圍內獨家開發和商業化卡瑞利珠單抗,用於治療肝細胞癌,採用聯合療法,其中與Rivoceranib的聯合應用備受關注。
公開資料顯示,Elevar Therapeutics, Inc.是一家快速崛起的生物製藥公司,總部位於美國新澤西州,並在愛爾蘭和韓國設有分支機構。其母公司HLB Inc.為韓國上市公司。據悉,卡瑞利珠單抗是由恆瑞醫藥自主研發的人源化PD-1單克隆抗體,2019年5月在國內獲得批准上市。該項目迄今已累計投入研發資金約228,017萬元。
同月內,恆瑞與印度製藥公司瑞迪博士實驗室(Dr. Reddy’s)簽訂合作協議,恆瑞醫藥將自主研發的人表皮生長因子1/2/4(HER1/HER2/HER4)靶向藥物吡咯替尼(馬來酸吡咯替尼片的簡稱)在印度範圍內的開發和商業化權益授權給給瑞迪博士實驗室。
協議內容顯示,作為首付款,恆瑞醫藥將獲得300萬美元,同時有權根據銷售業績獲得高達1.525億美元的銷售里程碑款。此外,根據協議,恆瑞醫藥還有資格按照許可產品在授權區域的年度淨銷售額計算,獲得兩位數比例的銷售提成。
據悉,Dr. Reddy’s是一家全球綜合性製藥上市公司,主要市場包括美國、印度、巴西、中國和歐洲。值得一提的是,這不是恆瑞醫藥首次將吡咯替尼引入國際市場,早在2020年9月,恆瑞醫藥以1.057億美元交易總額將吡咯替尼項目的韓國開發和商業化權益有償許可給了韓國的HLB-LS公司,該藥也是中國首個自主研發的抗HER1/HER2/HER4靶向藥。
此外八月,恆瑞醫藥將TSLP單抗SHR-1905注射液項目的全球範圍(除大中華區)的開發、生產和商業化權益授權給了美國One Bio公司。這項交易涉及2500萬美元的首付款,以及近期里程碑付款,此外還包括10.25億美元的研發及銷售里程碑款,以及一定比例的銷售分成。
更早前二月,恆瑞醫藥將EZH2抑制劑SHR2554(簡稱SHR2554)的全球權益(除大中華區外)授權給Treeline。這項交易的首付款達到1100萬美元,而將來的里程碑付款最高可達6.95億美元,還有根據年淨銷售額10%-12.5%的提成。