中國CAR-T新里程碑:傳奇生物再度出海,簽約諾華交易金額超10億美金
王力联系邮箱:[email protected]
文/王力 編輯/徐喆
繼國內首個用於成人復發或難治性B細胞急性淋巴細胞白血病的CAR-T產品“納基奧侖賽”獲批上市後,同月內,中國CAR-T細胞治療市場再現大額授權出海。
11月13日,傳奇生物宣佈與諾華製藥公司(Novartis Pharma AG)就傳奇生物的特定靶向 DLL3的嵌合抗原受體T細胞(CAR-T)療法簽訂了獨家全球許可協議,包括其自體 CAR-T 細胞療法候選藥物 LB2102 。
截至目前全球已上市的10款CAR-T產品,其中FDA批准了6款,國內的4款,包含此前11月剛剛獲批上市合源生物的納基奧侖賽注射液。
相較於傳統的放療和化療,CAR-T細胞治療具有更為個體化和特異性,減少對正常細胞的傷害,為癌症患者提供了一種新的治療選擇,尤其是在治療急性淋巴細胞白血病(ALL)和非霍奇金淋巴瘤(NHL)等血液系統癌症方面取得了顯著的突破。
然而對於企業而言,百萬元一針的“抗癌神藥”價格過高,前期研發費和後期的銷售費用都導致成本居高不下,且定製化需求導致無法批量生產也難以進入醫保,商業保險的覆蓋力度也有限,這導致了在國內上市的CAR-T療法,面臨銷售業績難以令人滿意的局面。
傳奇生物牽手諾華,交易金額超10億美金
11月14日,金斯瑞生物科技(1548.HK)宣佈,公司非全資附屬傳奇生物,將LB2102等DLL3 CAR-T療法的全球權益授權給諾華全球獨家許可,以開發、生產、商業化及以其他方式開發若干嵌合抗原受體T細胞“CAR-T”療法。
根據許可協議的條款,傳奇生物將獲得1億美元的預付款,並有資格獲得高達10.1億美元的臨牀、監管和商業里程碑付款以及分級特許權使用費。
據悉,傳奇生物將在美國進行LB2102的I期臨牀試驗,該療法用於治療廣泛期小細胞肺癌和大細胞神經內分泌癌,而諾華將負責許可產品的所有其他開發。
此前,LB2102新藥臨牀試驗(IND)申請已於2022年11月獲得美國食品藥品監督管理局(FDA)批准,用於治療廣泛期小細胞肺癌和大細胞神經內分泌癌。在2023年,美國FDA授予該產品“孤兒藥”稱號,進一步加強了其在創新藥領域的地位。
值得一提的是,這並非傳奇生物首次亮相在國際舞台。
2022年在A股市場因信達和禮來的PD-1單抗闖關FDA失敗消息而一蹶不振時,傳奇生物闖關FDA重振市場。
此前,美國食物藥品監督管理局(FDA)在審查信達和禮來PD-1單抗治療一線非鱗非小細胞肺癌的產品時給出否決意見,這一決定被視為FDA審批政策的收緊,給國內創新藥走向國際市場帶來了一系列的障礙。
同年三月,傳奇生物的CAR-T細胞療法產品西達基奧侖賽(Cilta-cel)在美國獲得FDA批准上市,成為中國首個出海的CAR-T療法產品。同時,它也是全球第二款獲批靶向BCMA的CAR-T產品,為中國創新藥在國際市場上取得的重要成就打下了堅實基礎。
根據傳奇生物公佈的財報數據,西達基奧侖賽(Carvykti)在2023年Q1-Q3實現了3.41億美元的營收,同比增長332%。目前,該產品僅在美國、歐盟和日本上市。
值得注意的是,傳奇生物出海之路的順暢背後也離不開強生、高瓴在內的資本扶持。
傳奇生物延續資本化“傳奇”,機構巨頭鼎力支持
2017年6月,傳奇生物成功推出國內首個CAR-T療法產品——西達基奧侖賽,將其早期數據在ASCO年會上展示。這組數據幾乎完美,立即吸引了強生等大型製藥公司的高度關注。
隨後,強生向傳奇生物支付了創紀錄的3.5億美元首付款,這一成交不僅刷新了當時中國藥企licens-out首付款的最高紀錄,還確立了雙方合作的最優條件。自此,雙方攜手共同推進BCMA CAR-T的臨牀開發和商業化。
觀察傳奇生物的股權結構,其前身為母公司金斯瑞生物拆分而來。在2020年3月10日,金斯瑞生物科技發佈公告,宣佈擬分拆其主營細胞治療業務的子公司——傳奇生物科技股份有限公司,此後赴美上市。
在2021年5月,傳奇生物迎來了第二位重要投資者——高瓴資本。當時,傳奇生物以3億美元的價格向高瓴資本旗下的LGN Holdings Limited出售了約2081萬股股份,佔總股本的6.58%。與此同時,高瓴資本還入股了金斯瑞生物、蓬勃生物和傳奇生物。
今年五月,高瓴再度多次加倉傳奇生物,短短一個月內,傳奇生物累計完成了5.849億美元募資,其中高瓴資本也再度增持。
除高瓴外,傳奇生物還獲得了RA Capital以及美國資產管理機構T.Rowe Price(普徠仕集團)的重要投資。值得注意的是,這三大機構分別為傳奇生物的傳奇股東,其在2022年四季度的持股比例分別為3.07%、1.46%和0.39%。此次融資表明,這三家機構對傳奇生物的未來發展持續看好。
資本的眼光“毒辣”有目共睹,普徠仕集團、高瓴和RA Capital的加註,使得傳奇生物這座生物科技公司迎來了一波強勁的資金支持。這也意味着,傳奇生物的重要產品即將商業化,未來將成為一座“金礦”。
在cilta-cel獲批之際,其定價也成為業內關注焦點。據瞭解,強生公司北美製藥總裁Scott White透露,cilta-cel的定價為46.5萬美元,略高於Abecma的41.95萬美元。強生公司曾在財報會議上表示,cilta-cel的銷售峯值可達50億美元。傳奇生物將在美國醫院市場展開推廣,而強生主要集中在社區銷售,這為傳奇生物在國際化舞台上的發展提供了廣闊空間。
值得期待的是,傳奇生物與諾華簽署的重磅合作,使得其CAR-T產品在國際市場上有望迎來更多的關注和認可。目前,西達基奧侖賽正在逐步放量中,傳奇生物未來的國際化佈局備受期待。
120萬一針,國內CAR-T產品商業化如何?
被一眾明星資本追捧的CAR-T療法究竟有何神奇?
公開資料顯示,CAR-T療法(Chimeric Antigen Receptor T-Cell Immunotherapy)是嵌合抗原受體T細胞免疫療法,這是一種近幾年來通過優化在臨牀腫瘤治療上新型的治療腫瘤的精準靶向療法。
T細胞也叫T淋巴細胞,是白細胞的一種,來源於骨髓造血幹細胞,其能夠抵禦和消滅腫瘤、感染等外來異物。
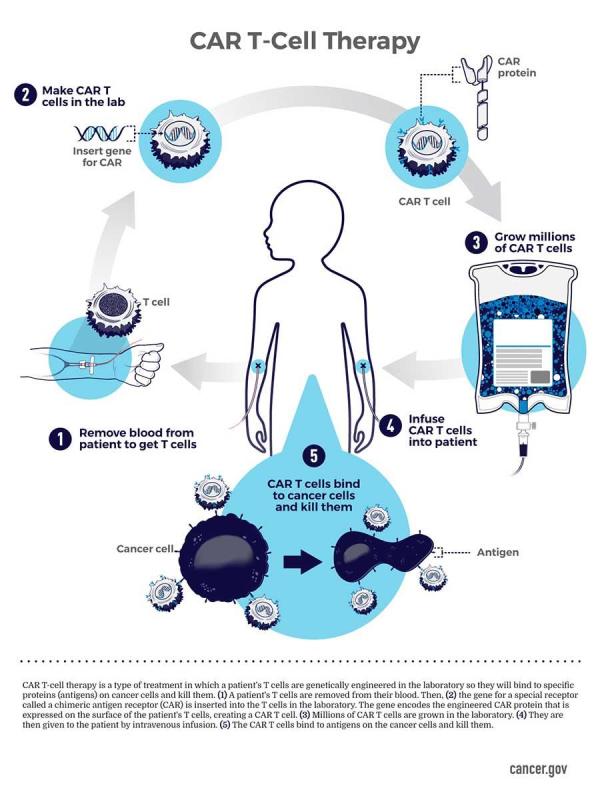
(圖片來自美國國家癌症研究所)
這是一種高度個性化定製的產品,CAR-T療法需要“個性化定製”,每一次治療,生物製藥公司需要從患者身上採集T細胞,在體外進行基因工程修飾後,再回輸給患者,這決定了它無法進行大規模量產。且製備時間長、製備原料昂貴,導致CAR-T療法成本居高不下。如何降低CAR-T療法的生產成本是重中之重。
而正因為此, CAR-T療法的價格居高不下,國際市場上單針大多超200萬人民幣,除傳奇生物cilta-cel46.5萬美元/針外,諾華的Kymriah產品價格也高達47.5萬美元/針,最早獲批的Abecma也仍然高達41.95萬美元/針。
隨着各大跨國藥企2023年Q3財報的出爐,全球範圍內來看,2023前三季,吉利德的Yescarta銷售額最大,營收11.3億美元,吉利德兩款CAR-T產品2023Q1-Q3營收達到14.03億美元。
諾華的Kymriah(Tisagenlecleucel)是全球首款上市的CAR-T療法,由於競爭激烈,2023年Q3營收1.24億美元,同比下降7%(按照USD),2023Q1-Q3營收3.88億美元。
吉利德兩款CAR-T產品Yescarta®和Tecartus®明顯增長,前三季度銷售額共計14.03億美元,與2022年同期相比增長36.9%; Q3銷售額共計4.86億美元,同比增長22%;
百時美施貴寶(BMS)的兩款CAR-T療法Abecma和Breyanzi,同期內共營收6.35億美元,同比增長62.8%。
國內市場上,佈局的上市公司包括信達生物、科濟藥業、先聲藥業、藥明巨諾等。當前許多臨牀實驗正在推行,但由於臨牀資源緊缺、研發資金前期投入較大等原因,行業內推進速度緩慢。
而已獲批的產品來看,國內CAR-T商業化也相對有限。
傳奇生物的Carvykti在前三季度累計銷售達到3.41億美元(約24.93億人民幣,按照50%的分成,傳奇生物可獲得1.7億美元收入,約12.47億人民幣。
從國內市場觀察,目前,國內已經上市的CAR-T療法包括復星凱特奕凱達、藥明巨諾倍諾達、馴鹿生物福可蘇以及合源生物剛剛獲批,國內首款用於治療成人復發或難治性B細胞急性淋巴細胞白血病(r/r B-ALL)的源瑞達。
以藥明巨諾為例,2022年該公司在CAR-T療法方面的處方量僅為165張,該領域在國內市場滲透有限。
儘管治療人數相對較為有限,但由於CAR-T療法的定價超過100萬元,該領域為藥明巨諾帶來的收入規模並不容忽視。在2022年,藥明巨諾的總收入達到1.45億元。然而,受到高額的銷售費用和研發支出的影響,藥明巨諾在同一年仍然虧損8.55億元。
儘管國內CAR-T療法在定價上已經顯得相對“便宜”,但其仍然維持在120萬元左右,加上其他治療成本等因素,總費用超過200萬元。在這一背景下,CAR-T療法在商業化過程中仍然面臨着重重阻力。
據世界衞生組織最新發布的數據顯示,中國的癌症新發病例和死亡人數在全球範圍內位居榜首,當前我國的惡性腫瘤負擔不斷加重。根據弗若斯特沙利文研究機構的預測,中國CAR-T市場的規模預計到2030年將達到289億元,於企業而言國內CAR-T市場仍具有巨大的發展潛力。