兩部門公佈新版《目錄》:禁止出口人體基因編輯技術,範圍縮窄至生殖細胞
王力联系邮箱:[email protected]
(文/王力 編輯/徐喆)12月21日,商務部、科技部發布公佈的《中國禁止出口限制出口技術目錄》正式實施引起廣泛關注。亮點在於,該目錄新添了“用於人的細胞克隆和基因編輯技術”,將其列為禁止出口技術的範疇。
根據《目錄》,對於“用於人的細胞克隆和基因編輯技術”的具體定義突顯了其倫理爭議和潛在嚴重危害。這些技術主要牽涉到對人體生殖細胞中的遺傳物質進行編輯,包括但不限於胚胎細胞、卵子細胞和精子細胞。
值得一提的是,在2022年12月30日,商務部公佈的修訂版《中國禁止出口限制出口技術目錄》徵求意見稿中,就已經首次提及“用於人的細胞克隆和基因編輯技術”作為禁止出口技術。然而,今年的最終定義明顯縮小了範圍,呈現出更為明確的輪廓。
作為頗具前瞻性的技術,基因編輯和合成生物學一直是全球科技競爭的焦點。值得注意的是,美國曾在這兩個領域進行技術封鎖。新版目錄的發佈是否意味着新一輪的技術對抗,對於國內從事基因編輯和合成生物學的企業而言,是否將帶來影響,一系列的問題在業內引發熱議。
新《目錄》禁止人體基因編輯技術出口
12月21日,商務部、科技部修訂發佈《中國禁止出口限制出口技術目錄》(以下簡稱《目錄》)。
商務部在面對媒體提問時表示,本次《目錄》修訂充分徵求了相關部門、行業協會、業界學界和社會公眾意見。這一調整是對2008年、2020年兩次調整的延續,旨在適應技術發展變化,維護技術出口秩序。
具體來看,此次《目錄》內公刪減了34項技術條目,新增4項,修改37項。具體內容包括刪除禁止出口的綠色植物生產調節劑製造技術等6項,以及限制出口的醫用診斷器械及設備製造技術等28項。同時,新增了用於人的細胞克隆和基因編輯技術作為禁止出口技術,對37項技術條目的控制要點和技術參數也進行了調整。
關於技術出口,商務部表示將進一步優化管理措施,簡化手續,提供更多公共服務,引導企業做好合規工作。
而這一調整將如何影響技術對抗升級、出口限制對領域投資的影響,成為業內關注的熱點話題。
從新版《目錄》來看,此次新增的用於人的細胞克隆和基因編輯技術具體解釋為“具有倫理爭議,且可產生重大危害,用於對含有遺傳物質的人體生殖細胞(即胚胎細胞、卵子細胞、精子細胞)進行編輯的基因編輯技術”。
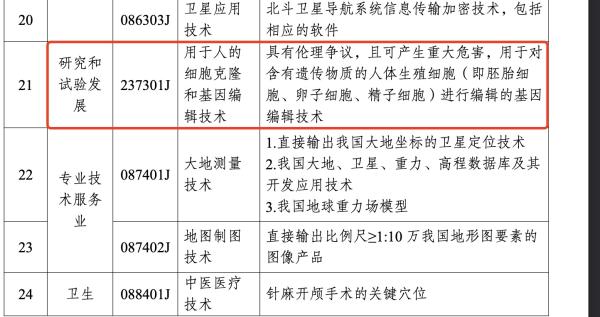
(截圖來自中華人民共和國商務部官網)
具體而言,該限制適用於對含有遺傳物質的人體生殖細胞,包括胚胎細胞、卵子細胞和精子細胞進行編輯的基因編輯技術。
業內人士認為,禁止出口用於人的細胞克隆和基因編輯技術的決策是基於對這些技術的倫理爭議以及可能帶來的重大危害的考量,而基因編輯技術是各國戰略性新興產業的主攻方向,對於搶佔新一輪科技革命和產業革命制高點,加快壯大新產業、發展新經濟、培育新動能,具有重要意義。
一直以來,為了佔據產業高地,美國為保持其技術、科學等方面的領先地位,對中國高科技領域採取一系列管制措施。
2018年11月19日,美國商務部工業安全署出台了一份針對關鍵技術和相關產品的出口管制框架,該框架列示的首個管制領域即為生物技術,其中便包括合成生物學。根據美國商務部工業安全署官方披露數據顯示,2019至2020年,美國先進生物技術出口至中國的金額由 22.85億美元下降至18.51億美元,下跌幅度達19%。《2021美國創新與競爭法案》中將合成生物學、生物科技、基因組學列入關鍵技術領域。
中美技術之爭,國內企業影響幾何?
從公司層面解讀,這一限制可能使得企業面臨更為嚴格的技術出口審批程序,需要履行更加複雜的手續。而於構造“細胞工廠”的企業而言,《目錄》更新影響幾何?
基因編輯(Gene Editing),又稱基因組編輯(Genome Editing)或基因組工程(Genome Engineering),是一項精確的科學技術,可以對含有遺傳信息的基因序列進行插入、刪除、替換等進行修改。
基因序列改變有可能對蛋白質的表達造成影響,並且蛋白質的一個重要功能是調節生命活動,所以基因序列的改變甚至會影響整個生命體的生理生化活動。
目前,人體基因編輯可分為兩個主要方向:一是編輯患者的體細胞,以治療疾病;另一是編輯生殖細胞(精子、卵細胞或受精卵),旨在預防遺傳疾病或增強某些功能。這兩者的應用存在顯著差異。
編輯患者體細胞的治療方式是通過修改體細胞來治療患者。這種治療的目標是隻影響接受治療的個體,而不對其後代產生影響。
相比之下,生殖細胞編輯在胚胎形成過程中或之後進行基因改變,這可能在兒童細胞中(包括生殖細胞)產生影響。與體細胞編輯不同,經過生殖系編輯的人類可能將這些基因編輯傳遞給他們的後代,因此存在潛在的污染人類基因庫的風險,因而這種技術目前未被廣泛採用。
而對於基因編輯企業來説,此次《目錄》的限制範圍是基因編輯在具有倫理爭議領域的應用,包括基因編輯胚胎細胞、卵子細胞、精子細胞和可造成重大危害後果的研究中的應用,當前國內大部分基因編輯企業都是編輯患者的體細胞以治療疾病,並不涉及生殖細胞編輯,因此限制出口的影響有限。
從基因編輯產業鏈來看,上游為科研機構和高校,包括中科院生化交叉研究中心、哈佛大學、清華大學、北京大學等均為該領域的重要參與者,代表着國內外頂尖的科研水平。而設計基因編輯技術的企業大多為初創企業尚未登陸資本市場,管線研發也多在臨牀早期,除輝大基因外還包括瑞風生物、本導基因等。
在中游企業方面,產品供應商包括源井生物、信念醫藥、吉瑪基因、諾唯贊等,而技術服務商包括九天生物、南模生物、博雅輯因等。這些企業在基因編輯領域扮演了關鍵的角色,通過提供產品和技術服務,支持上游科研機構和下游企業的需求。
下游CRO(臨牀研究外包)公司包括賽業生物、博騰生物、冠科生物等,而製藥公司則有芳拓生物、凌意生物、紐福斯等。
“科學的前沿,倫理的邊緣”,倫理審查成關鍵
從營收角度來看,我國基因編輯行業正處於發展前期階段,但技術層面來看,中國的基因編輯並不算落後。
今年12月初,美國食品藥品監督管理局(FDA)宣佈批准兩款CRISPR/Cas9基因編輯療法上市,標誌着基因編輯療法正式邁入監管認可的藥物領域。
業內普遍認為,這一天是基因編輯療法的歷史性時刻,這也標誌着人類正式進入利用基因編輯治療疾病的新時代。
這兩款療法分別是由福泰製藥與CRISPR Therapeutics合作研發的Casgevy以及藍鳥生物的Lyfgenia,獲批用於治療12歲及以上伴有複發性血管閉塞危象的鐮狀細胞病患者。
CRISPR-Cas9技術被稱為是“上帝的剪刀”,其原理是利用一種特殊的酶簇,來精確地編輯DNA序列,然後通過細胞自身修復機制,實現插入、刪除或修改特定基因,相對於傳統的基因編輯技術,具有更高的效率和精確性。
而反觀國內,實則早在2016年7月,四川大學華西醫院腫瘤學教授盧鈾團隊宣佈將開展“全球第一例”CRISPR–Cas9基因編輯人體臨牀試驗,同年10月28日,首名癌症患者接受了經CRISPR技術改造的T細胞治療,中國也是第一個將CRISPR用於人體試驗的國家。
近年來,我國也自主研發了基因編輯工具。2022年1月,輝大基因研發的CRISPR-Cas13 RNA編輯器系統-Cas13X和Cas13Y的底層專利就獲得了美國專利商標局授權。這是我國首個自主研發的、在美國獲得專利授權的CRISPR-Cas13基因編輯工具。
此後今年六月,輝大基因科學家團隊自主開發的新型DNA編輯系統CRISPR-Cas12i(Cas12Max®)的美國發明專利US11,649,444B1,通過專利快速審查通道,在短短9個月內正式獲得美國專利商標局(USPTO)授權,實現了中國首個CRISPR-Cas12i系統底層專利的海外佈局突破。
當前,中美在基因編輯領域的競爭主要集中在臨牀試驗倫理上,而在我國,關於基因編輯在臨牀試驗中的具體操作一直存在爭議。目前,我國的企業在臨牀試驗中主要限於處理單一基因遺傳病,而且更偏向於罕見病,而美國同行在治療疾病的選擇上則更為廣泛。
CRISPR-Cas9技術系統雖然為基因編輯提供了便利,但它有時會在非目標位點上引發錯誤的DNA修復,導致基因序列意外變化,為臨牀治療帶來潛在風險。
除了技術層面的風險,CRISPR-Cas9技術也引發了基因編輯的倫理爭議。通過基因編輯,我們有可能改變人類的遺傳信息,甚至創造“設計嬰兒”。這一技術是否應該用於人類胚胎的基因編輯引發了全球範圍內的爭議和道德觀點的衝突。
基因編輯問題不僅僅是學術上的困擾,更是一個社會問題。在2022年發佈的《關於加強科技倫理治理的意見》中,我國首次提出了基因編輯的道德倫理規範,將其納入國家層面的治理框架。