30年互相矛盾的星形膠質細胞研究,終於迎來一錘定音_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!18分钟前

撰文 | 維羅妮卡(清華大學醫學院)
神經系統主要由兩類細胞組成:神經元(neuron)和神經膠質細胞(neuroglia或glial cell,簡稱膠質細胞)。長期以來,人們普遍認為神經系統的功能活動主要由神經元承擔,而神經膠質細胞則被視為“背景細胞”,僅具備為神經元提供支持、營養和保護等輔助作用。然而,隨着相關研究的深入,這一觀點逐漸受到挑戰——神經膠質細胞的作用遠不止如此。
2023年9月,《自然》雜誌刊登的一篇文章首次證實,星形膠質細胞中存在一個特定的亞羣,能夠通過胞吐作用釋放穀氨酸,從而參與神經系統的電信號傳導。這一發現顛覆了傳統認知,揭示了星形膠質細胞在神經系統中具有重要的生理作用,也為複雜神經性疾病的治療開闢了新的思路。
01
星形膠質細胞:數量最多且功能最複雜的膠質細胞
1856年,德國病理學家魯道夫·魏爾肖(Rudolf Virchow, 1821-1902)首次描述了膠質細胞[1],將其視為大腦和脊髓內將神經元連接在一起的結締組織。膠質(glia)一詞源於希臘語中的膠水(glue),這也反映了科學家們對膠質細胞功能最初的理解——將神經元“黏”在一起,編織成嚴密的神經網絡。在人類中樞神經系統內,膠質細胞的數量為神經元的10~50倍,多達1~5x10^12個[2]。與神經元相似,膠質細胞表面也有突起,但並沒有樹突和軸突之分,彼此之間不能形成化學性突觸,而是通過縫隙連接相連。如果將神經元及其突起比作森林,那膠質細胞便是森林中的真菌,包裹着一棵棵樹幹,交織成網。
事實上,膠質細胞並非單一種類細胞,而是包括多種細胞類型。在中樞神經系統中,膠質細胞主要包括星形膠質細胞(astrocyte)、少突膠質細胞(oligodendrocyte)和小膠質細胞(microglia)等;在周圍神經系統中,則主要包括施萬細胞(Schwann cell)和衞星細胞(satellite cell)等。
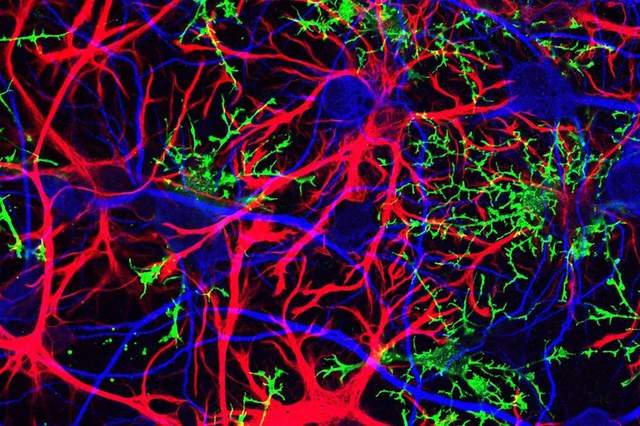
我們今天的主角是星形膠質細胞。星形膠質細胞是中樞神經系統內數量最多、功能最複雜的膠質細胞,是維持神經系統穩態不可或缺的組分,可以説是膠質細胞中的“明星”。
1871年,意大利神經解剖學家及病理學家卡米洛·高爾基(Camillo Golgi,1843-1926,即著名的高爾基體的發現者)發明了著名的鉻酸鹽-硝酸銀染色技術[3],通過顯微鏡觀察到星形膠質細胞的形態,並將其分為兩種基本亞型——原生質型(protoplasmic)和纖維型(fibrous)。在傳統觀點中,前者主要分佈於灰質中,突起短粗且分支眾多;後者主要分佈於白質中,突起長直且分支較少。但這種分類方法顯著低估了星形膠質細胞的異質性。事實上,在大腦的不同區域及不同皮質層中,星形膠質細胞都存在轉錄水平及功能水平上的高度異質性。然而,關於這種異質性是如何形成的,目前尚無定論。
在不同物種中,星形膠質細胞在中樞神經系統中的佔比約為20~50%[4]。數量眾多的星形膠質細胞與神經元緊密相鄰並膠合在一起,它們的長突起在腦和脊髓內交織成網,構成支撐神經元的支架。星形膠質細胞的突起末端膨大,形成血管周足,參與血-腦屏障(blood-brain barrier, BBB)的形成。這些突起包裹着神經元的神經末梢,同時避免不同傳入纖維的相互干擾,起到隔離中樞神經系統內各個區域的作用。
除了這些基本功能以外,科學家們發現星形膠質細胞還具有更多複雜的功能。例如,星形膠質細胞能夠攝取神經元釋放的遞質——穀氨酸(glutamate)和γ-氨基丁酸(γ-aminobutyric acid, GABA),並將其轉化成谷氨醯胺(glutamine)。這些神經遞質可以激活神經元表面的受體,使神經元興奮,從而實現相鄰神經元之間的電信號的傳遞。而谷氨醯胺無法激活受體,避免了神經元的持續興奮,還能被轉運回神經元內循環利用,為神經元合成新的遞質提供原料。
人類大腦約佔總體重的2%,卻要消耗全身20%的葡萄糖,其中神經元對能量的需求最高,需要持續的葡萄糖供應。星形膠質細胞能攝取血液中的葡萄糖,將其轉化為糖原儲存,或轉化為乳糖來為活躍的神經元供能。這一代謝過程與星形膠質細胞-神經元間的抗氧化物交換系統密切相關,有助於減輕神經元的氧化應激損傷。此外,星形膠質細胞還能產生多種神經營養因子,對神經元的生長、發育、存活和功能完整性具有重要作用。
在發育過程中,星形膠質細胞發揮着引導神經元遷移和修剪突觸(synaptic pruning)的作用,調節突觸的形成和功能。而它們本身還能作為中樞神經系統內的抗原提呈細胞,將抗原呈遞給T淋巴細胞,發揮免疫應答作用。
與神經元不同,膠質細胞終身具有分裂增殖的能力。大腦和脊髓發生損傷變性時,主要依靠星形膠質細胞的增生來填充組織缺損。然而,增生過強可能導致膠質細胞腫瘤的形成,也可能成為引起癲癇發作的病灶。研究表明,在體外能夠實現誘導膠質細胞向神經元分化,這為多種神經退行性疾病的治療提供了希望[5]。但也有學者持相反觀點,認為膠質細胞-神經元轉化尚無法實現。他們使用譜系追蹤技術證實膠質細胞並未轉化為神經元,而是某些內源性神經元被錯誤標記[6]。
02
爭論不休:星形膠質細胞能否參與電信號傳導?
從以上的介紹可以得知,關於星形膠質細胞功能的研究是重要的前沿課題之一,仍有許多未知留待人們探索。這其中就有一個延續了數十年的問題:星形膠質細胞是否參與神經系統的電信號傳導。
電信號傳導是神經系統正常運作的基礎,對維持生命活動、適應環境變化及實現生物體的複雜功能至關重要。電信號傳導的異常可能導致多種疾病的發生,包括神經退行性疾病、癲癇和疼痛障礙等。在學界既往的認知裏,神經元是神經系統唯一具有電信號傳導功能的細胞。有學者認為星形膠質細胞可能參與電信號傳導,但始終缺乏一錘定音的證據。
1990年,美國耶魯大學醫學院的研究團隊發現[7],在體外培養條件下,穀氨酸能夠誘導海馬星形膠質細胞內遊離鈣離子水平的升高。該研究證實星形膠質細胞表面也存在穀氨酸受體,表明其可能參與神經電信號傳導。
1994年,美國愛荷華州立大學動物學與遺傳學學院的研究團隊構建了星形膠質細胞-神經元的體外共培養體系[8],發現在加入緩激肽(bradykinin)後,星形膠質細胞內的鈣離子濃度升高,進而誘發穀氨酸釋放。釋放的穀氨酸通過與神經元表面的穀氨酸受體結合,能引發神經元內鈣離子濃度的升高。而在沒有星形膠質細胞的孤立神經元培養體系中,緩激肽的加入不會引起神經元內鈣離子濃度變化。這表明在體外培養條件下,星形膠質細胞能通過釋放穀氨酸向神經元傳遞電信號。
1997年,來自意大利米蘭大學藥理學研究所的安德里亞·沃爾泰拉(Andrea Volterra)團隊發現反向的結論同樣成立[9],即星形膠質細胞能對神經元發出的電信號作出反應。他們使用熒光共聚焦顯微鏡觀察大鼠大腦切片,發現刺激神經元傳入纖維能引起星形膠質細胞內鈣離子濃度的波動(oscillation),且鈣離子濃度波動的頻率與神經纖維接收的刺激模式有關。

一般理論認為神經元之間信號的傳導過程是,突觸前神經元釋放神經遞質,激活突觸後神經元表面的受體,引發細胞內鈣離子濃度波動,從而興奮突觸後神經元。在發現星形膠質細胞可能參與電信號傳導後,便有學者提出了“三重突觸”理論(tripartite synapse)[10]。該理論認為,突觸處的電信號整合及傳導不只涉及突觸前端和突觸後端,鄰近的突觸周圍星形膠質細胞也參與這一過程。
在2000年至2012年間,該領域發表了超過100篇論文,支持星形膠質細胞通過突觸參與神經電信號的傳導。但也有反對的聲音,質疑數據收集及解釋的合理性。反對觀點認為,大多數實驗是在體外培養的星形膠質細胞中進行的,不能證明星形膠質細胞釋放神經遞質(gliotransmission)的過程在體內真實發生。
體內實驗中,最有力的證據來自於一個星形膠質細胞的囊泡釋放受到抑制的轉基因小鼠模型。然而在2014年,有學者發現這一在星形膠質細胞研究中廣泛應用的小鼠模型存在缺陷[11],導致所有應用此小鼠模型進行的研究可靠性存疑。在此小鼠模型中,研究者使用膠質細胞纖維酸性蛋白(GFAP)啓動子來敲除囊泡運輸及釋放過程中的關鍵蛋白(SNARE),從而抑制遞質釋放。既往研究認為,GFAP僅在星形膠質細胞中特異性表達,但後來發現部分神經元也能表達GFAP。因此,該小鼠模型存在“脱靶效應”。敲除SNARE後觀察到的生物學效應,不能證明星形膠質細胞遞質釋放過程在體內存在且具有生理功能,因為該效應可能與部分神經元的遞質釋放被抑制有關。
正如前文有關星形膠質細胞功能的介紹,大多數學者認同,星形膠質細胞能攝取神經元釋放的穀氨酸,從而消除神經遞質對神經元的持續作用。但關於星形膠質細胞能否通過釋放穀氨酸參與神經元電信號的傳導,仍需更直接的證據加以證實。
03
Nature最新研究力證星形膠質細胞參與神經電信號傳導
繼1997年發現神經元能向星形膠質細胞傳遞電信號以來,安德里亞·沃爾泰拉(Andrea Volterra)團隊一直致力於研究星形膠質細胞-神經元信號交流,並在此領域做出了卓越貢獻。2023年9月,《自然》雜誌刊登了沃爾泰拉團隊的研究論文[12],題為《特化的星形膠質細胞在中樞神經系統中介導穀氨酸能神經遞質傳遞》(Specialized astrocytes mediate glutamatergic gliotransmission in the CNS),為星形膠質細胞參與神經電信號傳導提供了強有力的證據。

通過對8個小鼠海馬單細胞轉錄組測序開源數據(single-cell RNA sequencing)和對小鼠海馬單細胞膜片鉗測序數據(patch-seq,一種可以對單個神經元進行電生理學、形態學和轉錄組學的多模式表徵的技術)的整合分析,研究者將小鼠海馬星形膠質細胞劃分為9個擁有不同分子學特徵的亞羣,並發現僅其中一個亞羣選擇性表達與胞吐作用(exocytosis,指細胞內囊泡與細胞膜融合從而將囊泡內物質運送到細胞外的過程,是神經遞質釋放的重要機制)、鈣離子調控胞吐作用(calcium-ion-regulated exocytosis)、神經遞質分泌調控(regulation of neurotransmitter secretion)和穀氨酸分泌調控(regulation of glutamate secretion)相關的基因。這就説明該亞羣的星形膠質細胞在理論上能夠參與電信號傳導。而該亞羣的星形膠質細胞在小鼠大腦區域內分佈不均勻,甚至在特定的神經迴路中也非均勻分佈。
為了驗證人類大腦中是否存在該亞羣的星形膠質細胞,研究者在3個人類海馬單細胞轉錄組測序開源數據中搜索他們發現的特異性分子標記物。結果證實,能夠釋放穀氨酸的星形膠質細胞亞羣同樣存在於人類海馬中。
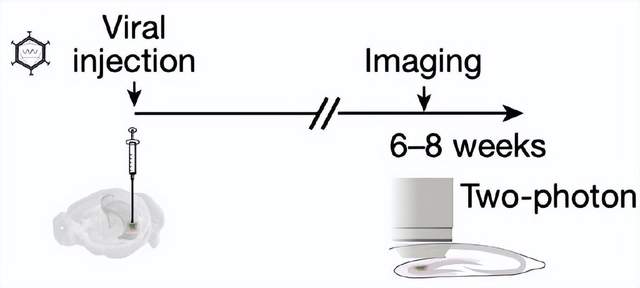
單細胞轉錄組學測序結果引人注目,但仍然只是間接證據。為了直接證實特定星形膠質細胞能夠釋放穀氨酸,沃爾泰拉團隊使用雙光子共聚焦顯微鏡在小鼠大腦齒狀回背側分區(dorsal molecular layer of dentate gyrus,數據預測該區域內富含穀氨酸分泌星形膠質細胞)中觀察遞質釋放。研究者利用在小鼠星形膠質細胞中選擇性表達的穀氨酸感受器成像,並在實驗體系中添加了突觸釋放阻滯劑,以排除神經元遞質釋放干擾。為了模擬體內由G蛋白偶聯受體(G protein-coupled receptors, GPCR)介導的鈣離子濃度依賴穀氨酸遞質釋放過程,研究團隊在實驗小鼠星形膠質細胞中表達了由氮-氧氯氮平(clozapine N-oxide, CNO)激活的GPCR受體。在小鼠大腦切片局部加入CNO後,他們在一部分星形膠質細胞中觀察到了穀氨酸遞質的釋放,並發現這部分星形膠質細胞聚集在特定區域,被稱為穀氨酸釋放“熱點”(hotspot)區域。通過向小鼠大腦切片內注射病毒載體,研究者在小鼠星形膠質細胞中特異性敲除了囊泡穀氨酸轉運體1(vesicular glutamate transporter 1, VGLUT1)。實驗發現,敲除VGLUT1後無法在“熱點”區域觀察到CNO誘發的穀氨酸遞質釋放,證明星形膠質細胞遞質釋放是由胞吐作用介導的。

上述實驗是在體外進行的,為了證實星形膠質細胞遞質釋放過程能在體內發生,研究者打開小鼠顱骨,使用雙光子共聚焦顯微鏡觀察清醒小鼠初級視覺皮層內的穀氨酸釋放。在未加藥物刺激時,他們記錄到了內源性星形膠質細胞穀氨酸釋放信號,説明星形膠質細胞能夠感知自然狀態下細胞外間隙中的穀氨酸濃度波動。在CNO的刺激下,星形膠質細胞穀氨酸釋放頻率顯著增加。
此外,研究者還進行了功能實驗,證明VGLUT1依賴的星形膠質細胞遞質釋放對急性癲癇發作具有保護作用;而VGLUT2依賴的星形膠質細胞信號通路具有調節黑質-紋狀體迴路的功能,是帕金森病的潛在治療靶點。
沃爾泰拉團隊通過單細胞測序技術找出了能釋放穀氨酸的星形膠質細胞的分子特徵,又通過體內和體外實驗直接觀察到了星形膠質細胞遞質釋放過程,還用功能學實驗展示了星形膠質細胞遞質釋放在神經疾病中的潛在保護作用。星形膠質細胞的電傳導功能領域,終於迎來了一錘定音的證據。同時,研究結果也為過去三十多年相互矛盾的研究提供瞭解釋。由於僅特定亞羣的星形膠質細胞能夠釋放穀氨酸,既往研究得出的結論是與星形膠質細胞的取材密切相關的:如果研究者使用的星形膠質細胞並非該特定亞羣,就無法觀察到穀氨酸釋放。

在接受採訪時,沃爾泰拉表示:“我們是正確的,確實存在能釋放穀氨酸的星形膠質細胞。但我們也是錯誤的,因為我們原以為所有星形膠質細胞都能釋放穀氨酸。”[13]英國倫敦大學學院(University College London)的神經科學教授德米利特·盧薩科夫(Dimitri Rusakov)對此評論道:“幾乎可以肯定地説,這些發現顛覆了目前學界對大腦信號傳導方式的理解,但具體是以何種方式顛覆,仍是一個開放性問題。”
04
好的研究會帶來更多問題
證實星形膠質細胞能釋放穀氨酸遞質僅僅是第一步,未來仍有許多問題等待我們解答。星形膠質細胞釋放的穀氨酸遞質對神經突觸有何影響?哪些大腦功能需要星形膠質細胞的參與?為何大腦中只有特定區域富含穀氨酸能星形膠質細胞?
當然,要回答這些問題也有一些技術層面的問題要解決——如何更好地標記星形膠質細胞。理想的星形膠質細胞標記物(分子)應該是穩定的,能夠特異性標記該類細胞,且在每個細胞中表達水平相似。現有的標記物都有各自的不足,比如GFAP(參與細胞骨架組裝的蛋白)在不同細胞間的表達水平差異較大,且在疾病或損傷狀態下表達水平會發生劇烈變化。而ALDH1L1(一種代謝酶)表達水平相對穩定但非常低,難以通過免疫熒光/免疫組化方式進行檢測,且該蛋白在肝臟細胞內也有較高的表達水平。完美的細胞特異性標記物的缺乏,給星形膠質細胞的研究帶來了較大的阻礙。
一項卓越的科學研究,在解答問題的同時,也會引發無數新的疑問。數量龐大的星形膠質細胞藴含了無限可能性,吸引了一批批科學家投身其中。正如盧薩科夫所説,“我們已經積累了大量的證據,現在需要的是一個能將所有證據整合到一起的理論。”
參考文獻
[1] Virchow, R. (1856). Gesammelte Abhandlungen zur Wissenschaftlichen Medizin. Meidinger Sohn & Co.
[2] 吳江等.《神經病學》,人民衞生出版社,2015年6月第3版
[3] Golgi, C. (1871). Contribuzione alla fina Anatomia Degli Organi Centrali del Sistema Nervosos. Tipi Fava e Garagnani.
[4] Hasel, P. (2021). Astrocytes. Current Biology, 31(7):R326-R327.
[5] Wu, Z. (2020). Gene therapy conversion of striatal astrocytes into GABAergic neurons in mouse models of Huntington’s disease. Nature Communications, 27;11(1):1105.
[6] Wang, LL. (2021). Revisiting astrocyte to neuron conversion with lineage tracing in vivo. Cell, 184(21):5465-5481.e16.
[7] Cornell-Bell, AH. (1990). Glutamate induces calcium waves in cultured astrocytes: long-range glial signaling. Science, 247(4941):470-3.
[8] Parpura, V. (1994). Glutamate-mediated astrocyte–neuron signalling. Nature, 369, 744–747.
[9] Pasti, L. (1997). Intracellular calcium oscillations in astrocytes: a highly plastic, bidirectional form of communication between neurons and astrocytes in situ. Journal of Neuroscience, 17(20):7817-30.
[10] Perea, G. (2009). Tripartite synapses: astrocytes process and control synaptic information. Trends in Neuroscience, 32(8):421-31.
[11] Sloan, SA. (2014). Looks can be deceiving: reconsidering the evidence for gliotransmission. Neuron, 17;84(6):1112-5.
[12] de Ceglia, R. (2023). Specialized astrocytes mediate glutamatergic gliotransmission in the CNS. Nature, 622(7981), 120-129.
[13] https://www.quantamagazine.org/these-cells-spark-electricity-in-the-brain-theyre-not-neurons-20231018/
本文受科普中國·星空計劃項目扶持
出品:中國科協科普部
監製:中國科學技術出版社有限公司、北京中科星河文化傳媒有限公司

1. 進入『返樸』微信公眾號底部菜單“精品專欄“,可查閲不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關注公眾號,回覆四位數組成的年份+月份,如“1903”,可獲取2019年3月的文章索引,以此類推。
版權説明:歡迎個人轉發,任何形式的媒體或機構未經授權,不得轉載和摘編。轉載授權請在「返樸」微信公眾號內聯繫後台。