4.7萬人,都在等着換腰子_風聞
地球知识局-地球知识局官方账号-人文+地理+设计=全球视野新三观1小时前
十多年前,一位年輕人賣掉自己一側腎臟,只為買一部當時最新款的iPhone手機,讓iPhone有了“腎機”的外號,這是網絡上早期關於“噶腰子”的記憶。
原來如此▼
從去年開始,網傳在東南亞某些國家有被噶腰子的風險,據説這些地方有一條完整的噶腰子的產業鏈,這讓“噶腰子”一詞在全網再次有了不小的熱度。
但從醫學的角度來説,腎臟由於血供簡單,成為了器官移植最早選擇的對象。要了解腎臟移植,我們首先要對腎臟的結構和功能有所瞭解。
腎在這呢(圖:shutterstock)▼
腎臟的結構及生理功能
腎臟是人體重要器官之一,是泌尿系統的一部分。人體共有兩個腎,因受肝的擠壓,右腎低於左腎約1-2cm。
左腎在第11胸椎椎體下緣至第2-3腰椎椎間盤之間,而右腎則在第12胸椎椎體上緣至第3腰椎椎體上緣之間。
大部分人腎臟血供極其簡單(不排除少數人解剖變異),僅由腎動脈及腎靜脈負責;但流經腎臟的血液量極大,可以佔到心臟輸出量的四分之一,是人體血流量最為充沛的器官之一。
切開了是這樣的(僅示意)▼
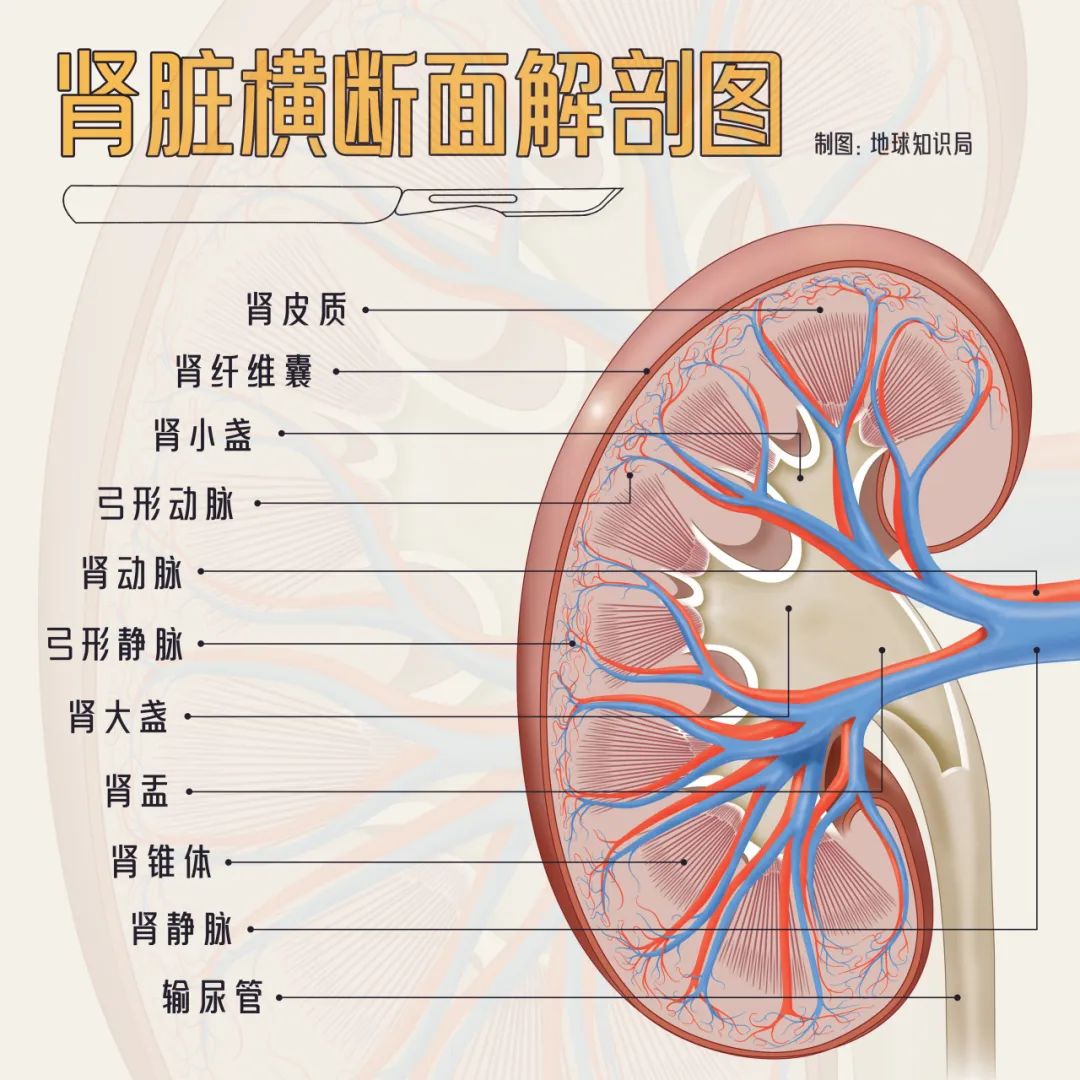
腎臟的主要生理功能是濾過血液,維持水、電解質平衡。執行濾過功能的基本結構是腎單位,包含腎小體以及腎小管兩部分,每側腎臟有100-200萬個腎單位。
腎動脈進入腎臟後,逐漸分支為腎小球毛細血管,血液流經此處時,血壓較高,有利於血漿中的水和小分子溶質進入腎小囊。
腎單位很細小(僅示意)▼
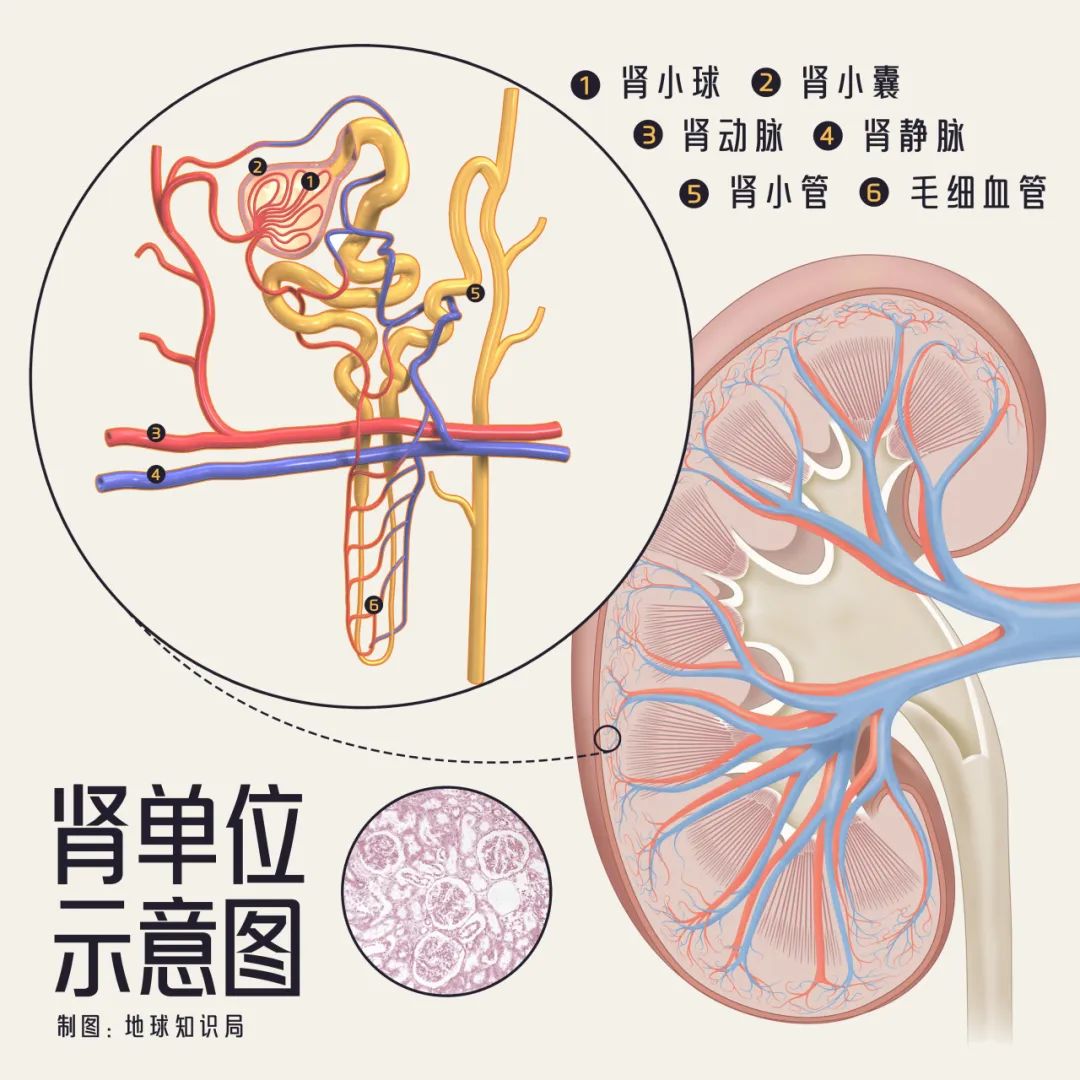
隨後,經過濾出的液體進入腎小管,在經歷了包括重吸收和排出等過程的多個步驟之後,最終轉化為尿液。這些尿液進入腎盞,然後流入膀胱。
腎小球濾液每分鐘約生成120mL超濾液(原尿),一晝夜總濾液量約170-180L。濾液經腎小管時,99%被重吸收。正常情況下,人體每24小時排出尿液1-2L,大於2.5L被稱為多尿,少於400ml為少尿;若少於100ml則屬於無尿。
腎小球內部(僅示意)▼
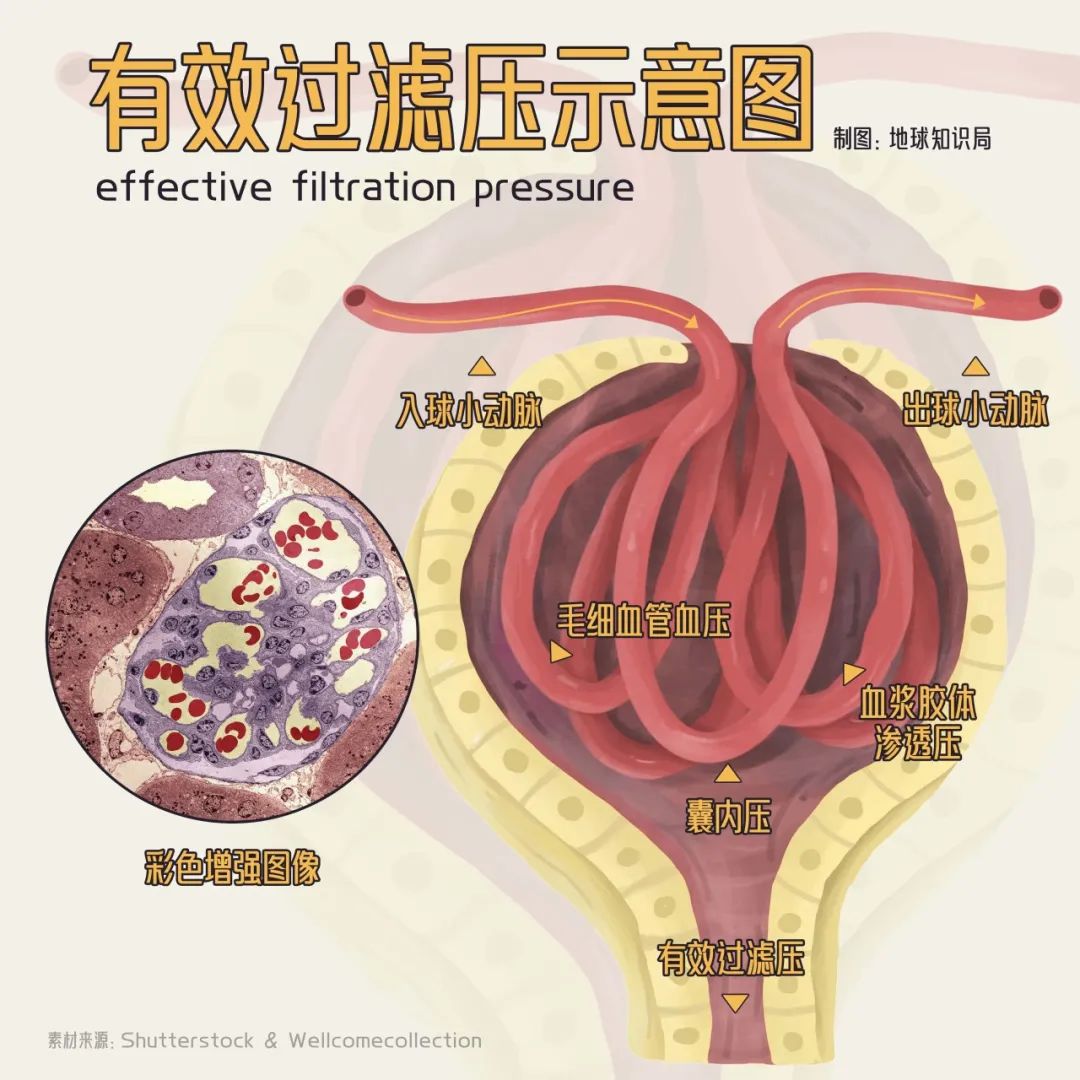
前文提到的腎小球是排出廢物的主要場所,因此腎小球濾過率(每分鐘兩側腎生成的超濾液量)也是臨牀上判斷腎功能的常用指標之一,數據下降預示着腎臟有疾病。
腎臟移植的歷史
前文説過,由於腎臟的血供比較單一,因此早在1902年,法國外科醫生亞歷克西斯·卡雷爾(Alexis Carrel)首創血管“三線縫合法”(三定點端-端吻合術)且在動物實驗中大獲成功後,外科醫生就開始嘗試腎臟移植。
從事研究的卡雷爾(圖:壹圖網)▼

同一年,奧地利醫生烏爾曼(Emerich Ulmann)首次成功完成了動物自體及異體腎移植。雖然實驗對象存活時間不長,但他用實踐證實了器官移植的可能性。
接下來,法國外科醫生賈佈雷(Mathieu Jaboulay)嘗試將豬腎移植到人體。由於當時技術尚不成熟,他們都選擇將腎臟移植在患者手肘部(此處手術比較容易實施)。
儘管在手術後的一兩天裏,移植的腎臟成功排出尿液,但由於很快形成了血栓,導致移植腎被迫摘除,患者也在手術後的3天內不幸去世。賈佈雷認為,移植失敗的原因是血管吻合技術不成熟導致的血栓形成。
1924年,某本醫學刊物上的插圖
(圖:gallica.bnf.fr)▼

3個月後,賈佈雷選擇了他認為血管質量更好的山羊腎臟作為供體,進行異種腎臟移植手術,但與第一次的結果一樣,血栓很快形成,患者也在幾天內死亡。
此後,德國醫生昂格爾開展了人與其它靈長類動物之間的異種腎臟移植,雖然沒觀察到血栓形成,但移植腎還是沒能存活。
昂格爾的手繪能力很強▼
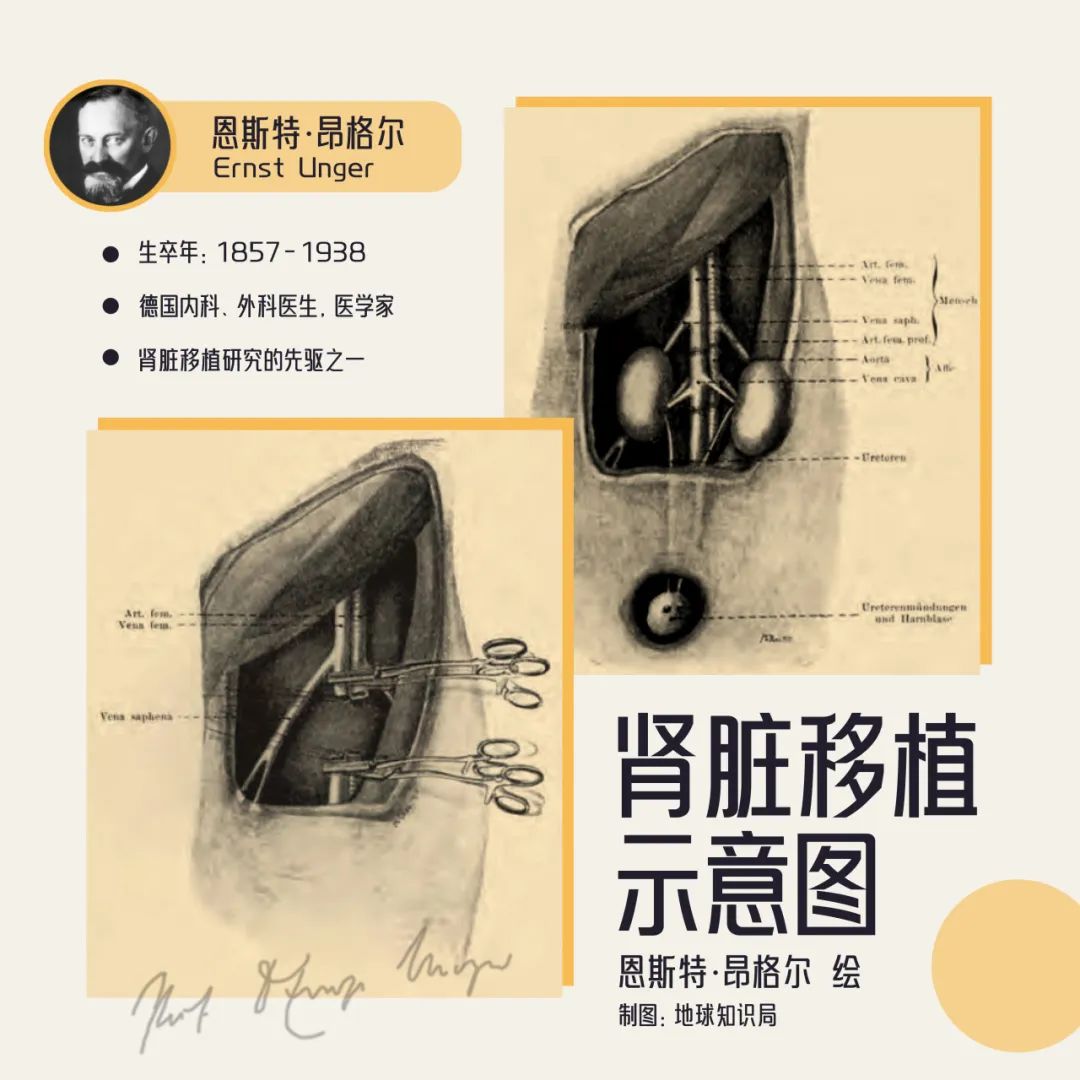
此後幾十年間,醫學界斷斷續續進行了多次異種腎臟移植。20世紀60年代初,美國雷姆斯馬團隊進行了一系列黑猩猩-人之間的腎臟移植試驗,術後生存時間最長的患者存活了9個月。
但是,大多數患者在移植手術後很快死亡,這讓彼時的研究者們認識到,異種腎臟移植不僅效果很難達到預期,而且存在動物倫理、供體數量等限制。更危險的是,不同靈長類動物間還存在未知病毒傳播的風險。
目前認為,人免疫缺陷病毒(艾滋病病毒)
就是由猴免疫缺陷病毒演化而來
(圖:NIAID)▼
最終,異種腎臟移植,尤其是非人靈長類動物腎臟移植在上世紀60年代以後逐漸被放棄。醫學界轉向了更可行和安全的同種腎臟移植。
早在1933年,蘇聯外科醫生沃羅諾伊(Yurii Voronoy)開展了首例同種腎移植,但由於血型不符,患者很快死去。
同一時期,學界已經發現了免疫排斥現象,特別是英國生物學家梅達瓦(Peter Brian Medawar)證實了“獲得性免疫耐受”。
工作中的梅達瓦(圖:壹圖網)▼

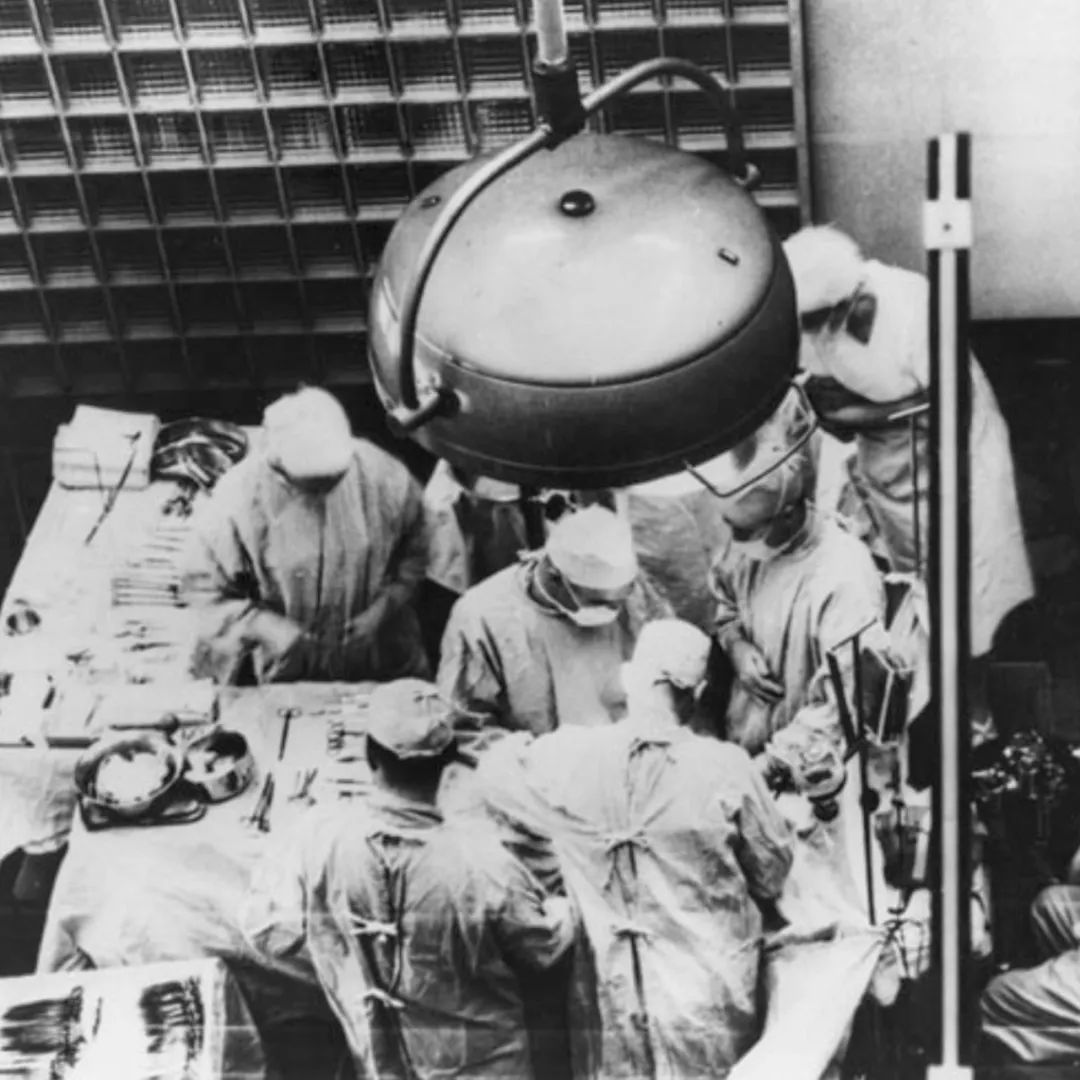
在1954年,美國哈佛大學的默裏(Joseph Murray)醫生為一對同卵孿生兄弟成功地進行了腎臟移植手術,術後患者以及移植的腎臟均能夠長期存活。
這是人類歷史上第一次成功的腎臟移植,同時也是人類歷史上第一次成功的活體器官移植。
照片記錄了這場手術的情景
(圖:Harvard University)▼
50-60年代,隨着巰唑嘌呤、環磷酰胺等免疫抑制劑相繼問世,也為非同卵雙胞胎間的器官移植打開大門。
1959年,默裏為一對異卵雙胞胎實施腎移植,患者術後接受了免疫抑制治療,移植腎同樣得到長時間存活。
1962年,默裏醫生又在非雙胞胎之間進行了腎臟移植,同樣在使用免疫抑制治療後,受體及移植腎得到長時間的存活。
這一系列突破性的成就為後來的器官移植手術奠定了基礎,併為醫學界開闢了新的治療領域。默裏也在1990年獲得了諾貝爾生理學或醫學獎。
在醫學的道路上,不斷探索▼

我國在1972年,由中山醫學院第一附屬醫院的梅驊教授與北京友誼醫院於惠元教授和侯宗昌教授合作,成功地完成了第一例活體親屬腎移植。
腎臟移植的未來
儘管每個人均擁有雙側腎臟,且腎臟具備不俗的代償機制,然而,若忽視健康維護,腎臟生理功能將不可避免地會隨時間推移而逐漸歸於耗竭。
許多造成腎病的危險因素,包括高血壓、高血糖、腎結石、吸煙、飲酒、肥胖、感染等,離我們並不遙遠。
掃描電子顯微鏡下的腎結石,後期上色
(圖:wellcomecollection)▼

目前最常用的腎功能評價如下:
1期:已有腎病,腎小球濾過率>90毫升/分鐘。
2期:腎小球濾過率60-90毫升/分鐘。
3期:腎小球濾過率35-60毫升/分鐘。
4期:腎小球濾過率15-30毫升/分鐘,腎功能衰竭期。
5期 :腎小球濾過率<15毫升/分鐘,尿毒症期。
據統計,在2017年,全球共有約6.97億例慢性腎臟病,其中三分之一生活在中國(1.32億)和印度(1.15億)。其中約有120萬人死亡,另有140萬心血管疾病死亡患者可同時歸因於腎臟病。
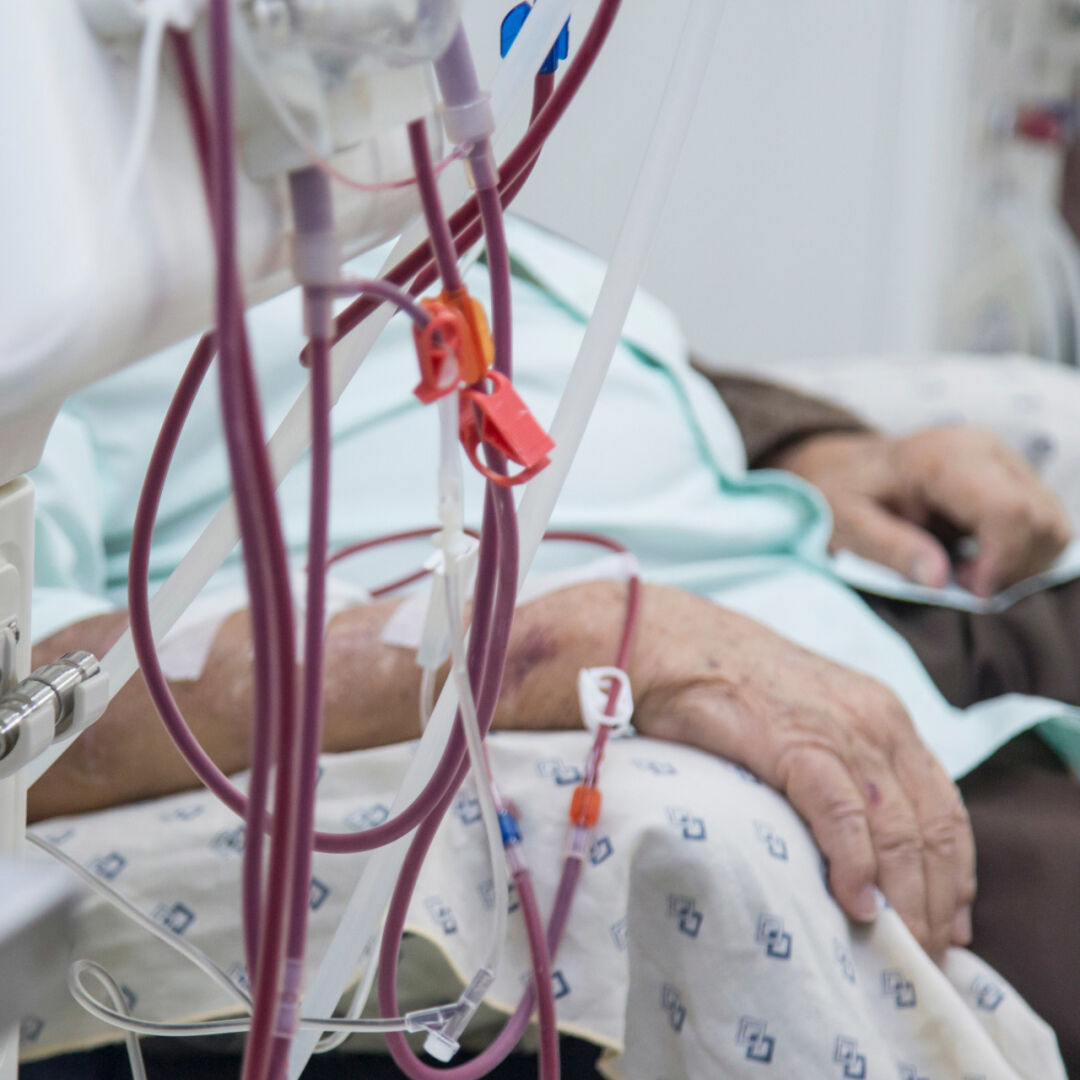
目前,絕大多數終末期腎臟病患者都是通過透析治療,但透析是通過機器代替腎臟的功能淨化血液,並不能治癒腎衰竭;患者需要定期入院接受治療,對於許多患者來説是一項不小的負擔。
血液透析進行中(圖:shutterstock)▼
因此一方面,腎臟移植已經成為挽救終末期腎臟衰竭患者的成熟可靠的醫療手段,我國腎臟移植的1年、3年受者生存率分別為96.7%、95.6%,多數中心移植腎5年存活率都能超過90%,患者預後好。
另一方面,2015年至2018年,我國每年完成器官捐獻分別為2766、4080、5146、6302例。但同時,截至2019年底,全國仍有47382人等待腎移植。
自2015年1月1日起,公民自願器官捐獻成為我國器官移植唯一合法來源。現在腎臟供體來源主要有活體及屍體兩種,2019年全國腎臟移植受者共12124例(活體1735例),但每年開展的腎移植數量遠遠比不上新增透析例數。
腎移植不是更換,而是添加
即不取出患者原本無功能的腎
而是直接將供體腎臟移植進患者體內
(圖:壹圖網)▼
因此全球不僅在鼓勵公民加入器官捐獻中,也在研究新的方法。
就比如在2021年,美國紐約大學的科研人員將一隻經過基因編輯的豬腎臟移植到一名腎衰竭同時腦死亡患者身上。在隨後幾天時間裏,移植的腎臟工作良好,未出現免疫排斥反應,患者體內各項指標也轉為正常。
就在前不久,該研究中心再次進行豬腎移植試驗,在手術後32天,這顆豬腎依然能夠正常工作,產生尿液且清除肌酐。
將豬腎臟移植到人體(圖:aamc.org)▼
和去年的“豬心移植”一樣,動物來源器官無疑會解決器官供體不足等問題;但在該技術全面落地之前,還會面臨更多的醫學及倫理問題。
腎功能不全、腎衰竭並不罕見,但我們有理由相信,隨着科技的進步,腎衰竭終究可以被攻克。但我們依然不能忽視最為關鍵的一點,那就是過上健康的生活,保護好自己的身體。
參考資料:
1. Matevossian, E., Kern, H., Hüser, N., Doll, D., Snopok, Y., Nährig, J., Altomonte, J., Sinicina, I., Friess, H., & Thorban, S. (2009). Surgeon Yurii Voronoy (1895-1961) - a pioneer in the history of clinical transplantation: in memoriam at the 75th anniversary of the first human kidney transplantation. Transplant international : official journal of the European Society for Organ Transplantation, 22(12), 1132–1139.https://doi.org/10.1111/j.1432-2277.2009.00986.x
2. GBD Chronic Kidney Disease Collaboration (2020). Global, regional, and national burden of chronic kidney disease, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet (London, England), 395(10225), 709–733. https://doi.org/10.1016/S0140-6736(20)30045-3.
3. 腎移植的“前世今生”. 復旦大學附屬中山醫院腎移植髮布.
4. 器官移植髮展史|異種臨牀腎移植的探索之路. 中華器官移植雜誌 2022-12-30 20:41發佈.
5. 首例豬腎移植人體,邁出異種移植的一大步. 科普中國發布.