為子宮裏的胎兒做器官移植,夢想距現實還有多遠?_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。1小时前
長遠目標,是將豬胎兒的腎臟移植給患有波特綜合徵的人類胎兒。
**撰文 |**黃思宇
日本科學家團隊近日進行了一次特殊的器官移植實驗,把一隻大鼠胎兒的腎組織移植給了另一隻大鼠胎兒。
儘管距離臨牀應用仍有距離。但國內母胎醫學專家指出,這次實驗成功令人興奮,意味着宮內治療的疾病譜有望進一步拓展。
本次實驗還發現,受體胎兒的血管在移植腎臟內生長,有國外專家指出,這意味着克服了移植後的免疫排斥問題。研究者本人表示,目前他正在進行豬到猴的宮內移植實驗,長遠目標是將豬胎兒的腎臟移植給人類胎兒。
綠色發光的腎臟
成功完成上述實驗的是東京慈惠會醫科大學腎臟病學家Takashi Yokoo的團隊,研究成果發表在預印本平台bioRxiv上。《自然》網站報道稱,這是首次子宮內的器官和組織移植。
促使這些科學家挑戰宮內器官移植的,是一種名為波特綜合徵(Potter Syndrome)的罕見疾病,胎兒腎臟完全缺失或嚴重畸形(發育不良),從而導致孕期羊水量減少,而羊水對胎兒肺器官發育至關重要,肺得不到充分發育,嬰兒出生時或出生後不久就會死亡。
波特綜合徵目前仍無法治癒。由於可以通過產前診斷髮現,醫生通常會建議波特綜合徵患兒的母親提前終止妊娠。而如果能在宮內就進行腎移植,讓胎兒擁有功能健全的雙腎,就可以避免之後的一系列連鎖反應,挽救胎兒的生命。帶着這個想法,Takashi Yokoo和同事行動起來。
用於移植的腎組織非常微小,為了便於追蹤,Takashi Yokoo團隊首先對大鼠進行了基因修飾,讓它們的腎臟表達一種綠色熒光蛋白。隨後,他們將綠色的腎組織從大鼠胎兒體內提取出來,用一根細針將其插入僅18天大、還在母親子宮內的幾隻大鼠胎兒背部皮下。共有來自4只大鼠母親的9個胎兒接受了移植手術,其中8個胎兒長出了綠色發光的腎臟。Takashi Yokoo解釋稱,腎臟組織可能未在移植失敗的那個胎兒中定植。
大約22天大(大鼠的正常孕期)時,接受移植的幾隻大鼠幼崽順利出生。出生後,它們皮下的腎組織漸漸發育,形成了廢物過濾單位(即腎小球)和層次分明的腎臟外部與內部結構。兩週半以後,這些腎臟開始產生尿液。Takashi Yokoo表示,他們原本預計,這些腎臟的發育時間線和正常發育幾乎相同。但由於移植的腎臟沒有和輸尿管相連,尿液無處可去,研究者不斷對腎臟進行引流,直到這些大鼠在五個月大左右時被處以安樂死。
實驗成功意味着什麼?
“這次大鼠實驗的成功令人興奮,意味着宮內治療的疾病譜有望進一步拓展。”上海市第一婦嬰保健院胎兒醫學科主任、產前診斷中心執行主任孫路明告訴“醫學界”。
孫路明長期從事母胎醫學的臨牀診療與研究,是國內最早規範開展宮內治療的胎兒醫學專家之一,也是中國首位在北美完成母胎醫學臨牀規培的醫生,並在國內率先建立與國際接軌的胎兒醫學中心。
她告訴“醫學界”,早年宮內手術是開放性的,對孕產婦的創傷比較大。近年來,隨着胎兒鏡等介入技術發展,宮內治療大多數以微創方式進行,治療範圍也進一步拓展,目前在我國已開展的胎兒宮內手術包括胎兒鏡下胎盤血管電凝術治療雙胎輸血綜合徵、胎兒鏡下嚴重先天性膈疝介入手術、胎兒先天性心臟病的宮內介入手術、各種選擇性減胎技術等。
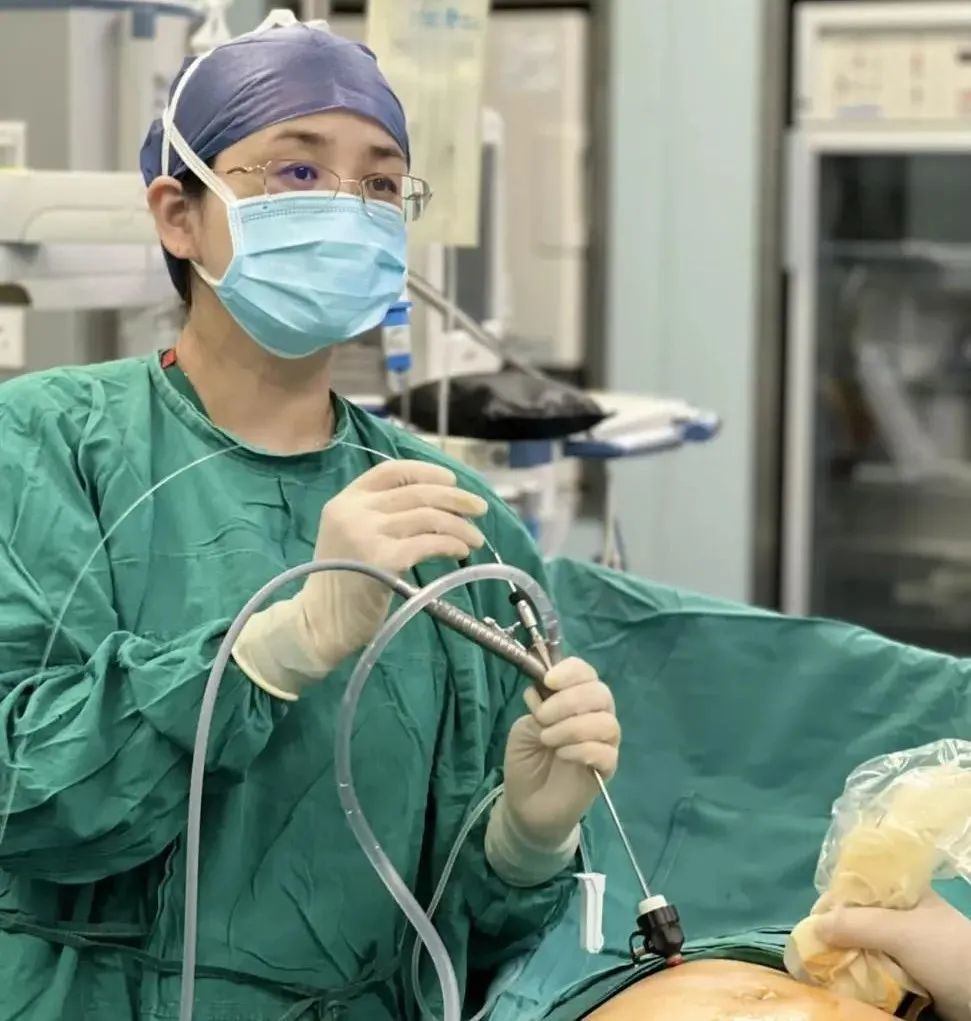
孫路明教授進行微創宮內手術(受訪者供圖)
孫路明介紹,宮內手術對指徵有嚴格把握,需要基於準確的產前診斷、有精確的分期或嚴重程度的分級、熟悉胎兒疾病的自然病程、動物模型證實手術確為可行,且目前確無有效的產後治療方法。上述宮內腎移植致力解決的波特綜合徵屬於這一類疾病。
不過,她也特別強調,對於宮內腎移植這樣的突破性、探索性技術,未來若要應用於臨牀,手術必須在胎兒醫學中心進行,多學科參與,需要經過充分的倫理討論,告知家屬宮內手術可能帶來的母胎風險。
“宮內治療的目的不僅僅是提高患病胎兒出生後存活率,更強調確保產婦的安全和健康,注重降低患兒的發病率和改善兒童的遠期預後。如果患兒通過宮內手術存活下來,但長期的生活質量不好,仍會給患兒本人及其家庭帶來沉重、長久的負擔。”孫路明説。
孫路明認為,未來宮內治療的範圍還有望拓展到先天性遺傳罕見病的基因及幹細胞治療,例如已有基因療法的脊髓性肌萎縮(SMA)、成骨不全症(俗稱“脆骨病”),以及酶替代療法治療溶酶體貯積症等內分泌遺傳代謝病。隨着新的診斷及治療技術快速發展,越來越多的先天性疾病未來有望在宮內得到救治,以提高患兒的存活率及遠期生命質量。
但孫路明指出,宮內治療在國內雖然已經過十多年發展,但仍屬於新興技術,開展時要遵循“規範先行,制度先行,培訓先行”。隨着宮內治療覆蓋的疾病範圍越來越廣,更需要新生兒科、小兒內外科、遺傳科等各專業的醫生參與,形成多學科診療團隊。
“如果要在臨牀上開展宮內腎移植,無疑需要更多學科的專家參與前期研究。”孫路明説。
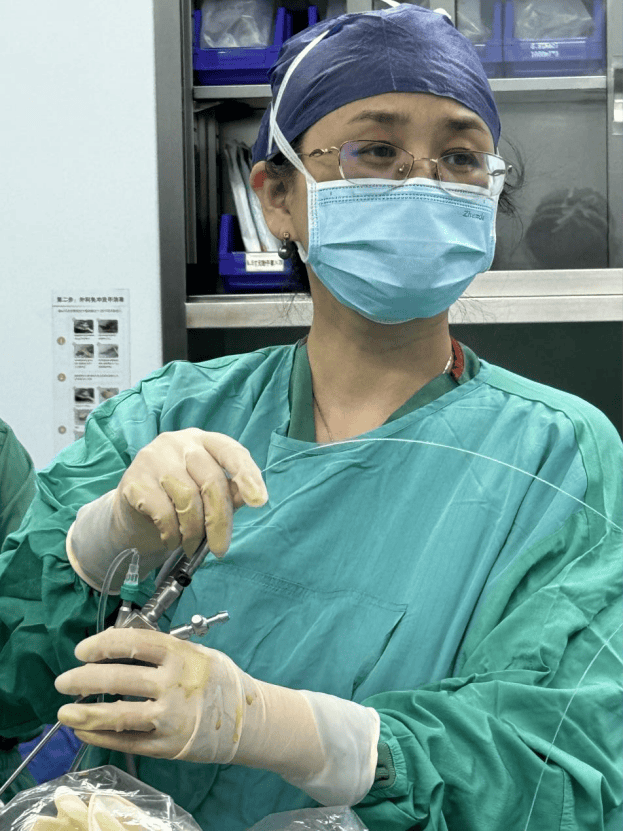
孫路明教授為患者手術中(受訪者供圖)
有望解決異種器官移植排異難題?
“器官移植排異的一大原因就是供體血管和受體血管不相容,在本案例中,受體正在‘滲透進’移植的器官,你們克服了這一難題。這真的非常棒。”澳大利亞瑪塔母親醫院(Mater Mothers’ Hospital)的胎兒外科專家Glenn Gardener對本次實驗點評道。
近距離觀察可以看到,胎兒的血管在供體組織內部生長,意味着這些腎臟被免疫系統排斥的可能性減小。Takashi Yokoo表示,他的長遠目標是將豬胎兒的腎臟移植給波特綜合徵患兒。
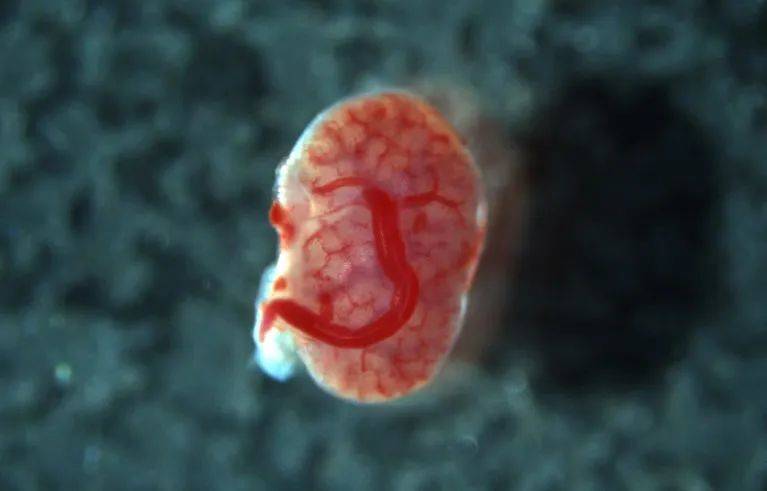
受體血管“滲透進”移植腎臟(圖源:K. Morimoto et al./bioRxiv)
為了測試異種器官移植的可能性,Takashi Yokoo還將小鼠的腎組織移植進大鼠胎兒體內,在4只大鼠身上獲得了成功。腎臟在移植後的10天內不斷髮育,而且沒有受到排斥。移植第18天時,腎組織出現了排異跡象,但排異可以通過免疫抑制劑緩解。
Takashi Yokoo表示,他還對11只豬的38個豬胎兒進行了豬對豬的宮內移植,18只豬崽順利出生,但研究成果尚未發表。目前,他正在狨猴身上進行豬到猴的宮內移植實驗,並且計劃在幾個月內開始對食蟹猴進行實驗。
近年來,科學家多次嘗試異種器官移植,已成功實施全球首例豬心、豬肝、豬腎人體移植手術。全球首例豬器官人體移植手術的紀錄誕生於2022年1月,美國馬里蘭大學醫學中心為一名57歲的終末期心衰患者移植了一顆豬心。這顆豬心經過了基因編輯,目的是使其適應人體,減少排異反應。然而,患者仍在術後兩個月後死亡。根據研究團隊後來發佈於《柳葉刀》《新英格蘭醫學雜誌》的分析報告,可能的死因之一就是排異反應。
本次實驗成功後,Takashi Yokoo稱,胎兒時期的組織產生免疫反應的可能性低於成人組織,意味着不需要在移植前進行基因修飾就可以杜絕免疫排斥。
不過,Glenn Gardener、約翰斯·霍普金斯大學胎兒介入專家Ahmet Baschat等專家均指出,雖然大鼠實驗的結果令人震撼,是一個很棒的概念,但距離應用於人類仍有遙遠的距離。
Takashi Yokoo則表示,他已經開始和公眾交涉,告訴他們人類胎兒異種移植的優勢,嘗試獲得他們的信任。他還計劃向所在大學和醫院的倫理委員會,以及日本的監管機構申請開展人體研究。
專家簡介

孫路明
醫學博士,主任醫師,教授,博士研究生導師。上海市第一婦嬰保健院胎兒醫學科主任兼產前診斷中心執行主任。完成加拿大母胎醫學臨牀專科醫生正規培訓,美國超聲診斷醫學註冊協會(ARDMS)婦產科超聲及胎兒心超認證。專業協會任職:國際婦產聯盟(FIGO)母嬰健康安全委員會委員;國家衞健委產前診斷專家組成員;中華醫學會圍產分會胎兒醫學學組副組長;中華預防醫學會出生缺陷預防與控制專業委員會常委;中國醫師協會醫學遺傳醫師分會委員;上海預防醫學會出生缺陷防控專委會主委;上海醫學會胎兒醫學及宮內兒科專委會副主委;《母胎醫學雜誌(英文)》副總編輯;《中國產前診斷雜誌》編輯部主任。
參考文獻:
[1]https://www.biorxiv.org/content/10.1101/2024.04.15.589452v1
[2]https://www.nature.com/articles/d41586-024-01152-y
[3]https://my.clevelandclinic.org/health/diseases/23584-potter-syndrome