全球首個!皮膚癌專家“自創療法”治腦癌_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。46分钟前
在傳統綜合治療基礎上,提出聯合新輔助免疫檢查點阻斷、腫瘤疫苗接種等思路,能激活患者的免疫微環境。我國也在開展類似研究,成果顯著。
**撰文 |**燕小六
2023年5月,知名黑色素瘤病理學家理查德·斯科萊爾(Richard Scolyer)被確診出腦膠質母細胞瘤(GBM)。病理顯示是預後最差的一種亞型,現有的標準治療方案效果不佳,中位生存期約14個月。
理查德決定“放手一搏”:拿自己做試驗,觀察黑色素瘤創新治療思路能否轉化到GBM治療中。“創新”體現在多方面,包括活檢後儘早啓動免疫治療,先做多靶點的免疫檢查點阻斷再做手術切除,術後聯合腫瘤疫苗接種等。
當地時間2024年4月29日,Nature Portfolio收到以理查德為“零號病人”撰寫的預印版文章。文章稱,這是全球首次在新診斷的GBM患者中嘗試前述治理思路,它證實了切除術前進行免疫治療的可行性。
復旦大學附屬華山醫院神經外科研究所免疫室主任、腦膠質瘤外科中心副組長姚瑜讀了相關文章。他告訴“醫學界”,該文在手術切除+放療的標準治療基礎上,提出聯合多種免疫治療手段,從不同層面激活GBM患者的免疫微環境。我國也在開展類似研究,成果顯著。
“GBM已經19年沒有新的治療方案問世。僵局亟待打破。”澳大利亞廣播公司報道,理查德和診療團隊已遞交申請,將啓動基於前述方案的全球首個臨牀研究。

理查德·斯科萊爾(Richard Scolyer,左三)和同事在澳大利亞黑色素瘤研究所門前合影。圖源/Melanoma Institute Australia
應戰“不好的預感”
理查德在腫瘤診療領域聲名赫赫。他是澳大利亞黑色素瘤研究所(MIA)聯合主席,《世界衞生組織皮膚腫瘤分類(2018年)》作者之一。
2023年,他獲得國際病理學會澳大利亞分區“年度傑出病理學家獎”。就在頒獎前夕,理查德突發癲癇被送入急診,經開顱活檢被確診為原發性GBM。
GBM是一種致死率極高的腦腫瘤。新診斷患者的標準治療方案是手術加輔助放化療等。但多數患者對此不敏感,複發率近100%,5年生存率不足5%。“急需尋找一種更有效的治療思路。”《國際神經病學神經外科學雜誌》2023年6月文章形容。
理查德和MIA的同事們商討後,決定以他為唯一對象,開啓一場“前所未有”的GBM治療嘗試。
活檢明確病理後,理查德先做了1個週期的三聯免疫檢查點阻斷(ICI)治療。12天后,完成GBM切除術。再接着,他做了局部放療,又經歷單藥免疫治療、糾正免疫不良反應後繼續接受多聯ICI,以及4次個體化腫瘤疫苗接種。
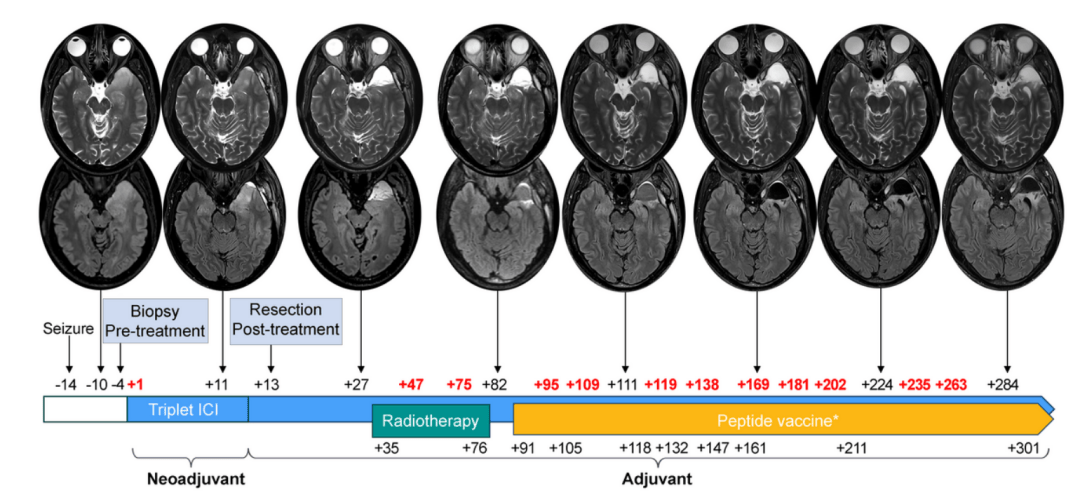
圖源/Nature Portfolio
姚瑜告訴“醫學界”,相較於標準治療,理查德的治療過程確實有多處不同。
第一,他的手術被分成兩步,先是像皮膚黑色素瘤那樣做一個活檢,通過病理確認是GBM後再行手術切除。“但按照我們臨牀實踐經驗,結合多種影像學特徵等高度懷疑GBM後,一般是直接手術。並且,術中冰凍確認是腫瘤後,做安全範圍內最大程度的切除術。”姚瑜説,針對佔位效應特別明顯的膠質瘤,手術需要及時快速開展,以最大程度地降低腫瘤負荷。
理查德曾解釋自己的選擇是“因為有不好的預感”。放棄常用的立體定向穿刺、選用創傷較大的開顱手術取樣,是希望獲得更多的組織樣本,能進行更詳盡的病理分析。
結果如他所料。理查德的腫瘤屬WHO Ⅳ級、IDH野生型、MGMT未甲基化,幾乎是GBM中預後最差的一類。但也有好消息:經過三聯ICI後,組織內多處免疫細胞都有10倍以上增加,提示腫瘤微環境明顯改變!
這歸功於理查德診療方案的第二個不同,即在手術切除病灶前,進行PD-1、LAG-3、CTLA-4等3個免疫檢查點阻斷治療。這裏用到3種免疫治療藥物,目的是激活免疫系統,增強其殺滅癌細胞的能力。
姚瑜介紹,在理查德之前,這種先免疫治療再行手術的“新輔助治療”思路,在復發患者的臨牀研究裏用過,且只使用1種免疫藥物。可見,理查德使用ICI的時間更早、數量更多。
有學者表示擔憂。澳大利亞廣播公司援引分析稱:“腦腫瘤進展很快,推遲手術一兩週就可能導致患者失去手術機會。而且,多個免疫治療藥物聯用會加劇腦腫脹等不良反應,患者可能立即死亡。”
前述預印版文章重點討論了三聯ICI的安全性、有效性。姚瑜認為,文章是想通過理查德的個案,説明部分GBM患者能耐受三聯ICI,以及這有助於豐富腫瘤的免疫微環境、助力治療。
圖源/Richard Scolyer
更重要的或是個體化疫苗
在2023年10月召開的歐洲腫瘤內科學會年會上,理查德的好友、同事兼診療團隊負責人喬治娜·朗(Georgina Long)在主會場做專題發言,介紹理查德截至當時的治療情況。
“敢這麼做,是因為我們在黑色素瘤診療中驗證過相關思路。”喬治娜介紹,一方面,針對黑色素瘤的SWOG 1801研究顯示,僅僅是將新輔助治療向前挪3個週期,就能將患者在術後2年的無事件生存率提高近20%。另一方面,不同免疫源性的腫瘤存在免疫優化策略,有時雙藥免疫治療就是優於單藥。
當地時間2024年5月14日,理查德通過社交媒體宣佈,治療近1年後,自己病情穩定、未檢出GBM復發跡象。他表示,自己留取了寶貴的生物樣本,包括新輔助治療前後的腦腫瘤樣本,整個治療過程中的血、糞樣本,以及腦脊液樣本等,未來會進行更詳細的轉化研究。
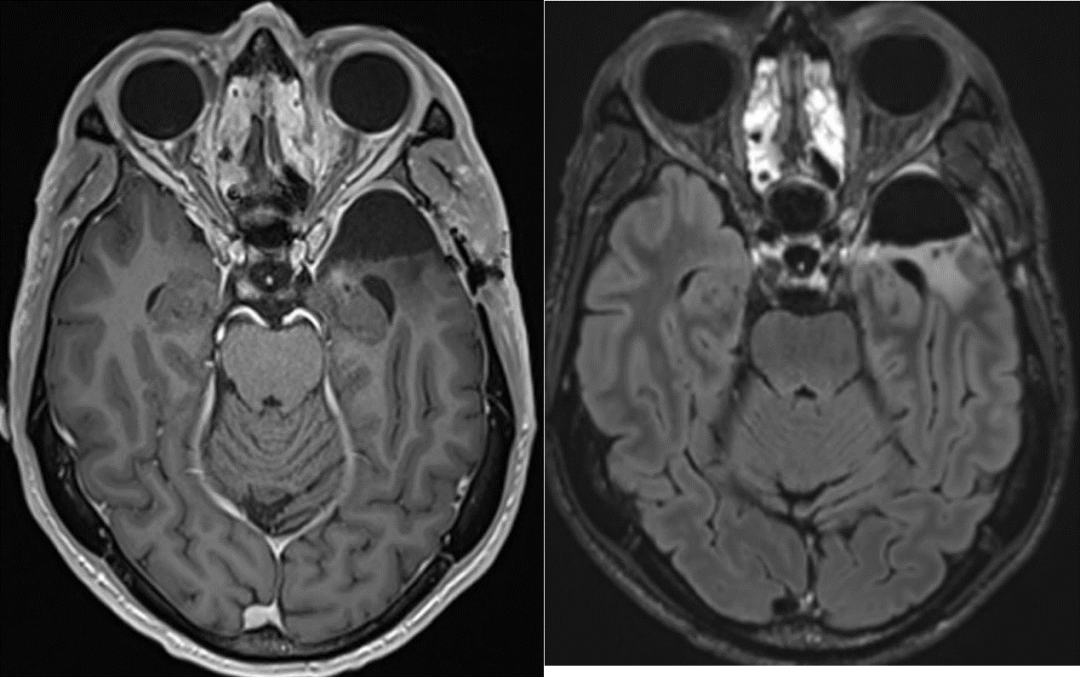
2024年3月19日,理查德·斯科萊爾在個人社交媒體發佈了治療10個月後的腦部複查結果。/Richard Scolyer
“這個生存期不算很驚奇。”姚瑜告訴“醫學界”,理查德的腫瘤集中在左側顳葉,最終切除範圍有限。而按照華山醫院的手術理念,同類病情者一般會做更大範圍切除,聯合放療,生存期10個月以上是很常見的。
姚瑜更關心預印版文章一筆帶過的“4次個體化腫瘤疫苗接種”。“這是他的第3個治療特點,即在新輔助免疫治療基礎上,使用個體化的腫瘤疫苗。包括我們中心在內,有研究發現單藥免疫治療改善患者的總生存期有限,加用腫瘤疫苗才是誘導特異性免疫反應的關鍵。”
腫瘤疫苗取材於人體自身免疫細胞,經體外培養和抗原誘導激活,使其數量成千倍增多、增強靶向性殺傷功能,然後回輸到人體,以增強機體的免疫能力。“這就像接種新冠疫苗、產生抗體一樣。腫瘤細胞只要冒出一些苗頭,免疫細胞就能滅掉它們。”姚瑜介紹。
根據姚瑜等編寫的《中國中樞神經系統膠質瘤免疫和靶向治療專家共識(第二版)》,相關技術包括肽疫苗、樹突狀細胞(DC)疫苗、腫瘤新抗原疫苗等。最近幾年,這一領域的好消息不斷。
姚瑜等華山醫院GBM團隊成員是我國最早開展DC疫苗研究的。在即將召開的2024年度美國臨牀腫瘤學會(ASCO)年會上,姚瑜等人將報告一項隨機、對照、雙盲研究:在復發Ⅳ級GBM患者中,採用升級版DC細胞聯合PD-1新輔助療法,能激活特異性免疫反應,達到控制腫瘤生長的目標。
“這和前文所説的情況相似。不同的是,他(理查德)是個案報告,我們已經完成更大樣本的臨牀對照研究。他採用了三聯ICI,我們只用了一個,副作用更小。”姚瑜介紹,在華山研究中,能觀察到非常神奇的特異性免疫反應,同時聯合各種創新技術,如抗原提取技術、新型佐劑技術、可視化技術、臨牀手術新技術等,惡性膠質瘤的預後大幅改善。

2024年1月,喬治娜·朗(Georgina Long,左一)和理查德被評選為“2024澳大利亞年度人物”。澳大利亞總理在頒獎典禮上盛讚二人的研究成果能挽救成千上萬生命。圖源/SydneyConnect Image
打破困境
Robert H. Lurie綜合癌症中心副主任羅傑·斯塔普(Roger Stupp)告訴媒體,理查德的情況令人鼓舞。免疫治療極有可能是改變GBM預後的新型治療方式。但現在要判斷這種療法是否有效,為時過早。
“理查德的生存期若達到18個月及以上,才稱得上‘具有臨牀意義’。”羅傑表示。他是國際著名的神經腫瘤學家,術後聯合放化療的GBM標準療法就是他於2005年提出的。
難點體現在多方面。首先,不論是免疫治療還是腫瘤疫苗研發,迄今都缺乏大樣本、支持實際療效的臨牀試驗結果。有的Ⅰ或Ⅱ期臨牀研究發現部分有效,有的Ⅲ期則認為無效。
原因之一或在於中樞神經系統存在血腦屏障這一特殊結構。這會阻止大多數抗腫瘤藥物或細胞進入大腦。GBM具有特殊的免疫抑制性質,也會天然地抑制或躲避機體的抗癌免疫反應。
同時,免疫療法要想起效,具有抗癌能力的免疫細胞必須進入腫瘤內部。但GBM患者的血管會發生功能失調,免疫細胞們難以抵達戰場。
其次,治療反應評估是個難題。早期進行免疫治療會導致炎症反應,或出現獨特的影像學改變,看起來像是疾病在進展。實際上,一部分患者仍可以獲得長期生存、腫瘤消退等臨牀獲益。據此,RNAO協作組制定“免疫療法RANO(iRANO)”來確定反應,防止接受免疫治療的GBM患者過早地被判斷為無反應者。
姚瑜告訴“醫學界”,在GBM賽道上,國內學者已經不僅僅是相關研究的跟隨者。“我們已經建立了中國自己的腦腫瘤免疫圖譜數據庫,擁有自己的免疫治療科研數據。在數據庫中,我們發現新的治療靶點,對GBM開創新的治療方式意義重大。此外,我國原創性地發現GBM的分子免疫逃逸新途徑和機制等,在國際上引起巨大反響。”
在姚瑜看來,針對惡性程度非常高的GBM,多聯ICI、腫瘤疫苗等都是有希望的免疫治療研究方向。他呼籲社會各界能多給醫院一些資源,以便開展更多維度的研究。“相較於肺癌、乳腺癌等,GBM的發病數較少,比較難獲得多個藥品支持,要開展多藥聯合研究存在難度。”
專家簡介

姚瑜
復旦大學附屬華山醫院神經外科主任醫師,博士生導師,師從周良輔院士;
華山醫院腦膠質瘤外科中心副組長,神經外科研究所免疫室主任;靜安區領軍人才;
科技部國家重點研發計劃“腫瘤治療性疫苗”課題負責人,成果入選SNO(2023年)ASCO(2024);
《中華醫學雜誌》編委(2023-)
國家基金委重大研發計劃和上海申康集團重大臨牀疑難攻關計劃首席科學家;
2018年王忠誠中國神經外科青年醫師獎青年醫師獎;
2016年首屆中國腫瘤青年科學家獎;
2021年度人民好醫生稱號(神經腫瘤);
2019-2021連續三年中國好大夫(神經外科);
2022年中央電視台(CCTV-1)在線大名醫:健康中國行動推進委員會辦公室/中國醫院協會頒發;
2018版和2020版中國中樞神經系統膠質瘤免疫和靶向治療共識制定專家組組長,中國中樞神經系統腫瘤免疫和靶向治療論壇執行主席;
中國生命關懷協會精準醫療與細胞治療專業委員會(二級學會)副主任委員;
《美國NCCN中樞神經系統腫瘤指南》翻譯專家委員會(中國)副主任;
美國癌症登月計劃(GBM AGILE)國際成員;Journal of Neuorology, Brain Pathology 審稿專家;
教育部研究生學位論文評審專家;2014-2017腫瘤科國家重點臨牀專科秘書;
國際神經外科聯盟(WFNS)教官;國家衞健委能力建設和繼續教育中心教官;
浙江大學校友會第三屆理事;浙江大學校友會醫藥分會常務理事;
訪學經歷:美國Beth Israel Deaconess Medical Center,美國Mayo Clinic,Dana-Farber癌症中心,MD Anderson癌症中心。
參考文獻:
1.Neoadjuvant Triplet Immune Checkpoint Blockade in Newly Diagnosed Glioblastoma(preprint). Nature Portfolio. doi.org/10.21203/rs.3.rs-4255559/v1.
2.Kirkwood, J.M. et al. Adjuvant nivolumab in resected stage IIB/C melanoma: primary results from the randomized, phase 3 CheckMate 76K trial. Nat Med. doi.org/10.1038/s41591-023-02583-2
3.Patel SP, et al. Neoadjuvant-Adjuvant or Adjuvant-Only Pembrolizumab in Advanced Melanoma. N Engl J Med. DOI:10.1056/NEJMoa2211437
4.中國醫師協會腦膠質瘤專業委員會, 上海市抗癌協會神經腫瘤分會. 中國中樞神經系統膠質瘤免疫和靶向治療專家共識(第二版). 中華醫學雜誌. DOI:10.3760/cma.j.cn112137-20200714-02117
5.Linda M. Liau, et al. Association of Autologous Tumor Lysate-Loaded Dendritic Cell Vaccination With Extension of Survival Among Patients With Newly Diagnosed and Recurrent Glioblastoma. JAMA Oncol. doi:10.1001/jamaoncol.2022.5370
6.Yu Yao, et al. Molecular subgroups and B7-H4 expression levels predict responses to dendritic cell vaccines in glioblastoma: an exploratory randomized phase II clinical trial. Cancer Immunology, Immunotherapy. doi.org/10.1007/s00262-018-2232-y