一場國際化學會議上散發的小冊子,撥開了分子學説的迷霧_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!1小时前

全文將分上下兩篇推送,本文為上篇。介紹從道爾頓、阿伏伽德羅到坎尼扎羅,近代原子分子學説在化學領域的源流脈絡。
撰文 | 鄭超(中國科學院上海有機化學研究所研究員)
每一處細小的事實都在引導你提出嶄新的理論;
每一點理論的思索都在提示你發現未見的事實。
Jac. Berzelius Bref (1914), i, Part 3
説起原子和分子,讀者朋友們想必不會感到陌生。任何一種中學物理或者化學教科書都會提及:原子是構成物質的基本微粒,原子按照一定的規則彼此連接,就形成了保持物質化學性質的最小單元——分子。從教科書的拓展閲讀材料中你還能瞭解到近代原子、分子理論的主要創立者:英國人道爾頓(J. Dalton,1766~1844)和意大利人阿伏伽德羅(A. Avogadro,1776~1856)。在如今的化學實驗室中,我們藉助X射線衍射技術可以測定晶體中分子的三維結構;使用掃描隧道顯微鏡能夠觀察,甚至操縱固體材料表面的原子。但是,假如你多一些好奇心,將不難發現這樣的事實:這兩種物質結構表徵方法的發明時間遠遠晚於道爾頓和阿伏伽德羅的生平年代。那麼,沒有先進儀器的加持,一百多年前的先行者們在看不見、摸不着的“迷霧”中,究竟依靠着怎樣的推理和實驗才斷定了原子和分子的存在,探聽到從感官無法直接觸及的微觀世界中傳來的陣陣春雷?
跳出藩籬的“嫁接”
原子、分子的思想由來已久,這從它們的詞源可見一斑。英文“原子(atom)”一詞來源於希臘語ἄτομον,意為不可分割;“分子(molecule)”則來源於拉丁語mōlēcula,意為一小堆物質。古希臘思想家留基伯(Leucippus)、德謨克利特(Democritus)和伊壁鳩魯(Epicurus)都持有物質由不可分割的微粒所組成的觀點,但是他們的論述顯然無法脱離超驗的哲學思辨範疇。緊隨文藝復興而來的科學革命讓原子論煥發了新的生機。經典力學的巨大成功讓十七世紀的自然哲學家普遍相信:宏觀物體的運動行為一定能夠歸因於肉眼不可見的微粒的性質與相互作用。最具代表性的實例來自牛頓(I. Newton),他發現如果把氣體看作由相互排斥的微粒所組成的彈性流體,並且斥力隨着微粒間距的增大而迅速減小,這樣的氣體就將服從波意耳(R. Boyle)的實驗定律(恆定温度下氣體的壓強與體積成反比)。在鉅著《光學》的末尾,牛頓明確提出了物質是由具有一定質量且不可穿透的運動微粒所組成的假説,並希望以此為基礎解釋複雜的化學變化。不過牛頓同時也承認,他無法用實驗證明這種微粒假説;把原子論從思維體操昇華為科學理論的任務只能留待後人。
向牛頓指出的方向邁出決定性一步的後人正是道爾頓。牛頓去世40年後,道爾頓出生於英格蘭北部一個貧苦的農民家庭。他自幼聰穎過人,卻沒能接受系統的學院教育,全靠自學成才。道爾頓一生未婚、不重名利,用做教師的微薄收入維持簡樸的生活。他“午夜方睡,黎明即起”,把全部精力投入到對科學的探索中,研究領域涉及氣象學、物理學和化學。道爾頓從21歲起每天清晨進行氣象觀測,直到他去世的前一天,前後持續57年之久。長期積累的關於氣温、氣壓、濕度等的第一手資料成為他研究氣體性質的重要基礎。

十八世紀末,人們已經從空氣中分離出氧氣、氮氣、碳酸氣(二氧化碳)等多種氣體,並測定了它們的密度。一個自然而又費解的問題是,這些組分為什麼能夠混合成均勻的空氣,而沒有依據各自的密度分層?此外,道爾頓通過實驗發現了氣體分壓定律,即混合氣體的總壓強等於所有組分的壓強之和。道爾頓沿着牛頓的思路,認為將氣體看作由具備特定質量的原子所組成的彈性流體是解釋上述事實的可行方案。不過,由於深受當時流行的“熱質説”影響,道爾頓的原子被一層無質量的熱流環繞,就像被棉花包裹的硬球一樣。道爾頓進一步假設,同種原子的熱流相互排斥、異種原子的熱流沒有相互作用。這樣一來,不同氣體的原子能夠在彼此的熱流之間穿梭,從而實現均勻的混合;排斥作用只發生在同種氣體的熱流之間,就“保證”了分壓定律的成立。

道爾頓真正超越牛頓及以往所有原子論者的地方,在於他將物理的原子論與化學反應的元素質量比巧妙地“嫁接”。道爾頓提出了著名的倍比定律:當兩種元素A和B可以化合形成不同物質時,在這些物質中與一定質量A元素結合的B元素的質量成簡單的整數比。例如沼氣(甲烷)和油氣(乙烯)都只含有碳、氫兩種元素,如果以兩種氣體中碳元素的質量為基準,那麼沼氣中氫元素的質量是油氣的兩倍;類似地,碳氧化物(一氧化碳)中碳、氧元素的質量比為3:4,而碳酸氣中這一比例恰為3:8。道爾頓敏鋭地意識到,使用原子論可以完美地解釋這一發現。既然原子不可分割,那麼元素的彼此化合必然以各自的原子為最小單元。不同物質中元素質量比的簡單倍數關係,不正好對應着參與化合的原子個數的差異嗎?以這個發現為起點,道爾頓創造性地提出了一種計算原子相對質量(原子量)的方法。以氧為例,當時人們通過水的電解實驗和氫氣燃燒實驗,已經知道水僅由氫和氧組成。道爾頓基於一種“最簡比”原則,推定水是氫與氧的二元化合物,其化學式(用今天的記號表示)為HO,再將氫的原子量設為1,根據實驗測定的水中氫和氧的質量分數即可算出氧的原子量。如果採用拉瓦錫(A. Lavoisier)的數值(氫和氧的質量分數分別為15%和85%),氧的原子量可定為5.7(≈ 85/15);如果採用蓋–呂薩克(J. L. Gay-Lussac)和洪堡(A. von Humboldt)的數值(氫和氧的質量分數分別為12.6%和87.4%),氧的原子量則為7(≈ 87.4/12.6)。
1803年9月,道爾頓在實驗日誌中寫下了第一張原子量表。當年10月,道爾頓在向曼徹斯特文哲學會宣讀的一篇論文中,首次公開了他的原子論和原子量表。1808年,道爾頓出版了他的名著《化學哲學新體系》,在該書的第二部分中用原子論闡述了基本元素與二元素化合物的組成和性質。以今天的眼光看,道爾頓的原子論有太多的瑕疵。他篤信的熱質説是完全錯誤的理論,確定物質化學式的方式也失之武斷;他的實驗技術並不高明,所收錄的原子量(即使換算為正確的化學式)也有很大的誤差。但是這絲毫不減損道爾頓在科學史上的地位。“原子論”是古老的,但是道爾頓第一個跳出哲學思辨的藩籬,既用原子論的觀點解釋物質的化學組成,又用可觀測的實驗現象論證原子的存在。正如當時的英國皇家學會會長戴維(H. Davy)所指出的,道爾頓所提出的科學原子論可以與開普勒(J. Kepler)在天文學上的功績相媲美。他無愧於恩格斯所稱讚的“近代化學之父”的美譽。
莫衷一是的混亂
道爾頓的原子論甫一問世,就受到了化學家們的廣泛關注,但是同時也面臨着嚴峻的挑戰。問題的核心在於,道爾頓所計算的原子量強烈依賴於未經證明的化學式。例如,不論

蓋–呂薩克是十九世紀初法國首屈一指的物理學家和化學家。他早年求學於拉瓦錫的親密合作者貝託萊(C. L. Berthollet),並繼承了老師的衣缽。蓋–呂薩克最著名的成就是以他的名字命名的物理定律:在恆定的壓強下氣體的體積隨温度的上升線性膨脹。1804年,蓋–呂薩克兩次乘坐熱氣球升空(第一次與物理學家畢奧(J. B. Biot)同行),研究了大氣温度、濕度以及地磁場隨高度的變化規律。他是歷史上第一個到達7000米高空的人。

在熱氣球探險結束後不久,蓋–呂薩克和德國博物學家洪堡合作,深入研究了氫氣與氧氣的反應。藉助伏打測氣管(用水銀將一定體積的氫氧混合氣體密封於倒置的長管內,再用電火花引發氫氧反應,通過反應結束後水銀液麪的上升測定混合氣體體積的減少量),他們發現氣體的化學反應遵循簡單的體積比:在一定的温度和壓強下,2體積氫氣和1體積氧氣反應生成2體積水蒸氣。這個簡明的數學關係立刻讓人意識到,體積可以作為氣體參與化學反應的計量單位。如果承認化學反應以原子為基本單元進行,就不難得出以下推論:“在一定的温度和壓強下,相同體積的任何氣體的原子數相等”。
也許是出於對老師的維護(貝託萊始終反對不同元素按照一定計量比發生化學反應的觀點),蓋–呂薩克本人並未對氫氧反應體積比的意義做過多的闡述,不過這項實驗結果對於道爾頓的衝擊非同小可。從今天的視角來看,我們很容易認同“相同體積氣體的原子數相等”這一論述在一定程度上同時支持了氣體分壓定律和原子論;但是道爾頓對此並不買賬,反而質疑蓋–呂薩克和洪堡實驗結果的準確性。對於道爾頓而言,水作為氫與氧的“複合原子(compound atom)”,其原子量理應大於氧氣(道爾頓認為水的化學式是HO,氧氣的化學式是O),如果承認“相同體積氣體的原子數相等”,那麼水蒸氣的密度也將大於氧氣,而這顯然與事實不符。因此,道爾頓堅持認為,由於原子周圍環繞着無質量的熱流,所以實驗測定的氣體密度(宏觀性質)並不能與其原子量(微觀性質)直接掛鈎,相同體積的不同氣體所含有的原子數也不必相等。更加嚴重的是,如果按照蓋–呂薩克和洪堡的體積比配平氫氣和氧氣的反應方程式,那麼水的化學式中必然出現“半個氧原子”:

貝採利烏斯的科學生涯起於對電化學的研究。電解是當時化學家們瞭解複雜物質組成的重要手段。貝採利烏斯注意到,在電解實驗中一些物質總是從陰極析出、而另一些從陽極析出,這使他相信物質的結合是由於不同電荷的相互吸引。貝採利烏斯進一步將物質的電性與酸鹼性聯繫起來,構建了他關於無機物分類的理論體系——電化學二元論。他把電負性



歷史在這裏和化學開了一個不大不小的玩笑。十九世紀二十年代的化學家們並不知道,破解謎題的鑰匙早已出現,而這把鑰匙的正確用法卻還要等到幾十年後的一個特別場合方才廣為人知。
“不費工夫”的共識
1828年,貝採利烏斯的德國學生維勒(F. Wöhler)使用氰酸鹽和氨水等無機物製備了有機物尿素,打破了有機物的合成必須依賴“生命力”的神話,揭開了近代有機化學的序幕。有機物雖然僅由碳、氫、氧、氮等少數幾種元素組成,但是種類繁多,元素的含量比也變化多端。由於缺乏公認的原子量和確定物質化學式的方法,據當時的學者統計,連醋酸這樣簡單的有機物,竟也有多達19種不同的化學式!為了扭轉這種混亂的局面,一場史無前例的國際化學會議於1860年9月3日至5日在德國南部城市卡爾斯魯厄召開了。
卡爾斯魯厄會議由德國化學家凱庫勒(F. A. Kekulé)、維爾齊恩(C. Weltzien)和法國化學家武爾茨(C. A. Wurtz)發起,共有來自歐洲15個國家的140餘位化學家參會,是歷史上第一次國際學術會議。雖然經過了長時間的討論,但是由於與會者反對舉手投票的“民主”議事方法,這次會議並沒有針對它的初衷——物質組成與化學反應的基本概念——形成任何決議。不過,在會議的最後一天,意大利化學家坎尼扎羅(S. Cannizzaro)在會場散發了他於兩年前為熱那亞大學的學生編寫的一本講義《化學哲學教程提要》,書中用嚴謹的邏輯和清晰的表述澄清了當時化學研究中最核心的疑難問題。

坎尼扎羅的人生經歷曲折而豐富。他成長於意大利的西西里島,早年參加反抗波旁王朝統治的西西里獨立革命,還擔任過炮兵軍官。後來輾轉於意大利、法國多地求學並從事化學研究,發現了有機化學中著名的坎尼扎羅反應(苯甲醛在強鹼性條件下歧化生成羧酸和醇)。坎尼扎羅在化學史上留下的最濃墨重彩的一筆,當屬在卡爾斯魯厄會議上傳播分子學説。這套理論源於他的意大利前輩阿伏伽德羅於1811年發表的論文。阿伏伽德羅比坎尼扎羅年長50歲,和道爾頓、蓋–呂薩克以及貝採利烏斯是同時代的人。他出生於一個顯赫的法官家庭,年輕時做過多年律師,30歲開始研究自然科學,後來長期在家鄉的都靈大學擔任教授。阿伏伽德羅身處法語學術圈的邊緣,生前在英語世界中並不知名(十九世紀初原子論的幾位重要貢獻者都是英國人,或者與英國學界聯繫密切)。阿伏伽德羅的分子學説在提出後的近半個世紀裏都不受認可,但他自己並不介意。他一生的大部分時間都與家人過着寧靜的生活。
阿伏伽德羅研究了蓋–呂薩克和洪堡關於氫氣和氧氣反應的實驗結果,他贊成把體積作為氣體參與化學反應的計量單位這一觀點。阿伏伽德羅提出只要把(1)式改寫為(3)式,
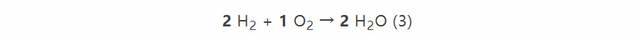


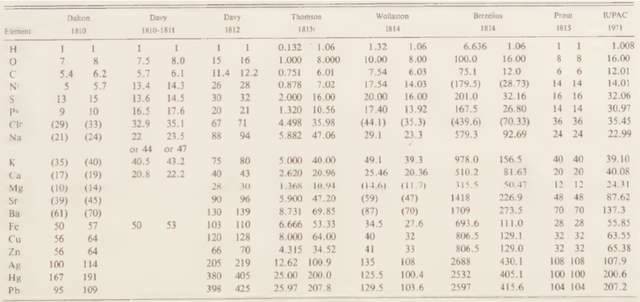
分子學説之所以能在坎尼扎羅的手中前進一大步,是因為他從物質蒸氣密度和元素質量比這兩種宏觀可測的性質出發,建立了推導物質分子量、分子式以及元素原子量的完整邏輯鏈條。他將氫(H)的原子量設為1,依據阿伏伽德羅對氫氧反應體積比的解讀,氫氣(H2)的分子量為2。只要承認等温等壓下相同體積氣體的分子數相等,物質的蒸氣密度就能作為其分子量的度量。將一系列氣體物質的密度與氫氣密度相比,即可推定它們的分子量。如氧氣為32、碳氧化物和碳酸氣分別為28和44、氯氣為71、鹽酸氣為36.5、汞蒸氣為200、甘汞和昇汞蒸氣分別為235.5和271。注意到分子中各元素對分子量的貢獻值一定是其原子量的整數倍,那麼根據物質中各元素的質量比可以確定其化學式和相應元素的原子

由於有機物的蒸氣密度和元素組成通常可以比較方便地測定,因而坎尼扎羅的方法迅速驅散了籠罩在有機物化學式問題上的疑雲,給出確定並且自洽的答案。對於無法測定蒸氣密度的物質,坎尼扎羅依據關於晶體比熱的杜隆–珀蒂定律(Dulong–Petit law)輔助確定化學式中包含原子的總數,也能得出令人滿意的結果。“踏破鐵鞋無覓處,得來全不費工夫”。坎尼扎羅如同水銀瀉地般的精彩推理征服了許多即將離開卡爾斯魯厄的與會者。德國化學家邁耶爾(J. L. Meyer)讚歎道“原來的茫然一下子就被剝除了”。自此,將原子和分子的概念應用於物質組成和化學反應的研究便再無障礙,各種關於原子量數值的衝突也迎刃而解。年輕的俄國化學家門捷列夫(D. I. Mendeleev)——在卡爾斯魯厄會議上他還只是一名默默無聞的留學生——正是按照原子量由小到大的順序將不同元素依次排列,終於在九年後發表了偉大的元素週期律。
未完待續
從道爾頓、阿伏伽德羅到坎尼扎羅,近代原子、分子學説在經歷了十九世紀前半葉的迷茫和混亂後,終於在化學理論體系中贏得了穩固的一席之地。然而原子和分子真的是客觀存在的微小實體嗎?或者只是人為構建的理想模型?圍繞這個問題,更多的探索和爭論將在化學之外展開。它催生了新的學科,革新了人們的認知,更塑造了二十世紀科學的底層邏輯……
參考文獻
[1] J. R. Partington, Ann. Sci. 1939, 4, 2435.
[2] A. J. Ihde, J. Chem. Educ. 1961, 38, 83.
[3] S. G. Brush, Synthese 1968, 18, 192.
[4] A. J. Rocke, Hist. Stud. Phys. Sci. 1978, 9, 225.
[5] W. W. Porterfield, J. Chem. Educ. 1995, 72, 871.
[6] M. C. Usselman, D. G. Leaist, K. D. Watson, ChemPhysChem 2008, 9, 106.
[7] M. C. Usselman, T. A. Brown, Ann. Sci. 2015, 72, 153.
[8] M. I. Grossman, Brit. J. Hist. Sci. 2017, 50, 657.
[9] Y. Xu, Y. Tong, J. Yuan, Found. Chem. 2023, 25, 439.
[10] D. S. L. Cardwell, Ed. John Dalton & The Progress of Science. Manchester University Press, 1966.
[11] A. J. Rocke, Chemical Atomism in the Nineteen Century – From Dalton to Cannizzaro. Ohio State University Press, 1984.
[12] C. Cercignani, Ludwig Boltztnann The Man Who Trusted Atoms. Oxford University Press, 1998.
[13] P. Achinstein, Book of Evidence. Oxford University Press, 2001.
[14] P. Grapí, Inspiring Air: A History of Air-related Science. Vernon Press, 2019.
[15] R. Seth, G. E. Smith, Brownian Motion and Molecular Reality. Oxford University Press, 2020.
[16] 李醒民,《自然辯證法通訊》,1988年,第10卷,57頁。
[17] 劉立,《大學化學》,1989年,第4卷,61頁。
[18] 沈乃澂,《物理》,2018年,第47卷,648頁。
[19] 王竹溪著,《熱力學》,高等教育出版社,1955年。
[20] 道爾頓著,李家玉、盛根玉譯,《化學哲學新體系》,北京大學出版社,2006年。
[21] 牛頓著,周嶽明、舒幼生、邢峯、熊漢富譯,徐克明校,《牛頓光學》(第二版),北京大學出版社,2011年。
[22] 賀拉斯著,李永毅譯註,《賀拉斯詩全集——拉中對照詳註本》,中國青年出版社,2017年。
致謝
作者感謝中國科學院上海有機化學研究所遊書力院士、中國科學院物理研究所曹則賢研究員、上海交通大學張紹東教授和中國科學院自然科學史研究所劉金巖研究員對本文的寶貴意見。
作者簡介
鄭超博士,中國科學院上海有機化學研究所研究員,國家自然科學基金委員會優秀青年科學基金項目獲得者。研究方向為物理有機化學與手性合成。

1. 進入『返樸』微信公眾號底部菜單“精品專欄“,可查閲不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關注公眾號,回覆四位數組成的年份+月份,如“1903”,可獲取2019年3月的文章索引,以此類推。
版權説明:歡迎個人轉發,任何形式的媒體或機構未經授權,不得轉載和摘編。轉載授權請在「返樸」微信公眾號內聯繫後台。