延壽13%的同時折壽6.6%?_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯2小时前

壽命和生殖就像糾纏在一起的一對量子,彼此成就、彼此衝突,然後一起支撐着人類穿過説不清、看不透的歲月,慢慢演化成這顆星球上最具智慧的生命。
但即使聰慧如現代人類,也還是搞不清壽命和生殖的真正關係:有人活到八十仍執着於“一樹梨花壓海棠”,而有的人為了長命百歲年紀輕輕就開始禁慾,各有各的追求中,這兩者真的不能兼得嗎?
想要在生命的維度上更近一步還得讓壽命和生殖“和平共處”!近日,日本學者Tohru Ishitani團隊在Science子刊上發文探討了生殖細胞的存在對壽命的影響,並在這個過程中發現了奇怪的現象:人類進化的分歧已經這麼大了嗎[1]?


對“生殖細胞對壽命到底能造成怎樣影響”的討論並非新鮮事,早在之前的研究中,就有線蟲和果蠅等低等衰老生物學模式生物實驗得出了**“幹掉生殖就能延長壽命”**的結論[2-3]。
但是!低等生物的實驗結果很難指代人類情況,而直接在人類身上研究未免太不人道,於是為了更貼近人類、又不“殘忍”,這次研究者們盯上了衰老生物學新秀——脊椎動物模式生物綠松石鱂魚。
這種看上去好像沒有小鼠、猴子等“靠譜”的短壽魚類[4],其實能在瘋狂壓縮實驗週期和成本的同時表現出能與更高級模式生物媲美的“人類表徵”:相同的免疫衰老和衰老相關疾病、相似的衰老原因和衰老進程[5-8]……
早在7年前,綠松石鱂魚就憑藉着在糞菌移植抗衰研究方面的傑出貢獻打出了自己的“成名戰”:成功驗證了糞菌移植抗衰的可能性,並直接推動“吃屎抗衰法”躋身抗衰干預核心圈[9]。

有珠玉在前,本次研究不努力都不行!所以,綠松石鱂魚這次又將帶來怎樣顛覆性的成果?

為控制變量,研究者們只是通過基因編輯清空了不同性別綠松石鱂魚體內的生殖細胞,但其他所有生理過程都不會受到影響,除了不再具備產小魚仔的能力外,雌魚雄魚甚至還能正常交配。
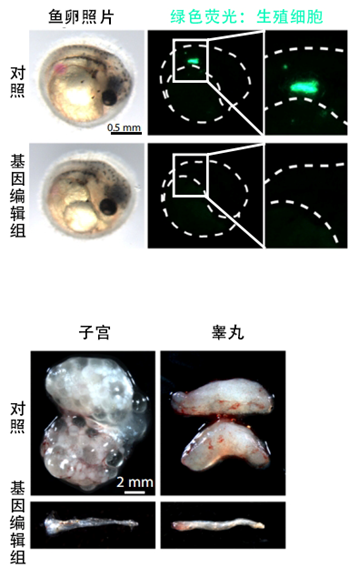
圖注:實驗魚體內的生殖細胞被清除得乾乾淨淨
但隨着衰老的來臨,年輕時造不成任何影響的生殖細胞缺失開始展現出它真實的能力:的確能折壽,但不是所有魚都折壽,還帶來了多種其他方面的變化。
折壽?延壽?有一條魚開始罵罵咧咧
首先當然是對壽命的影響。同樣是清除了所有衰老細胞,但和線蟲果蠅不一樣的是,鱂魚的壽命變化在兩性之間產生了巨大的差異:雌魚中位壽命縮短10%,平均壽命縮短6.6%;而雄魚中位壽命延長3.5%,平均壽命延長13%!
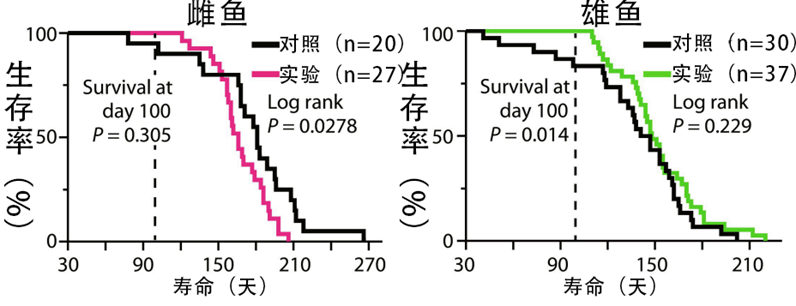
圖注:雌魚折壽而雄魚延壽
原本雌魚在壽命方面比雄魚擁有巨大的先天優勢(約高32.5%),可在生殖細胞的調控下,兩者實現了大致水平上的相同。雌魚哭唧唧:剝奪了我的生育能力,還要折我壽,這日子沒法過了!
生存期與健康期?笑死,旱的旱死澇的澇死
除了壽命,在其他健康層面上雌魚和雄魚也展現出了巨大的差異。雌魚壽命縮短,同時還要面臨心血管疾病風險增加、肥胖等情況;而雄魚不僅壽命延長,還表現出了骨骼肌再生潛力的增加、皮膚膠原含量的增加和骨骼體積密度的增強。
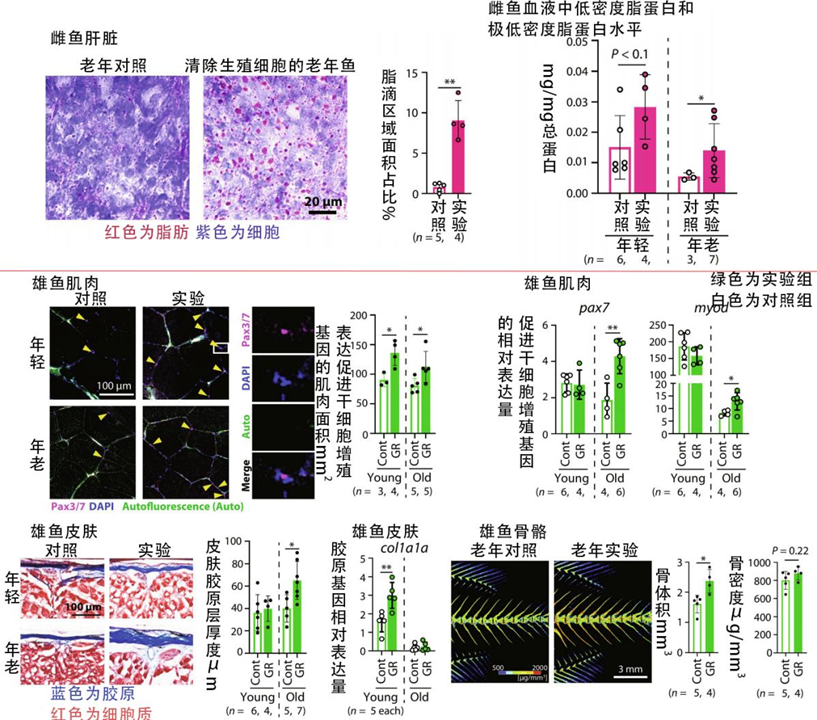
圖注:在壽命變化差異的基礎上,健康變化在雌雄之間也存在差異
一邊折壽和疾病雙雙降臨,另一邊不僅延壽還能身強體壯?幸運者越幸運,不幸者越不幸,在統一干預措施下的衰老中竟也這樣……
“絕育後發腮”是真的!這次誰也跑不掉
最後的最後,在一眾“差異”中,研究者們終於找到了一個一樣的:體長和體重的增加。其中,“絕育”雌魚的體長和體重分別增加了10%和27%,雄魚也分別增加了5.7%和16%,雖然暫時還很難評判這到底是好是壞,但寵物界“絕育即發腮”的傳説果然名不虛傳。
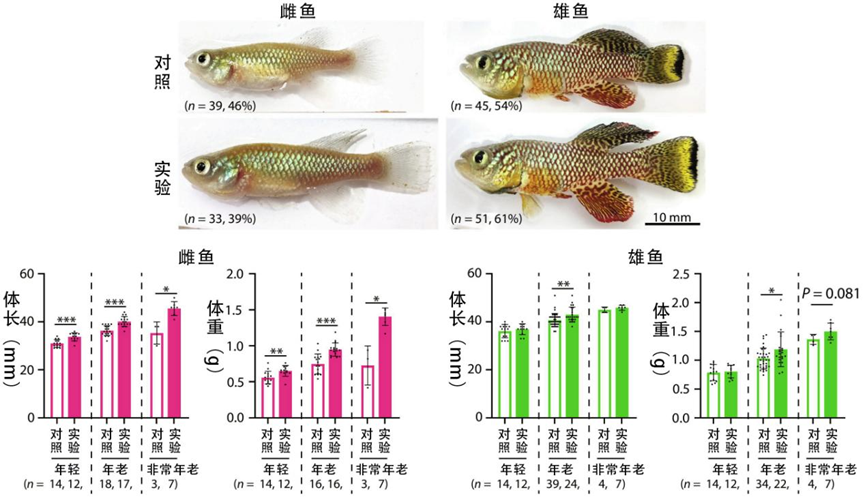
圖注:不管是雌魚還是雄魚,都會因為生殖細胞的消除“長高”、增重

所以,同樣是進行了“一鍵消除生殖細胞”,為什麼對雌性和雄性上會產生完全相反的結果?研究者們專門去研究了消除了生殖細胞對不同性別鱂魚基因表達的影響,然後從中成功找到了端倪。
No.1
雌魚?可能是因為激素減少了
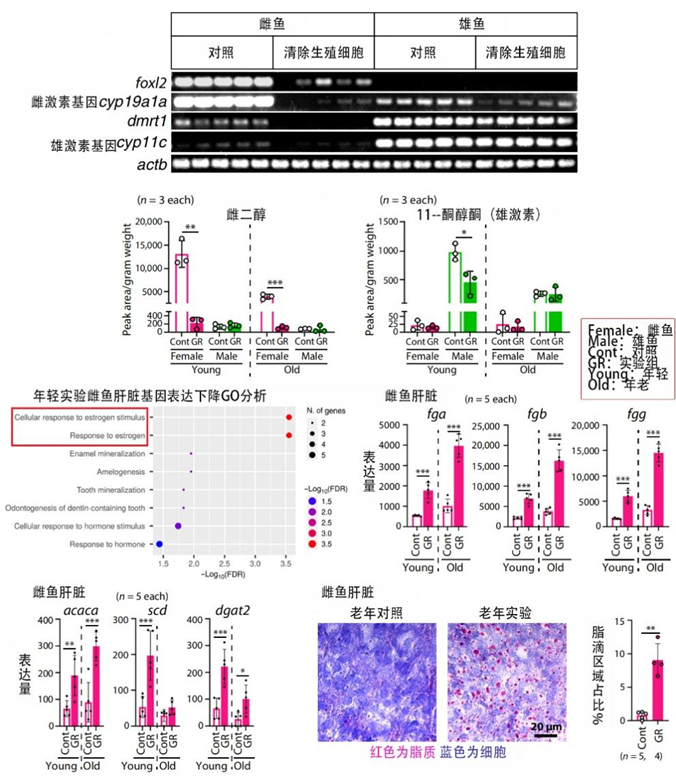
首先,就像更年期,生殖細胞沒了激素當然減少,雌性更是首當其衝。在實驗雌魚身上,研究者們果然發現了雌激素水平的降低,其合成基因如cyp19a1a和相關通路的表達也同步下降。
雌激素的降低還會帶動其他基因表達的變化,如凝血相關基因的表達如fga、fgb等增加,增加心血管疾病的風險;脂肪酸等合成相關基因的表達如acaca、scd等也增加,不僅造成脂質積累,也增加心血管負擔。

圖注:雌魚雌激素及其相關基因表達下降
如果説激素及其相關因素的改變主要是給健康期拖後腿,那隻在雌魚出現但不波及雄魚的衰老相關經典通路IGF-1增加則主要在折壽促衰方面出力:在IGF-1通路作用下,細胞壓力陡增,繼而誘發細胞“擺爛”,衰老細胞持續積累,促進整個機體衰老和折壽。
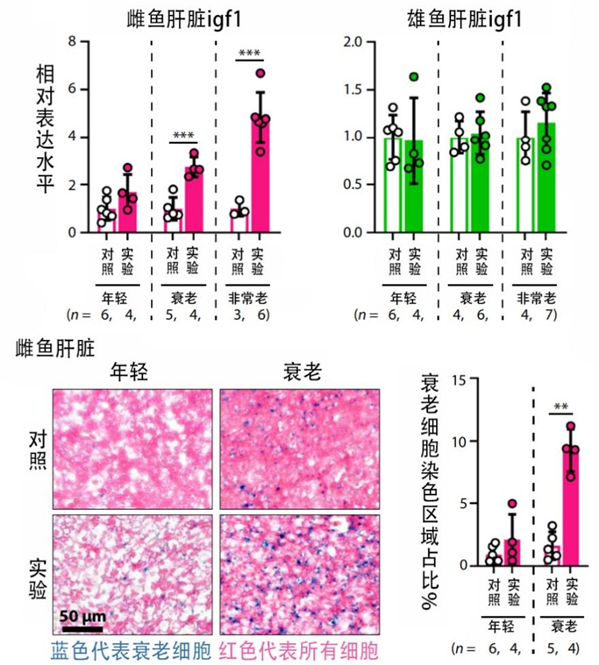
圖注:igf1過量表達,導致衰老細胞積累
至此,從壽命到健康狀況,即使是體重的增加,都得到了合理的解釋。
No.2
雄魚?恭喜抽中了Vd大禮包
相比之下呢,雄魚就要幸運得多,上面雌魚面臨的那些危機雄魚都沒有,反而能喜提一款有益基因的高表達——cyp2r1。
cyp2r1編碼維生素D3羥基化的主要酶,主要負責活化維生素D並增加其下游信號的轉導。維生素D強化骨骼的能力早已世人皆知,而這也正是實驗魚骨質增多增強的原因。
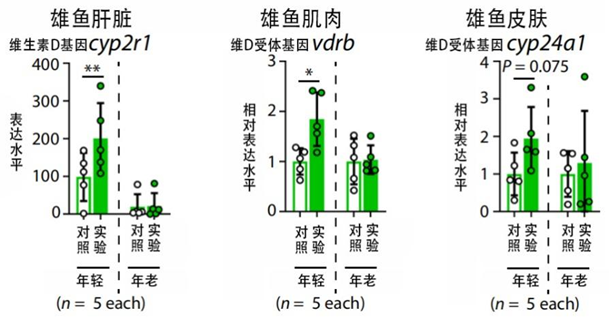
圖注:雄魚維D基因和各器官組織中受體基因均高表達,保證維D發揮抗衰作用
除此之外,維生素D還能增加促進肌肉乾細胞增殖的衞星細胞的數量和能力,從而增肌、維持肌肉功能;還能促進皮膚細胞生產膠原蛋白,保持皮膚Q彈又年輕。

通過上述解釋與驗證,研究者們得出了最可能適用於人類的“生殖細胞與壽命大全”,但一位全程圍觀並嘎嘎樂的男性同事在派派的提醒下突然失去了笑容:等會兒,**好像正常人都是有生殖細胞的,除非……**住腦!再想下去就不禮貌了!

而且,即使是女性,好像也並不能因為“正常”佔據優勢,因為更年期≈絕經≈不能每個月產出一個卵子≈失去生殖細胞!好嘛,衰老面前沒有贏家,很難不懷疑這是“天道”為彌補女性平均壽命先天比男性長的“bug”而打的“補丁”。
(想知道這個bug是怎麼回事嗎?想了解女性壽命平均比男性長約5歲的具體原因嗎?點擊下方卡片,前往派派後台,發送“男女差異”,一鍵瞭解!)
那怎麼辦?
別急,在去除生殖細胞的實驗中,研究者們還順勢找到了適用兩性的干預方法——補充維生素D。
研究者們給老年綠松石鱂魚吃維生素D類似物alfa,發現真的顯著提高了兩性鱂魚的壽命!其中,雄魚中位壽命延長了約22%,雌魚也延長了約12%;此外,那些靠alfa增加了壽命的雄魚同時還還獲得了和去除生殖細胞一樣的好處:緩解皮膚衰老,體型更大更強壯。
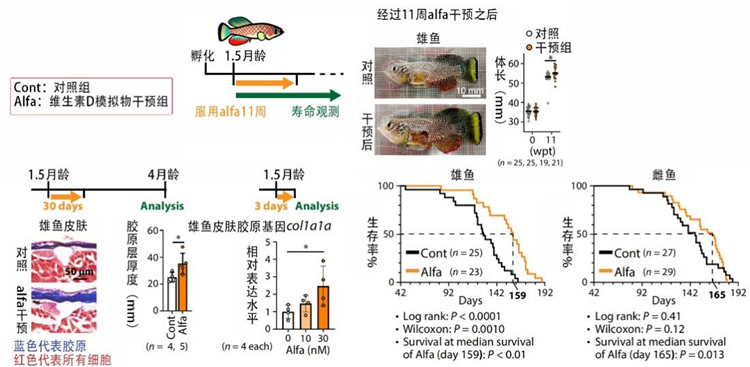
圖注:在維生素D類似物alfa的干預下,鱂魚們壽命長長,身體倍兒棒
對中年男性來説,原本《葵花寶典》才能解決的問題,一款小小維生素就輕鬆搞定;而對女性來説也不虧,不僅能延長壽命,還能補補因為更年輕隨時可能出現的骨質疏鬆,何樂而不為?
經過經過幾番翻轉、複雜的論證、艱苦的研究……最終壽命和生殖之間的“悖論”還是達到了一種新高度的、奇怪的平衡:有人因為有生殖細胞而更長壽,但隨着年齡的增長自然失去且較難補救;有人則因為有生殖細胞而不能長壽,但有更多抗衰選擇。
《道德經》有云:“天之道,損有餘而補不足”,人類進化緩慢,能維持現有的平衡已經是不易,但幸運的是,人類還能用自己的聰明才智人為尋找“平衡之道”。相信在不久的將來,人類在實現長命百歲的同時也能兼顧生殖,實現真正的“魚與熊掌兼得”。
參考文獻
[1] Abe, K., Ino, H., Niwa, T., Semmy, D., Takaochi, A., Nishimura, T., Mogi, C., Uenaka, M., Ishii, M., Tanaka, K., Ohkawa, Y., & Ishitani, T. (2024). Sex-dependent regulation of vertebrate somatic growth and aging by germ cells. Science advances, 10(24), eadi1621. https://doi.org/10.1126/sciadv.adi1621
[2] Patel, M. N., Knight, C. G., Karageorgi, C., & Leroi, A. M. (2002). Evolution of germ-line signals that regulate growth and aging in nematodes. Proceedings of the National Academy of Sciences of the United States of America, 99(2), 769–774. https://doi.org/10.1073/pnas.012511099
[3] Flatt, T., Min, K. J., D’Alterio, C., Villa-Cuesta, E., Cumbers, J., Lehmann, R., Jones, D. L., & Tatar, M. (2008). Drosophila germ-line modulation of insulin signaling and lifespan. Proceedings of the National Academy of Sciences of the United States of America, 105(17), 6368–6373. https://doi.org/10.1073/pnas.0709128105
[4] Polačik, M., Blažek, R., & Reichard, M. (2016). Laboratory breeding of the short-lived annual killifish Nothobranchius furzeri. Nature protocols, 11(8), 1396–1413. https://doi.org/10.1038/nprot.2016.080
[5] Morabito G, Donertas HM, Seidel J, Poursadegh A, Poeschla M, Valenzano DR. (2023). Spontaneous onset of cellular markers of inflammation and genome instability during aging in the immune niche of the naturally short-lived turquoise killifish (Nothobranchius furzeri). bioRxiv 2023.02.06.527346; doi: https://doi.org/10.1101/2023.02.06.527346
[6] Cui, R., Medeiros, T., Willemsen, D., Iasi, L. N. M., Collier, G. E., Graef, M., Reichard, M., & Valenzano, D. R. (2019). Relaxed Selection Limits Lifespan by Increasing Mutation Load. Cell, 178(2), 385–399.e20. https://doi.org/10.1016/j.cell.2019.06.004
[7] de Bakker, D. E. M., & Valenzano, D. R. (2023). Turquoise killifish: A natural model of age-dependent brain degeneration. Ageing research reviews, 90, 102019. Advance online publication. https://doi.org/10.1016/j.arr.2023.102019
[8] https://elifesciences.org/for-the-press/779a3695/gut-microbes-influence-life-expectancy
[9] Smith, P., Willemsen, D., Popkes, M., Metge, F., Gandiwa, E., Reichard, M., & Valenzano, D. R. (2017). Regulation of life span by the gut microbiota in the short-lived African turquoise killifish. eLife, 6, e27014. https://doi.org/10.7554/eLife.27014