功能性治癒糖尿病的希望!鄧宏魁合作團隊幹細胞再生療法首例臨牀研究登上《細胞》_風聞
熊猫儿-53分钟前
2024年9月25日,頂尖學術期刊《細胞》上線的一篇最新論文,帶來了糖尿病細胞治療的重要突破。
由天津市第一中心醫院沈中陽教授、王樹森研究員,與北京大學、昌平實驗室鄧宏魁教授合作領銜的研究團隊,利用化學重編程誘導多能幹細胞(簡稱CiPS細胞)製備胰島細胞治療****1型糖尿病。在首個臨牀研究中,首例接受移植的患者恢復了內源自主性、生理性的血糖調控,移植75天后完全穩定地脱離胰島素注射治療,目前療效已穩定持續1年以上,實現了臨牀功能性治癒!

糖尿病是一種因胰島素絕對或相對分泌不足引起高血糖的代謝性疾病。高血糖可導致糖尿病酮症酸中毒,隨着時間的推移,還可導致併發症,如腎病/衰竭、眼病(包括視力受損)、心臟病、卒中、神經損傷甚至死亡。
胰島素注射、降糖藥物是目前治療糖尿病的主要手段,雖然可以控制該疾病,但不能有效避免糖尿病併發症的發生,嚴重影響了患者的生活質量甚至危及生命。另一方面,胰島移植治療糖尿病已有較好的臨牀應用基礎,但人胰腺供體極為稀缺,嚴重限制了其廣泛應用。

圖片來源:123RF
多能幹細胞製備的胰島細胞為糖尿病移植治療提供了新的來源。多能幹細胞具有無限增殖的特性,能夠分化成生物體所有功能細胞類型,是再生醫學領域最具潛力的“種子細胞”。2012年,諾貝爾生理學或醫學獎授予了在多能幹細胞誘導上做出貢獻的兩位科學家,山中伸彌教授與John B. Gurdon教授。他們的工作發現,使用轉基因或細胞核移植的方法,可以“誘導”成體細胞回到胚胎髮育早期狀態,重編程為具備“多能性”的幹細胞(即iPS細胞)。
2013年,鄧宏魁教授團隊在《科學》(Science)雜誌發表論文,提出了一種全新的誘導人多能幹細胞製備技術:化學重編程。這種方法僅使用外源性化學小分子就實現了細胞命運的逆轉,將小鼠體細胞重編程為多能幹細胞(簡稱CiPS細胞)。在此基礎上,研究團隊2022年在《自然》(Nature)發表論文,進一步實現了利用化學小分子將人成體細胞誘導為多能幹細胞(人CiPS細胞)。
化學重編程技術的建立開闢了人多潛能幹細胞製備的全新途徑,並且規避了傳統轉基因操作可能引發的安全問題,為細胞治療及人造器官提供了理想的細胞來源,從而為未來再生醫學治療重大疾病帶來新的可能。糖尿病的治療就是其中一個重要方向。
基於化學重編程的關鍵核心技術,鄧宏魁研究團隊建立了人CiPS細胞高效分化製備功能成熟胰島的方案,並在靈長類糖尿病的實驗動物模型體內,證明了人CiPS細胞分化胰島細胞治療糖尿病的可行性、安全性和有效性。
此外,研究團隊還建立了一個全新的胰島移植策略“腹直肌前鞘下移植”,實現了移植後胰島細胞的長期存活和功能維持。相較於傳統的肝門靜脈移植,新的胰島細胞移植方案創傷小、操作簡便、移植物易於長期追蹤觀察,並且必要時可進行移除,保證體內移植細胞的安全可控性。這些臨牀前研究為後續開展臨牀研究奠定了堅實基礎。
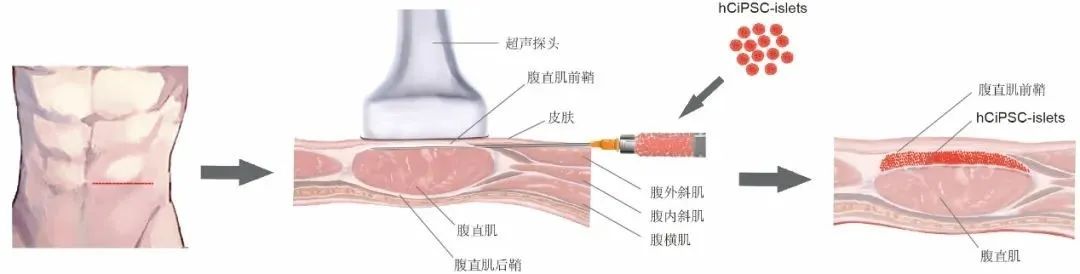
**▲**胰島細胞腹直肌前鞘下移植的示意圖(圖片來源:研究團隊提供)
2023年6月,人CiPS細胞來源的胰島細胞移植治療1型糖尿病的探索性臨牀研究獲批開展。在這項臨牀研究中,入組的首例患者已有長達11年的1型糖尿病病史,通過強化胰島素治療仍然不能有效控制血糖,在接受CiPS細胞來源的胰島細胞移植之前的一年內,多次發生危及生命的嚴重低血糖發作。而且這名患者過去接受過胰腺移植手術,但一年後胰腺移植失敗,羣反應抗體(PRA)呈現為強陽性,意味着難以接受同種異體胰島移植,而自體細胞移植有可能解決這個難題。
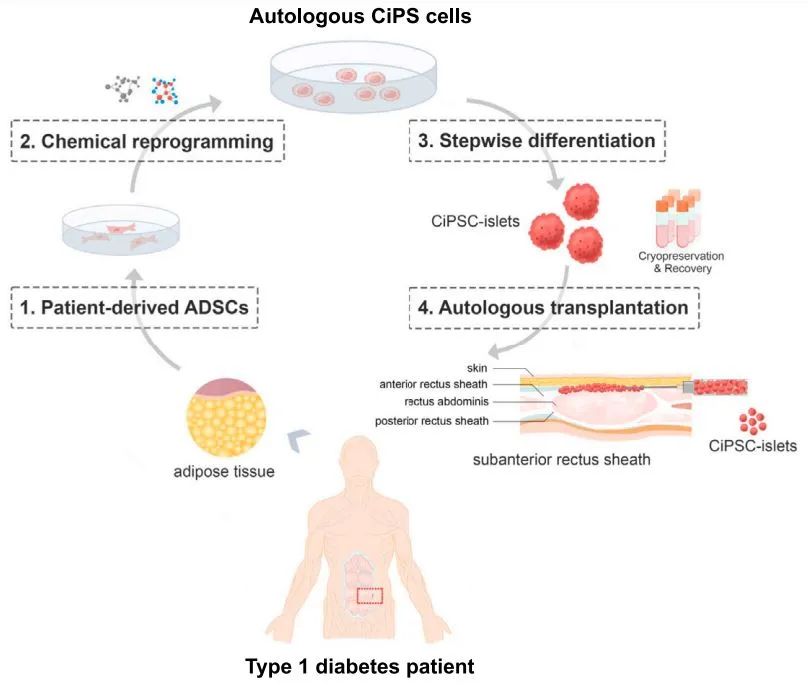
▲基於CiPS細胞治療1型糖尿病的臨牀研究示意圖(圖片來源:參考資料[1])
研究結果顯示,在腹直肌前鞘下移植自體CiPS細胞分化胰島後,患者的空腹血糖水平逐步恢復正常,外源胰島素需要量持續下降,從移植後第75天開始,實現了完全穩定地脱離胰島素注射治療。移植5個月後,患者血糖達標率已從基線值43.18%持續提高到98%以上,並維持在該水平,表明血糖控制穩定。另一個重要指標糖化血紅蛋白(HbA1c),在移植後一年降至4.76%,表明全身血糖水平長期處於正常狀態。
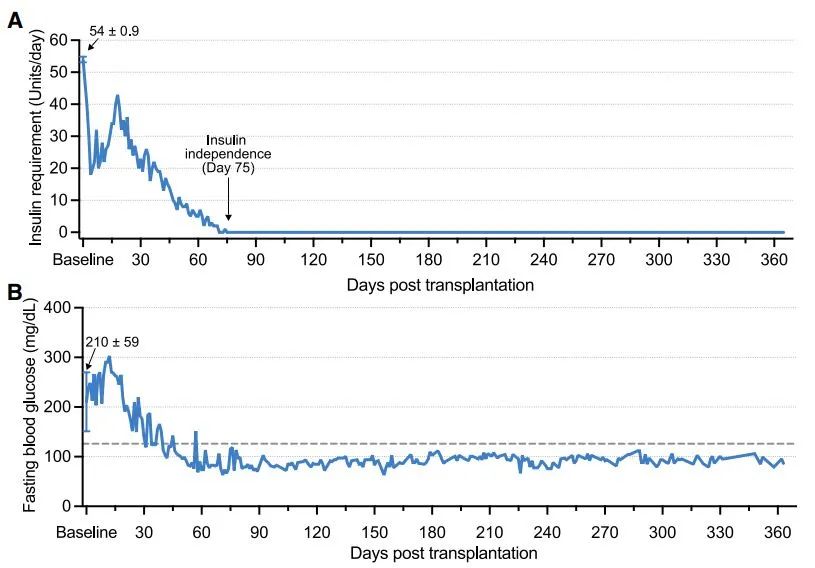
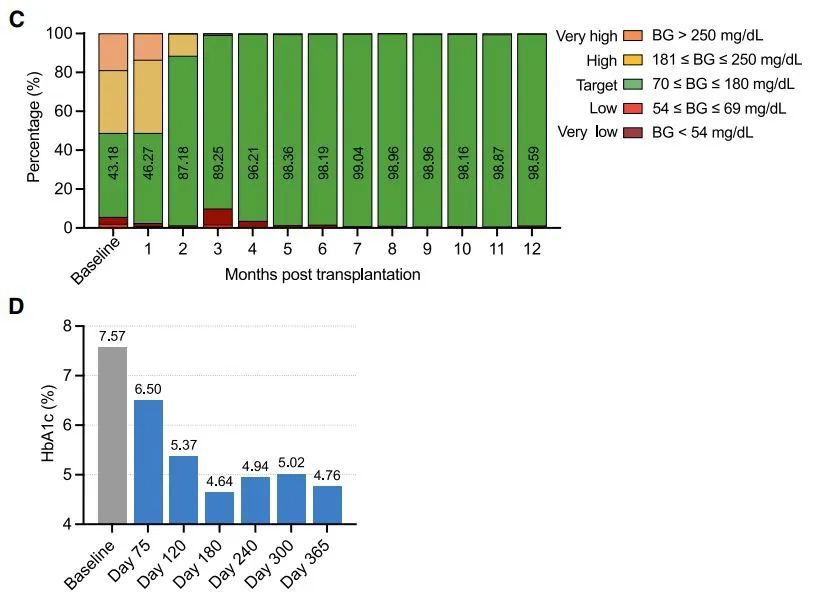
▲該名1型糖尿病患者的治療效果(圖片來源:參考資料[1])
截止到論文發表時,患者完全脱離胰島素治療超過1年,臨牀數據達到1年有效性和安全性終點,無移植相關異常跡象。值得一提的是,這項研究還首次在臨牀上實現了通過超聲和核磁對移植物的有效監測,極大提高了幹細胞臨牀治療研究的安全性。
“這些結果初步證明,化學重編程多能幹細胞製備的胰島細胞療法安全有效,實現了1型糖尿病的臨牀功能性治癒。”研究作者總結道。
更為重要的是,實現1型糖尿病的臨牀功能性治癒還只是起點。鄧宏魁教授表示,化學重編程技術製備的功能細胞在臨牀治療疾病的成功,表明化學重編程有望成為高效製備各種功能細胞類型的通用底層技術,為細胞治療在重大疾病治療上的廣泛應用開闢了新的道路。
參考資料:
[1] Shusen Wang et al., (2024) Transplantation of chemically induced pluripotent stem-cell-derived islet under the abdominal anterior rectus sheath in a type 1 diabetes patient, Cell Doi: https://doi.org/10.1016/j.cell.2024.09.004
[2] Jingyang Guan et al., (2022) Chemical reprogramming of human somatic cells to pluripotent stem cells. Nature. https://doi.org/10.1038/s41586-022-04593-5
[3] Zhen Liang et al. (2023) Implantation underneath the abdominal anterior rectus sheath enables effective and functional engraftment of stem-cell-derived islets. Nature Metabolism Doi: https://doi.org/10.1038/s42255-022-00713-7