失明能治癒了?有患者視力提高了一萬倍_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。10-15 22:00
有望為20%因遺傳性視網膜變性而失明的嬰幼兒,帶來治療希望。
**撰文 |**凌駿
從失明到可以在黑夜裏看清周圍物體,基因治療正將這種“不可能”變為現實。在《柳葉刀》近期發佈的一項研究中,美國賓夕法尼亞大學佩雷爾曼醫學院的研究人員展示了,如何讓視力的平均改善達100倍。
甚至,“其中一些患者在接受最高劑量的治療後,視力提高了10000倍。”研究主導者Artur Cideciyan教授介紹。這些人患有遺傳性視網膜病變——先天性黑矇症(LCA),患者體內和視神經發育及功能相關的蛋白無法正常合成,全球大約有20%的兒童失明案例由LCA引起。
這是近年來學界在探索致盲性眼病治療中的又一次突破。據不完全統計,目前全球有超過150項針對視網膜/視神經疾病的基因療法臨牀試驗,試驗主要集中在美國和中國。
輝大基因(上海)首席執行官陸英明博士曾聯合研發出全球首個眼科基因治療藥物,他告訴“醫學界”,失明是最令人聞風喪膽的身體殘疾之一,但基因療法正在為治療,甚至治癒這一疾病帶來希望和光明。
視力最高提升10000倍
LCA是一類最嚴重的視網膜營養不良症,也是導致全球兒童先天性失明的主要疾病。由於患兒攜帶有遺傳致病基因,阻礙了視覺信號的傳導,他們出生後會出現眼球震顫(不自主的眼球運動)、瞳孔反應遲鈍或幾乎消失、畏光、視力嚴重下降、夜盲,大多情況下1歲時就會徹底失明。
在基因治療出現前,沒有任何方式可以阻止LCA的進展。但基因療法則提供了一種極具想象力的治療路徑:直接修改或增加基因以挽救視力。本次發佈於《柳葉刀》的研究,採用的就是“基因替代療法”ATSN-101,它能夠將正常基因導入眼內併產生正常的蛋白,用於治療GUCY2D基因突變引起的I型LCA。
共有15名患者參與了這項試驗,其中一些人已經成年。相比正常人能夠看清120米外的物體,他們至少要在6米內才能看到它的存在。為此,醫生將不同劑量的基因藥物注射到患者視網膜中,希望在成功定植後,新基因能恢復感光細胞的活性。
據研究人員介紹,治療完成後,所有患者的視力迅速得到了改善,並在1年隨訪期內得以維持。在關鍵的光敏感度測試(FST)中,患者平均的視功能改善為100倍,其中有兩人更是達到了10000倍。
“相當於他們原本只能在強光室內看見眼前的物體,現在卻能在月色下看清周圍的環境。”Artur Cideciyan教授稱,其中一名患者表示,他目前僅藉助篝火就能在午夜裏看清方向。
陸英明博士告訴“醫學界”,選擇FST作為關鍵療效的評估指標,是因為LCA主要影響的是視覺循環中光感受器的光敏感度。“FST代表全視網膜感受光刺激的最小亮度,ATSN-101治療後所謂的視功能改善100倍,就是指能夠看見原來1/100水平的光亮。這一指標與LCA的發病機制和患者的訴求契合。”
安全性方面,研究人員共觀察到了68起不良事件,其中56起與外科手術相關,包括眼部炎症、虹膜睫狀體炎和玻璃體炎等,並無與試驗用藥相關的嚴重不良事件。
研究人員認為,此次的試驗數據足以支持III期隨機雙盲臨牀試驗的開展。“考慮最新臨牀試驗的成功,以及此前積累的經驗,我們有望為20%因遺傳性視網膜變性而失明的嬰幼兒帶來治療希望。”研究人員稱。
有多少“失明”有望得到治癒?
根據世界衞生組織統計,全球至少有22億人視力受損,有4000萬到4500萬盲人和1.8億視力障礙者。其中,先天性遺傳視網膜病(IRD)的患者約有300萬,他們快則二三十歲就失明,慢則到五六十歲徹底失明。
轉機出現在2017年,美國食品藥品監督管理局(FDA)批准了全球首款眼部基因治療藥物Spark Therapeutic公司的Luxturna,用於治療由RPE65基因突變引起的Ⅱ型LCA,全面開啓了IRD的基因治療時代。
陸英明博士當時在Spark Therapeutics公司擔任臨牀研究和運營主任,他告訴“醫學界”,“由於眼睛是一個‘免疫特權’器官,允許外來分子進入而不易引發強烈的炎症反應,這為使用腺病毒相關病毒(AAV)為載體的基因療法提供了可能。”
在國內,上海市第一人民醫院副院長、眼科中心主任孫曉東教授也是這一領域的權威專家,2022年,眼科中心啓動了我國首個Ⅱ型LCA基因藥物——LX101的臨牀試驗,“目前累計有21名患者接受了治療,他們的視功能均出現了一定程度的改善。”孫曉東教授曾向“醫學界”透露,團隊正在推進Ⅲ期臨牀的進一步驗證。
由知名兒童視網膜病專家、上海新華醫院趙培泉教授主持的研究者發起的,針對Ⅱ型LCA的臨牀研究同樣觀察到令人鼓舞的效果。在注射由輝大基因研發的基因治療藥物HG004後,受試者平均FST提高超過100倍,部分高劑量組甚至達到10000-100000倍。
但由於致盲性眼病種類過多,至少200餘種,僅LCA就有超過20種突變類型,“比如對於一些會產生毒性的基因突變,單純‘補充’正常基因,可能就無法阻止視力的損害了。”孫曉東教授表示,“同時,有的致病基因編碼的蛋白質較大,超過了載體遞送上限,也會導致研究受阻。”
此時,革命性的CRISPR/Cas基因編輯工具允許“改動”基因的幅度更大,進一步為治療更廣泛病種提供了可能性。
2024年5月,美國哈佛大學醫學院附屬馬薩諸塞眼耳科醫院等機構在《新英格蘭醫學雜誌》發佈論文,全球首次直接將基因編輯藥物注射到眼內,讓11名10型LCA患者改善了視力。“我可以看到蠟燭在身邊閃爍,這是一生中從未見過的東西。”一名患者在治療後表示。
醫生給LCA患者注射基因編輯藥物
“CRISPR/Cas9的問題在於Cas9核酸酶太大,無法包裝成單個AAV載體遞送,需要用兩個AAV載體才能裝下。但將兩個AAV送到視網膜,又需要擔心安全風險不可控。”陸英明博士説,“哈佛大學醫學院的學者用的就是兩個AAV,初步未發現嚴重不良事件,這給學界提供了信心。”
除了基因增補/替代、基因編輯,近年來以小核酸藥物為代表的“基因沉默”療法同樣發展火熱。“基因沉默”不需要修改致病基因,而是阻止它轉錄翻譯成致病的蛋白,目前也已在一些遺傳性眼病中展開了探索。
而更大的患者羣體,則來自濕性年齡相關性黃斑變性(nAMD),這是一種後天的致盲性眼病,是全球50歲以上人羣失明的主要原因。僅僅在中國,就有約300萬nAMD患者,他們會出現突然的視力下降。為了阻止病情發展,每隔幾個月,患者都要前往醫院,讓醫生往眼球內注射單抗藥物。
“除了不夠便捷,頻繁注射還可能造成眼球損傷,出現感染風險。”陸英明博士説,而基因增補療法可能做到“一針管終身”,永久地將表達抗體的基因注射到眼內。據瞭解,此前北京協和醫院、北京同仁醫院、四川大學華西醫院等都陸續宣佈,已啓動nAMD基因治療的探索,完成首例臨牀試驗給藥,患者恢復情況良好。
“但有一些nAMD患者,由於眼內反覆打藥產生了對抗體藥物的抗體,也就是所謂的‘抗抗體’,基因增補抗體的效果可能不佳。此時,就可以通過RNA編輯療法,從源頭阻止致病因子的翻譯過程。”陸英明博士表示。目前,輝大基因針對nAMD的RNA編輯療法也進入了臨牀試驗階段。
值得一提的是,對於遺傳性的致盲性眼病,一般認為要早期干預,因為隨着時間推移,可能還會發生更多影響視力不可逆的損傷。但在此次《柳葉刀》文章發佈後,研究人員表示,在這項試驗中,一些患者在失明數十年後,還能通過基因療法獲得視力改善,這是巨大的成功。
還存在哪些挑戰?
儘管此次試驗取得了階段性的成果,但陸英明博士告訴“醫學界”,“從目前的結果來看,受試者離達到正常標準的‘視力1.0’,還有很長一段距離。”
根據試驗結果,雖然視網膜光敏感度大幅提高,但患者的最佳矯正視力(BCVA)僅平均提高了8個字母。“目前,BCVA的改善是LCA基因療法中尚存的難點。美國FDA曾表示,起碼提高15個字母才有意義,可幾乎所有的臨牀試驗都達不到這一要求。”陸英明博士説。
對此,孫曉東教授曾對“醫學界”分析,基因治療雖能修正致病靶點,但由於恢復視力需要整個視覺傳導通路神經傳導正常,在一些情況下,患者的感光細胞已經結構受損或嚴重萎縮,其功能的損傷是不可逆的。
相似的還有在2021年,渤健(Biogen)宣佈,旗下針對無脈絡膜症的基因療法BIIB111臨牀試驗失敗。陸英明博士告訴“醫學界”,“無脈絡膜症是一種罕見的遺傳性視網膜變性疾病,會導致感光細胞逐漸退化並引起失明,但它的病程長,前期發展緩慢,從某一個時間節點起,患者病情又會突然急轉直下,這使得啓動基因治療的最佳時機非常難以把握。”
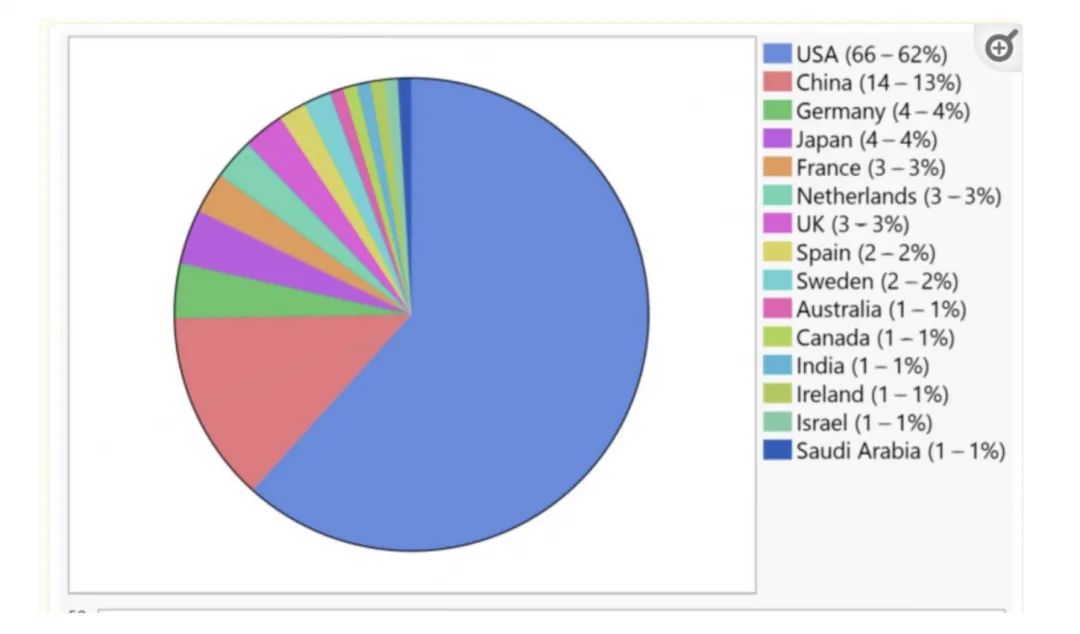
目前全球針對視網膜/視神經疾病的基因療法臨牀試驗,主要集中在美國和中國
除了不同致盲性眼病本身具有複雜的生理特點,陸英明博士表示,基因治療在研發中也存在一系列技術挑戰,尤其是遞送基因藥物的載體。
“對於傳統的眼部基因療法而言,AAV是最合適的載體,但只能用於遞送較小的基因。而基因編輯理論上能夠實現任何基因的修改,但Cas9對AAV而言體積就過大了。”陸英明博士説。
事實上,“發現致病基因或蛋白——改造/添加/沉默基因——治癒疾病”,眼科基因治療的邏輯已經非常清晰,陸英明博士認為,“未來學界可能會更專注於改進載體,或是緊湊型CRISPR核酸酶的設計,並從中找到最佳的組合搭配,以提高療效,並降低免疫原性。”
值得一提的是,除了基因治療,孫曉東教授同樣對“醫學界”表示,隨着多項新興技術的發展與基礎研究的深入,學界在先天性失明眼病的診治上已取得了不少突破。“包括光遺傳學治療、幹細胞治療、視網膜假體等,未來還需要多學科的交叉合作,讓不同基因型、不同臨牀階段的眼病患者都能有合適的治療技術相匹配。”