過了青春期,免疫力就降級?衰老是場“免疫病”!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯10分钟前

你知道嗎,衰老就是一場“免疫病”。有些人總“大病沒有,小病不斷”,就是免疫力低下的鍋!“一切疾病都與免疫有關”此話確實不假,小到體温變化、腸胃不適,大到惡性腫瘤,這些可能都是免疫偷偷“罷工”惹的禍。
但我們很難知道我們的免疫衰退具體有多少、對身體影響到底會多大。這時,如果有辦法能直接讓我們得知免疫衰退狀況就好了!
這不,華盛頓大學就為我們帶來了好消息——學者們找到了一個新的指標,能夠直接測量免疫衰老狀況[1]。不過,欲知指標究竟如何,要先從一個經常被忽視的器官——胸腺説起。


胸腺位於心臟上方,不僅佔據身體的“核心”,也是身體的中樞免疫器官,是T細胞發育的場所,還能分泌多種激素來調節免疫功能。
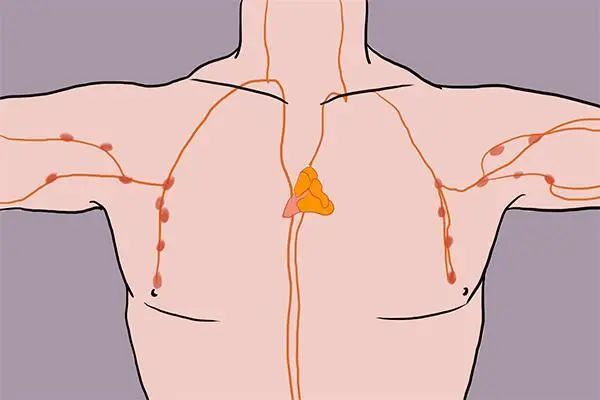
圖注:胸腺的位置
但胸腺也是最早衰老的免疫器官。胸腺在嬰兒時期開始發育,青春期後就開始隨年齡增長而萎縮,功能也開始退化,最終逐漸被脂肪替代[2]。以致很多人認為胸腺與闌尾、智齒一樣,是可有可無的退化器官。
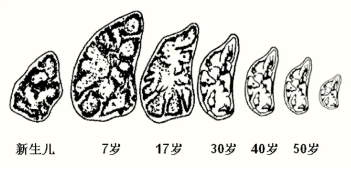
圖注:胸腺的退化
但是,胸腺其實可以成為免疫的“衰老時鐘”。
研究表明,胸腺退化是與免疫老化相關的最明顯的生理變化[3]**。**胸腺功能不全的新生兒與老年人羣體更易患病,研究還發現,胸腺切除的人患癌症的風險是普通人的2倍[4]。也就是説,胸腺不僅不可或缺,還與人體的免疫功能息息相關!
拋開其本身的發育和萎縮,胸腺最大的作用,就是培育遊走在免疫“一線”的“頭號殺手”——T細胞。每個T細胞在真正成為優秀的“殺手”之前,都要經過“胸腺學校”的培訓。
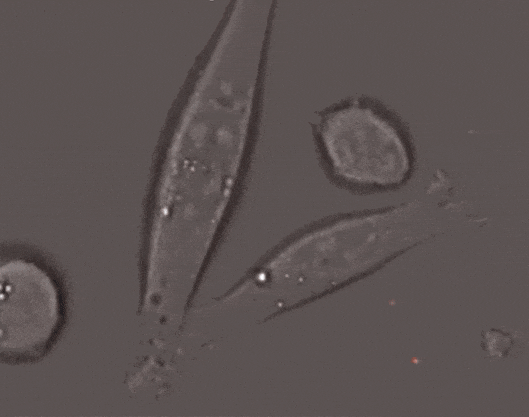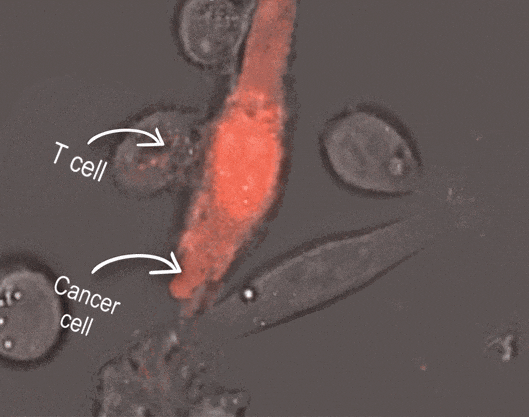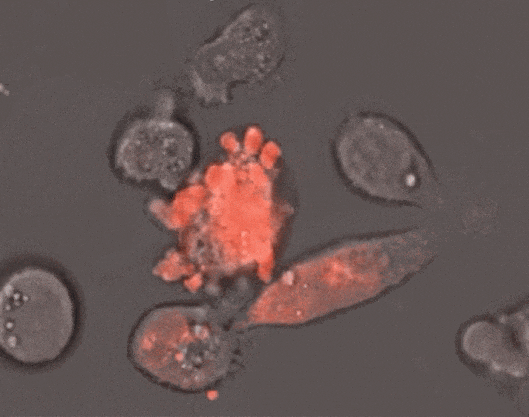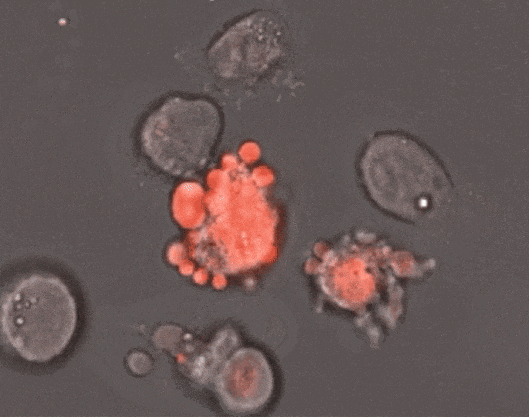
圖注:T細胞“圍剿”癌細胞
在胸腺“學校”,T細胞需要學會正確分辨身體的“敵”與“友”才能順利“畢業”。畢業的它們會被貼上CD4或CD8兩種“標籤”並從胸腺中遷出,這些細胞叫做新進胸腺遷出細胞(RTE)。之後它們會移居到附近的淋巴器官,並分化為幼稚T細胞[5]。

圖注:見習T細胞(幼稚T細胞)還在“胸腺學校”內學習正向選擇與負選擇,圖片源自動漫《工作細胞》
“胞”如其名,幼稚T細胞指的是通過了“訓練考核”卻從未真正在免疫反應中“實戰”過的T細胞。它們在受到不同的刺激後會分化為記憶T細胞和效應T細胞,深入身體免疫應答的“一線”,扮演着至關重要的角色。
因此,這些RTE就像免疫“預備軍”,代表着胸腺的免疫實力,能夠直接反映人體免疫功能的健康狀況。因此,通過監測RTE的數量和佔比就能夠提示免疫的歲數,給免疫“打分”。
然而,如何準確識別檢測RTE一直是一個難題。目前,一些已知的RTE標誌物如CD31和PTK7都不夠精準,甚至在經過胸腺切除後的患者中仍能檢測到所謂的“RTE”[6],可以説特別不靠譜。
於是,為了探尋更加精準、更加全面反映免疫衰老的RTE標誌物,研究者選擇先觀察其分化而成、能被明確鑑定的幼稚T細胞特徵,探尋其中RTE的蛛絲馬跡。

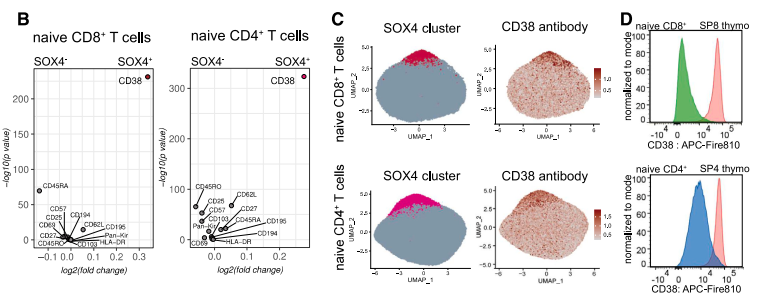
在這些幼稚T細胞中,有一小撮獨特的細胞羣引起了研究者的注意,它們的數量會隨年齡增長急劇下降。並且,它們有一個共同的特徵——SOX4高表達。
SOX4是一種重要的發育轉錄因子,可調節多種細胞的分化和發育[7]。此刻,研究者靈光一閃:這特徵,這變化……難道是RTE?
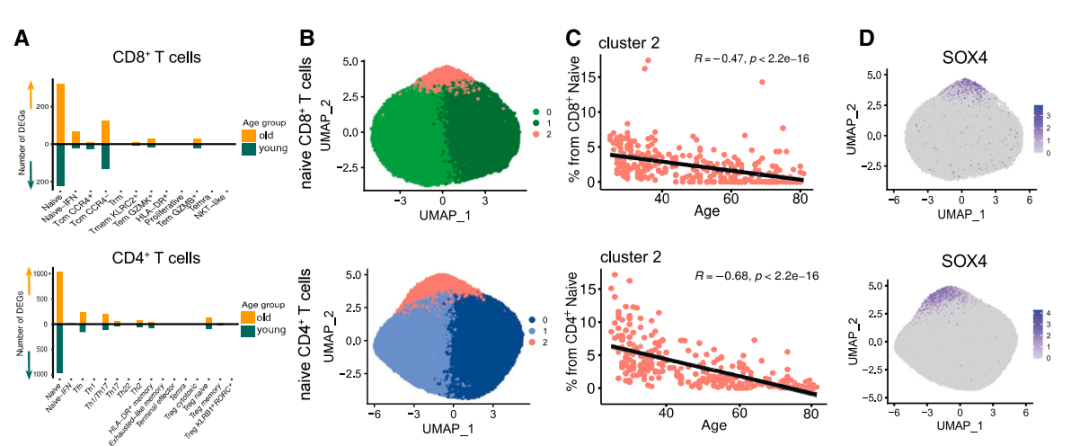
圖注:SOX4+幼稚T細胞隨年齡增長減少
通過進一步驗證,研究者果然發現,這些細胞與RTE的特徵幾乎一樣。
首先,SOX4+幼稚T細胞高表達IKZF2、TOX2因子,這些因子參與T細胞胸腺分化成熟的過程[8; 9],與RTE的功能也緊密相關。
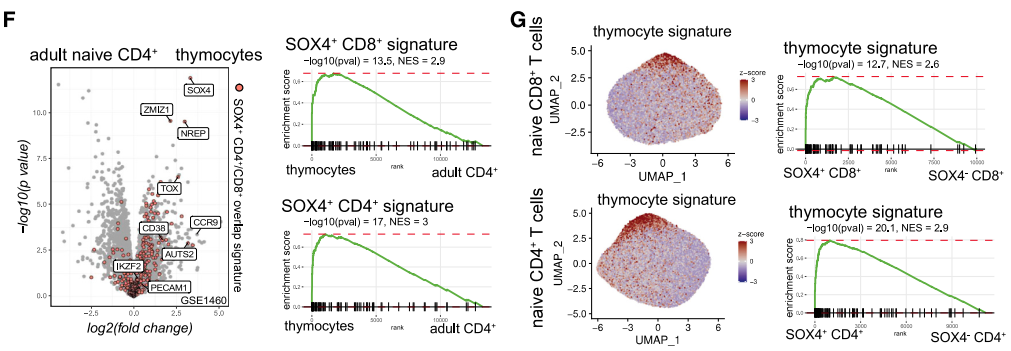
圖注:SOX4+幼稚T細胞的相關指標表達情況
並且,SOX4高表達的幼稚T細胞與用CD31作為標誌物篩選出的RTE也十分重合。
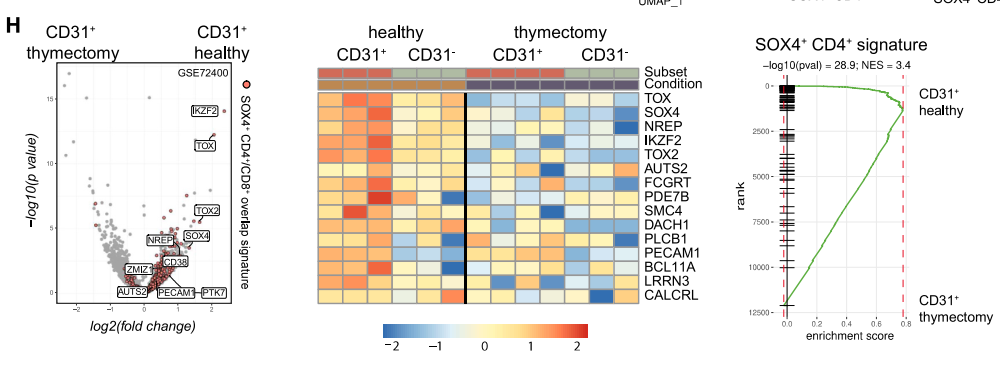
圖注:SOX4+幼稚T細胞與CD31篩選的RTE的表達對比
因此研究者們確定,這些特別的SOX4+幼稚T細胞可能就是RTE。
不過,探索並未停止。SOX4雖好,但卻“藏”在細胞裏面,很難檢測到,因此SOX4並不能算作一個成熟的RTE標誌物。
為了找到更易於實踐的指標,讓它真正進入臨牀、造福大眾。研究者們決定換個思路,轉而繼續尋找能輕鬆在SOX4+細胞表面“露臉”、方便我們檢測的細胞表面蛋白。
**功夫不負有心人,研究者找到了TRE們的共同“外表特徵”——CD38高表達。**這會不會就是識別TRE的關鍵線索?為了解開這個謎團,研究團隊展開了一系列實驗。
圖注:在RTE細胞中CD38高表達
首先,研究者以CD38的表達量為標準,將幼稚T細胞分為了三大陣營:低表達的CD38-,中等表達的CD38+,以及高表達的CD38++。隨後他們展開了進一步探索,最終有了如下發現:
反向驗證也成立
研究者檢測了CD38++細胞的SOX4表達情況。數據表明,CD38的表達也能對應SOX4的表達。也就是説,CD38高表達的幼稚T細胞與RTE就是同一批細胞。
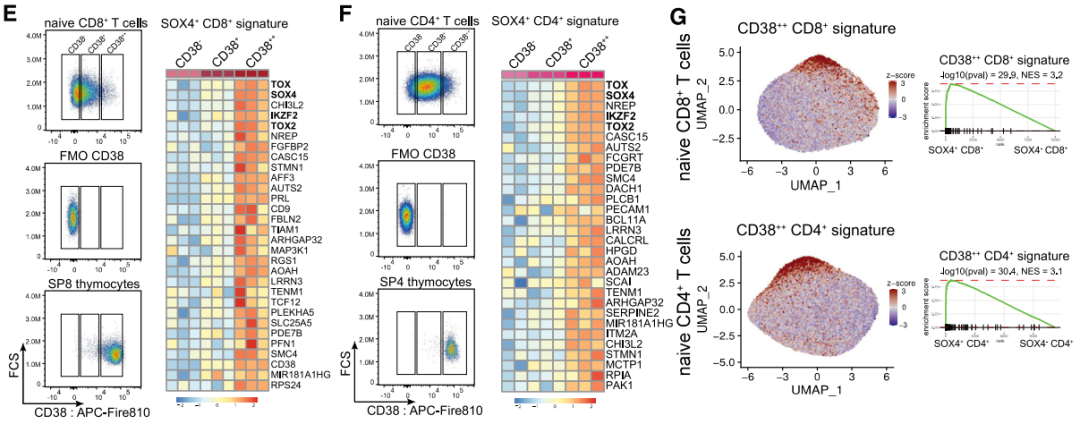
圖注:分類後的CD38-/+/++幼稚T細胞中SOX4+基因表達
二者特徵一致
研究者比較了CD38++幼稚T細胞與RTE的蛋白表達。結果發現,CD38++幼稚T細胞的IKZF2和TOX蛋白表達量也較高,與RTE的特徵一致,而其他細胞沒有這種特徵。
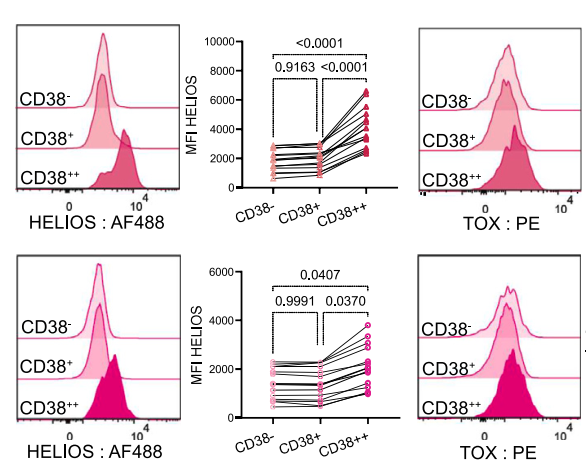
圖注:幼稚T細胞中IKZF2或TOX與CD38共表達的流式細胞術圖
證據已然確鑿,研究者鎖定目標:細胞表面的CD38蛋就是我們要找的RTE表面標誌物。
在前期的研究中,CD38因為其特異性開始嶄露頭角,但若要成為出色的免疫標誌物,就要優於其他指標。於是,研究者將CD38與其他標誌物進行比較,挖掘它作為“候選標誌物”的潛力。

不比不知道,CD38作為RTE的標誌物可謂相當出色!
易檢測、更精準
相比其他“不夠成熟”的標誌物PYK7,CD38更具特異性!首先,研究表明,並不是所有RTE細胞都表達PYK7,因此將它作為質保只能識別一部分RTE[10];而CD38的識別範圍更廣泛,是更全面的標誌物。
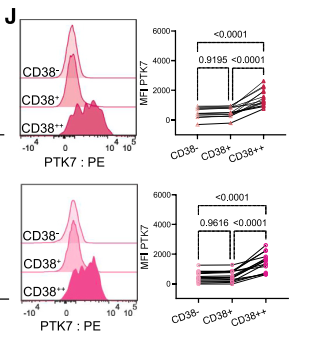
圖注:幼稚T細胞中PTK7和CD38共表達的代表性流式細胞術圖
此外,有時一些非RTE的細胞會高表達CD31,因此CD31作為標誌物不夠準確。相比之下,CD38作為標誌物篩選的細胞則更接近SOX4+ RTE細胞,更為精準。
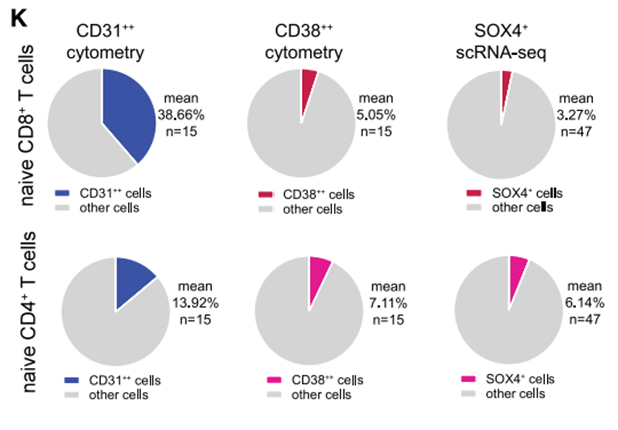
圖注:CD38與PYK7和CD31的信號、範圍對比
此外,研究者還發現,使用CD31作為標誌物篩選時信號較低,可能會導致難以有效區分RTE細胞,而CD38的信號則很強,更易被檢測,更加靈敏。
高度反映免疫力
作為免疫標誌物中的佼佼者,CD38在實際應用中也得到了檢驗。上文提到,隨着年齡的增長,胸腺逐漸萎縮和衰退,而胸腺(部分)切除手術可以模擬這一自然衰老過程中胸腺功能的喪失。
因此,研究者對比了正常人與切除胸腺的新生兒體內CD38++幼稚T細胞的佔比,結果顯示,與健康組相比,胸腺切除的新生兒的CD38++幼稚T細胞明顯更少。也就是説,CD38在臨牀“實戰”中也能準確反映免疫的衰老。
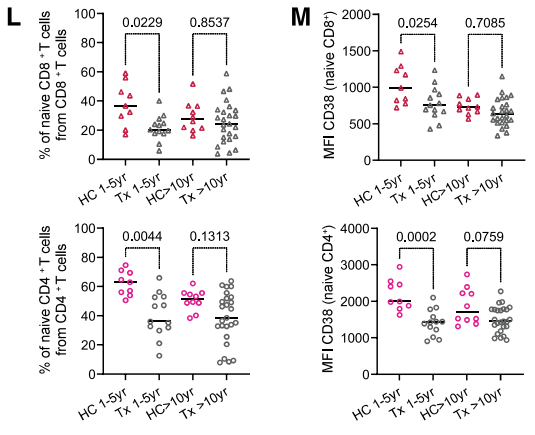
圖注:健康對照組和胸腺切除術患者的幼稚T細胞百分比(左)與細胞表面CD38表達(右)
看來,CD38標誌物既精準又靈敏,識別RTE、反映免疫功能情況都不在話下!派派也期待着CD38檢測將來能經過更多的“實戰測試”和“技能升級”,真正在臨牀實踐中大展身手!
參考文獻
[1] Bohacova, P., Terekhova, M., Tsurinov, P., Mullins, R., Husarcikova, K., Shchukina, I., . . . Artyomov, M. N. (2024). Multidimensional profiling of human T cells reveals high CD38 expression, marking recent thymic emigrants and age-related naive T cell remodeling. Immunity. doi:10.1016/j.immuni.2024.08.019
[2] Kumar, B. V., Connors, T. J., & Farber, D. L. (2018). Human T Cell Development, Localization, and Function throughout Life. Immunity, 48(2), 202-213. doi:10.1016/j.immuni.2018.01.007
[3] Aita, J. F., & Wanamaker, W. M. (1979). Body Computerized Tomography and the Thymus. Archives of Neurology, 36(1), 20-21. doi:10.1001/archneur.1979.00500370050009
[4] Kooshesh Kameron, A., Foy Brody, H., Sykes David, B., Gustafsson, K., & Scadden David, T. (2023). Health Consequences of Thymus Removal in Adults. New England Journal of Medicine, 389(5), 406-417. doi:10.1056/NEJMoa2302892
[5] Sun, L., Su, Y., Jiao, A., Wang, X., & Zhang, B. (2023). T cells in health and disease. Signal Transduction and Targeted Therapy, 8(1), 235. doi:10.1038/s41392-023-01471-y
[6] Junge, S., Kloeckener-Gruissem, B., Zufferey, R., Keisker, A., Salgo, B., Fauchere, J.-C., . . . Güngör, T. (2007). Correlation between recent thymic emigrants and CD31+ (PECAM-1) CD4+ T cells in normal individuals during aging and in lymphopenic children. European Journal of Immunology, 37(11), 3270-3280. doi:https://doi.org/10.1002/eji.200636976
[7] Moreno, C. S. (2020). SOX4: The unappreciated oncogene. Seminars in Cancer Biology, 67, 57-64. doi:https://doi.org/10.1016/j.semcancer.2019.08.027
[8] Niu, H., & Wang, H. (2023). TOX regulates T lymphocytes differentiation and its function in tumor. Frontiers in Immunology, 14.
[9] Mitchell, J. L., Seng, A., & Yankee, T. M. (2016). Ikaros, Helios, and Aiolos protein levels increase in human thymocytes after β selection. Immunologic Research, 64(2), 565-575. doi:10.1007/s12026-015-8754-x
[10] van den Broek, T., Delemarre, E. M., Janssen, W. J. M., Nievelstein, R. A. J., Broen, J. C., Tesselaar, K., . . . van Wijk, F. (2016). Neonatal thymectomy reveals differentiation and plasticity within human naive T cells. Journal of Clinical Investigation, 126(3), 1126-1136. doi:10.1172/jci84997