父母改掉這個習慣,讓孩子多活三年!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯1小时前

時至今日,我們已經不會再懷疑肥胖對於健康乃至壽命的負面影響,關於這一點,早在2009年,牛津大學一項涉及57個研究、100萬人的數據分析就已經表明——中度肥胖(BMI 30-35)會減少大約3年的預期壽命[1]。
3年啊!之前有句話咋説來着?青春才幾年,疫情就佔3年。這不,只要把肥給減下來,咱甚至能騰出被疫情霸佔的時間!
儘管數據所揭示的事實很殘酷,但堅定的肥胖人士也有話説的:少就少唄,為了多活那兩年,吃喝還得小心翼翼一輩子那多不值當,再説了,我胖我的礙別人什麼事?

哎!到這裏,派派可就有話説了,自己肥胖真的不礙別人的事嗎?通過一番詳細地調查,派派發現,一位母親的肥胖,尤其是懷孕期間的肥胖,不僅會影響到自身的健康,很可能也會霍霍自己子女的壽命!

咱説話是講證據的,首先在動物研究方面,曾有學者對比了吃正常飼料大鼠的後代(CF1)和長期吃高熱量飼料導致肥胖的大鼠的後代(MOF1),這兩波鼠崽從小到大的各項生理指標:體重、臟器重量、總脂肪、膽固醇、血糖、胰島素、甘油三酯、丙二醇、活性氧等等[2]。
結果一看,發現除了膽固醇水平以外,MOF1身上幾乎所有隨着衰老變化的生理指標變化程度都顯著高於CF1:
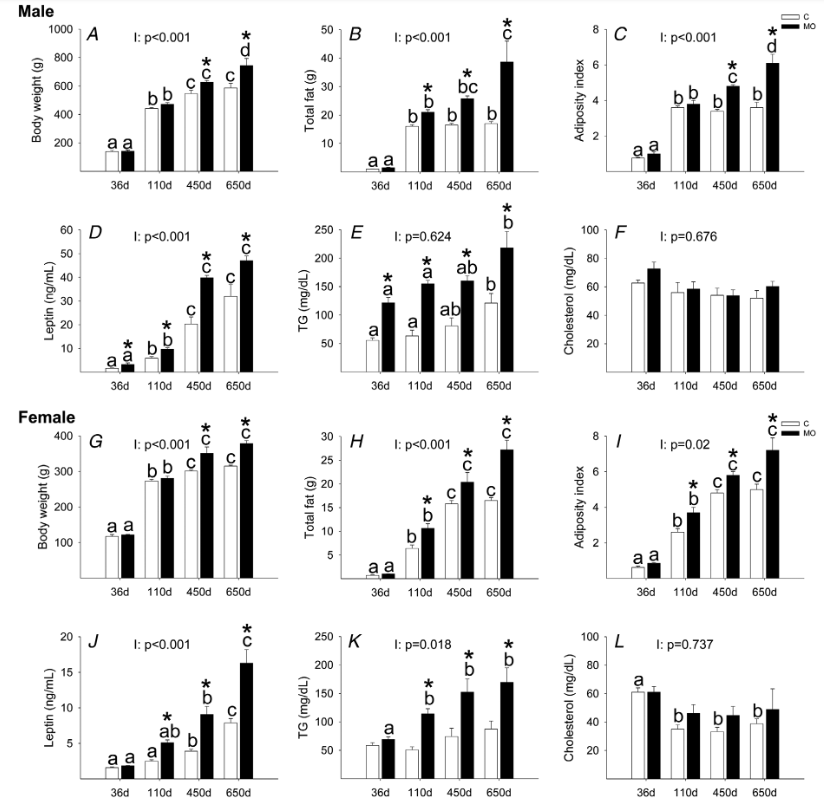
圖注:黑色柱子代表肥胖鼠後代(MOF1),白色柱子代表正常鼠後代(CF1);36d、110d、450d 和 650d代表了MOF1和CF1大鼠被檢測這些生理指標時的日齡
要知道,無論是MOF1大鼠還是CF1大鼠,它們終其一生都是吃一樣的正常飼料(兩組親代吃不一樣的飼料,但兩組子代都吃正常飼料),但MOF1大鼠偏偏就是比CF1鼠呈現出更加明顯的代謝老化。
MOF1大鼠:我這一生如履薄冰,吃一樣的飯,做一樣的事,卻偏偏比隔壁CF1命短,居然…居然只是因為我有一個肥胖的老媽?

不僅是動物研究,人類流行病學研究也早就給我們發出警示:
一項對37,709名英國個體的研究發現,如果一位母親首次產檢時的BMI較高(>30),那麼她的子女在34-61歲期間的全因死亡率要比BMI正常的母親後代高35%,因心血管疾病住院的風險也要高29%[3](該研究發表於影響因子93.6分的期刊——BMJ (Clinical research ed.)上)。
還有一項在芬蘭赫爾辛基出生隊列中進行的研究也發現,母親BMI與子代心血管疾病風險呈正相關。尤其對於兒子們來説,媽媽的BMI每增加1 kg/m²,他們得冠心病的風險就增加3.1%[4]。

遺憾的是,儘管母體的肥胖與後代預期壽命的相關性已經確鑿,但科學家們對於其中的分子機制還是雲裏霧裏,更多的只是科學家們根據已知的知識和零碎的線索進行猜測,接下來派派將整合這些信息,對“母親肥胖會影響孩子壽命”的原因進行梳理。

首先,最為主流的一個理論是,母體的肥胖可能通過DNA甲基化等表觀遺傳修飾來影響胎兒的基因表達。
(關於甲基化與壽命,可詳見派派曾寫過的另一篇科普,公眾號後台回覆 甲基化元兇 即可獲得原文)
無論是小鼠還是狒狒的研究都表明,母體肥胖或者是孕期高脂飲食都會嚴重破壞胎兒的甲硫氨酸循環[5,6],不過具體的機制還不清楚。
甲硫氨酸循環是一碳代謝網絡的重要組成部分,它給包括DNA甲基化在內的許多代謝過程提供了重要的調節作用。
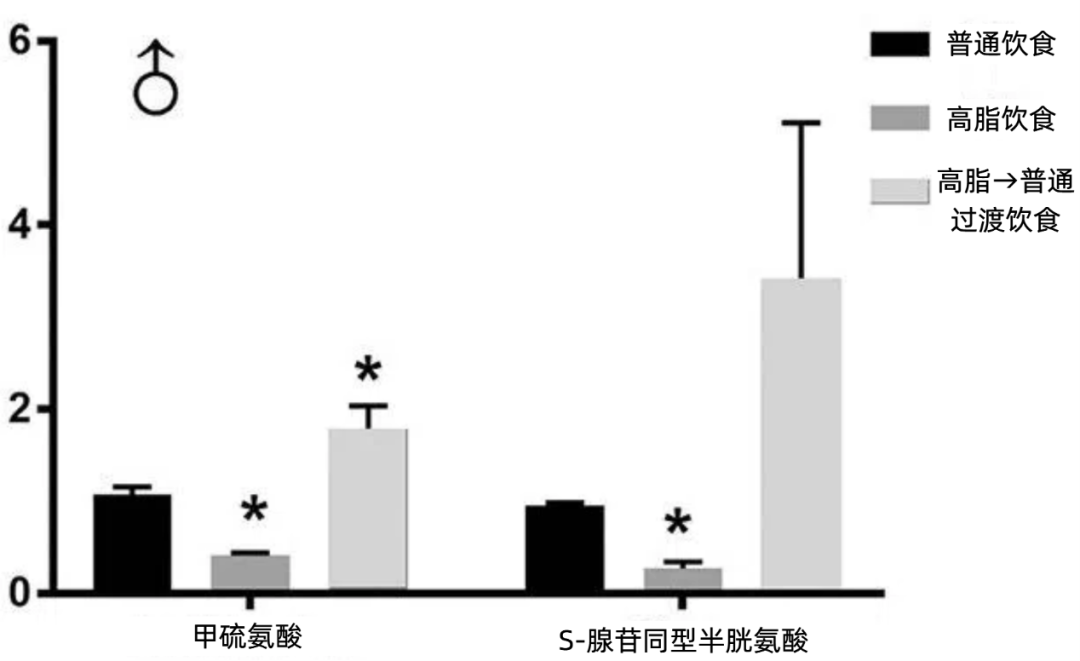
圖注:研究者檢測了孕期動物在不同飲食模式下,其後代肝臟的甲硫氨酸循環相關代謝物水平
在甲硫氨酸循環被破壞的情況下,S- 腺苷同型高半胱氨酸水平也會降低,程度比甲硫氨酸更甚,而它又是甲基化的操刀手——DNA甲基轉移酶(DNMT)的抑制劑,因此學者也發現,高脂飲食鼠的後代肝臟中的DNMT活性反而提高。
最終,後代基因組中的甲基化模式受到的具體影響是:部分DNA區域,例如我們熟知的長壽因子AMPK和促進脂肪酸氧化、抑制炎症的PPAR-α等基因都被高甲基化,它們的表達可能會受到長期抑制。
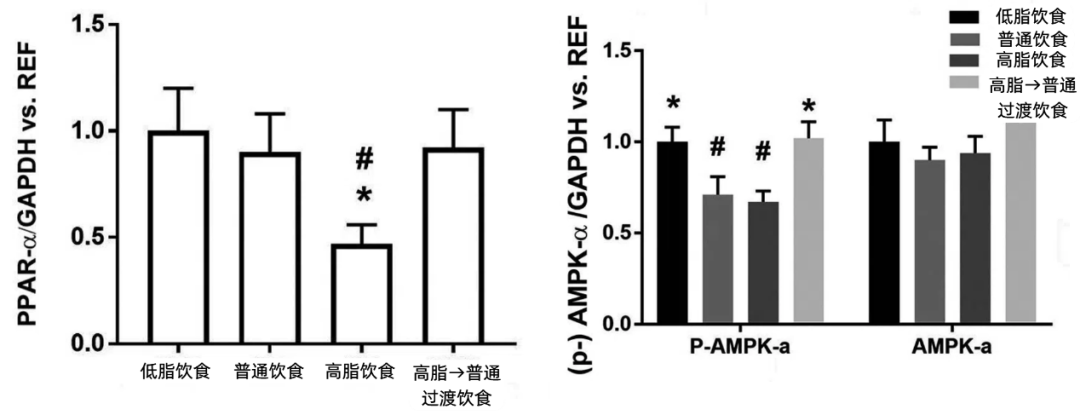
圖注:與前者一樣,圖片展示的並非是不同飲食模式下的母體的基因表達情況,而是其後代的基因表達情況
AMPK與長壽的聯繫自不必多説,PPAR-α這個抗老小能手的重要性也得到過許多研究的支持:
PPAR-α的表達會隨着年齡增長而減少[7];
與野生型小鼠相比,PPAR-α失活小鼠的壽命顯著縮短[8];
PPAR-α 的激活一定程度介導了熱量限制對壽命的延長[7]。
可能有的人聽到這裏還不以為然,心想:DNA甲基化這種表觀遺傳修飾不是會因環境而改變的嗎?雖然媽媽可能傳給了我不好的甲基化模式,那我改善後天的環境不就能逆轉了嗎?

對於這種樂觀的想法,派派可能得先潑一盆冷水。因為有研究表明,胚胎髮育期和生命早期是表觀遺傳編程的黃金時期,這一時期形成的一些表觀遺傳標記更“頑固”,相對不那麼容易在後天被改變[9]。
從邏輯上也不難推理,相比於成人的身體,胚胎時期的幹細胞佔比顯然要大得多,那不妨想想,幹細胞中的表觀遺傳變化,是否要比體細胞中的變化造成大得多的影響呢?因此,胚胎髮育階段因環境導致的表觀遺傳變化,是有可能影響一生的。
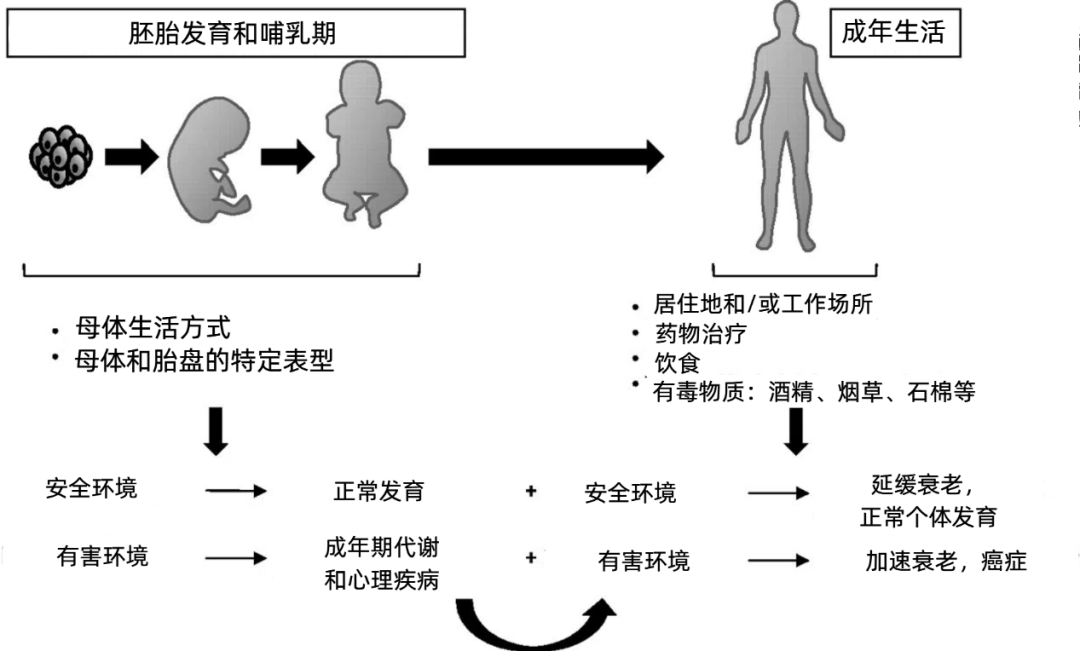
而以上所有,也僅僅只是從表觀遺傳層面闡述的母體肥胖影響子女壽命的可能機制,其實其他層面同樣可能存在影響,比如:
母體肥胖環境,胎兒下丘腦對瘦素和胰島素的敏感性降低,導致後代擁有更高的食慾[10](原來我管不住嘴的毛病還能甩鍋給麻麻……)。
母體肥胖環境會影響胎兒期脂肪前體細胞的建立,導致出生後脂肪組織擴張能力異常增強[11],可謂是從孃胎裏就給孩子鋪好了發胖的紅地毯。
母體肥胖環境可導致胎兒胰島β細胞數量減少,使其更不容易控制血糖代謝[12]。
除了這些,也有人在不是那麼生物學的層面提出過一個猜想:孩子的生活習慣很大程度上受到父母的影響,因此肥胖的父母可能會將不夠健康的“家風”傳給自己的子女。
總之,如果母親在孕期體重偏高,飲食習慣欠佳,那麼子女的長壽之路可能要比其他人走得稍微艱辛一些。寫到這裏,派派忍不住回想了一下家母的情況……


當然當然,派派仍舊要強調,具體到個人的壽命,環境因素通常比遺傳因素影響更大,母親的肥胖只是可能讓路變得稍微難走了些,但想要走通,還是有很多辦法的。
首先我們要認識到,在上一部分中我們提到的各種機制,無論是表觀遺傳變化也好,還是胰島素敏感性也好,基本上都是通過擾亂後代的代謝健康來影響其壽命的,那麼運動和合理膳食就是那個早已被證明能夠改善這些代謝問題的“解決方案”[2]。
即使一個人的母親比較胖,只要他現在的體型是正常的,也沒有什麼異常的代謝指標,那麼就意味着他已經相當程度上抗住了肥胖母親帶來的壽命debuff!

另外,對於母親而言,如果不想讓自己的孩子在“母債子償”的過程中太過辛苦,孕期的肥胖媽媽也可以做很多事情,比如在還方便運動的階段儘可能減輕體重,被證明是可以有效改善後代健康狀況的[13]。
還有一個令人安心的證據是,根據對小鼠的研究,若母體在懷孕前從高脂飲食過渡到正常飲食的話,那麼高脂飲食對後代造成的不利的表觀遺傳變化基本上都可以避免[5]。
因此,肥胖的準媽媽們,還是得管住嘴,邁開腿,同時準爸爸和婆婆們,也不要以“不能餓着孩子”為由有事沒事就投餵準媽媽。孕期的健康管理,離不開全家人的支持,家長的一小步,可能就是孩子長壽的一大步!
生物的世界如此多樣,總會存在例外吧,難道母體的肥胖,對子女而言就不存在積極的一面嗎?別説還真有,一項研究顯示母體肥胖的孩子在6個月大時,認知表現會更好,遺憾的是,這種優勢在18個月大時基本就已經消失了[14]……
其他方面硬要説的話,胖媽媽帶給子女的影響,或許只有在饑荒之類的極端時期,才會成為優勢吧,因為她們的孩子比別人家的孩子更容易儲存脂肪…………但派派心想,應該沒有人會羨慕這種“末日優勢”吧……
參考文獻
[1] Moderate obesity takes years off life expectancy. https://www.ox.ac.uk/news/2009-03-18-moderate-obesity-takes-years-life-expectancy. Accessed 11 November 2024.
[2] Rodríguez-González GL, Reyes-Castro LA, Bautista CJ, Beltrán AA, Ibáñez CA, Vega CC, Lomas-Soria C, Castro-Rodríguez DC, Elías-López AL, Nathanielsz PW, Zambrano E. Maternal obesity accelerates rat offspring metabolic ageing in a sex-dependent manner. J Physiol 2019; 597:5549–5563.
[3] Reynolds RM, Allan KM, Raja EA, Bhattacharya S, McNeill G, Hannaford PC, Sarwar N, Lee AJ, Bhattacharya S, Norman JE. Maternal obesity during pregnancy and premature mortality from cardiovascular event in adult offspring: follow-up of 1 323 275 person years. BMJ 2013; 347:f4539.
[4] Godfrey KM, Reynolds RM, Prescott SL, Nyirenda M, Jaddoe VW V, Eriksson JG, Broekman BFP. Influence of maternal obesity on the long-term health of offspring. Lancet Diabetes Endocrinol 2017; 5:53–64.
[5] Peng H, Xu H, Wu J, Li J, Zhou Y, Ding Z, Siwko SK, Yuan X, Schalinske KL, Alpini G, Zhang KK, Xie L. Maternal high‐fat diet disrupted one‐carbon metabolism in offspring, contributing to nonalcoholic fatty liver disease. Liver International 2021; 41:1305–1319.
[6] Nathanielsz PW, Yan J, Green R, Nijland M, Miller JW, Wu G, McDonald TJ, Caudill MA. Maternal obesity disrupts the methionine cycle in baboon pregnancy. Physiol Rep 2015; 3.
[7] Masternak MM, Bartke A. PPARs in Calorie Restricted and Genetically Long-Lived Mice. PPAR Res 2007; 2007:1–7.
[8] Howroyd P, Swanson C, Dunn C, Cattley RC, Corton JC. Decreased Longevity and Enhancement of Age-Dependent Lesions in Mice Lacking the Nuclear Receptor Peroxisome Proliferator-Activated Receptor α (PPARα). Toxicol Pathol 2004; 32:591–599.
[9] Aguilera O, Fernández AF, Muñoz A, Fraga MF. Epigenetics and environment: a complex relationship. J Appl Physiol 2010; 109:243–251.
[10] Furigo IC, Dearden L. Mechanisms mediating the impact of maternal obesity on offspring hypothalamic development and later function. Front Endocrinol (Lausanne) 2022; 13:1078955.
[11] Scheidl TB, Brightwell AL, Easson SH, Thompson JA. Maternal obesity and programming of metabolic syndrome in the offspring: searching for mechanisms in the adipocyte progenitor pool. BMC Med 2023; 21:50.
[12] Neri C, Edlow AG. Effects of Maternal Obesity on Fetal Programming: Molecular Approaches. Cold Spring Harb Perspect Med 2015; 6:a026591.
[13] Shrestha A, Prowak M, Berlandi-Short V-M, Garay J, Ramalingam L. Maternal Obesity: A Focus on Maternal Interventions to Improve Health of Offspring. Front Cardiovasc Med 2021; 8:696812.
[14] Torres-Espinola FJ, Berglund SK, García-Valdés LM, Segura MT, Jerez A, Campos D, Moreno-Torres R, Rueda R, Catena A, Pérez-García M, Campoy C, PREOBE team. Maternal Obesity, Overweight and Gestational Diabetes Affect the Offspring Neurodevelopment at 6 and 18 Months of Age--A Follow Up from the PREOBE Cohort. PLoS One 2015; 10:e0133010.