破題衰老還得劍指免疫!Cell重磅:中科院劉光慧組再出成果,提出“衰老據點”_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯1小时前

當被問到“衰老是什麼樣子”,你會回答什麼?皺紋、白髮、褪色的容顏?虛弱、蹣跚、佝僂的體態?或者説你是一位對衰老有深入研究的專業人士,你的答案是基因突變、功能障礙、生理紊亂?
不,不夠,這些都還只是模糊的概括,或是從某一點出發的“管窺蠡測”,相當於在衰老這片“森林”裏只看到了綠色或一棵單一的樹,想要攻破整個衰老,還得有更全面的視野才行!
最近,中科院高產選手劉光慧教授組同華大基因顧穎團隊在生物學頂刊Cell上聯合發文,以數十億基因的海量數據將衰老從“綠”細化到“每片葉子的紋路”,並開創性地從全局角度找到了全身性衰老關鍵之一[1]。


一開始本文的研究者們就奔着最全面、最廣泛去的,於是他們從年輕和年老小鼠身上精心選擇了9個關鍵組織展開“普查”:海馬、脊髓、心臟、肺、肝臟、小腸、脾臟、淋巴結和睾丸。
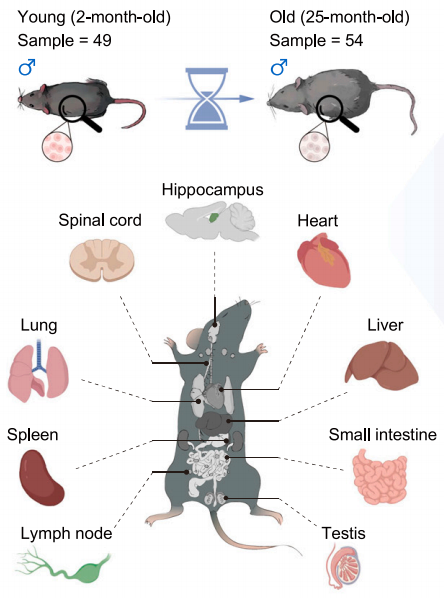
圖注:被選取的9個器官/組織都是小鼠核心組分
這些核心器官的衰老模式是怎樣的?又是哪一個器官最先感染上了衰老?
No.1
前奏——組織樣本細胞分析
初步的組織樣本細胞分析並沒能得出足夠細緻的結論,但研究者們找到了一些這些器官在衰老過程中存在的共性:CD45陽性免疫細胞增多、CD31陽性內皮細胞減少,前者與慢性炎症關聯,而後者指向血管神經等功能支持組織喪失。
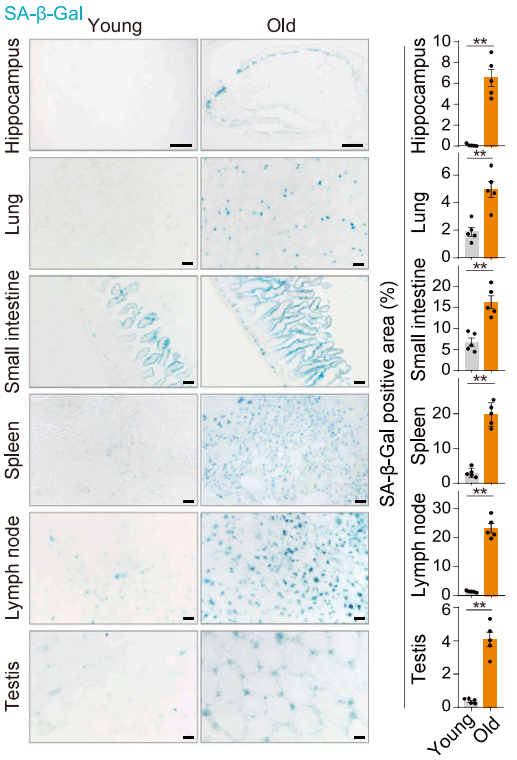
圖注:老年小鼠各器官存在相似程度的衰老,單從“衰老指標”很難找出差異
此外,就是各組織的特異性衰老表現,如海馬和脊髓中的小膠質細胞增多、心臟和腸道的纖維化水平升高等。
No.2
正篇——多點深入基因檢測
看不出明顯規律那就進一步深入,從9(器官數)到103(組織樣本數)到2,226,026,950(基因檢測總數),研究者們終於把原先“360p”的衰老帶入“8K”時代。

圖注:經過研究者的海量分析檢測,“衰老分辨率”有了質的飛躍
海量的樣本投餵也會帶來海量的數據,為了方便理解,本文的研究者們引入了一個名為**“組織結構熵(OSE)”**的概念。
眾所周知,“熵”這一源自正統自然科學但表現出靠近人文科學氣質的概念,代表的其實是一個相當玄學的含義——混亂度,有科學家曾因發出了“萬事萬物都終走向熵增”的哲學之語被廣泛質疑,但在本項研究中對“衰老”這一限定範圍而言,這句話的確沒錯。
所有組織的OSE值都會因為年齡的增加而增加,其中海馬、脾臟、淋巴結和肝臟的變化更明顯,表現為結構的破壞和原先固定於某一組織範圍的特定細胞的擴散;
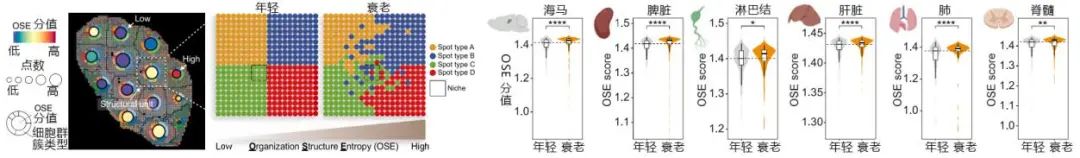
圖注:研究者提供了一個很好理解的OSE模型,並發現OSE在不同器官中隨年齡增長而增長
與因細胞“離家出走”造成的組織結構紊亂同時出現的,還有組織內細胞身份的丟失,比如在肝臟中,就存在維持正常肝功能的肝細胞隨衰老的進程不斷“墮落”成脂肪細胞的現象。身份的丟失和細胞擴散一樣,都是推動其所在組織器官功能喪失的源源動力之一。
No.3
華彩——SSSs“衰老據點”確定
在精確的OSE數據基礎上,研究者們才得以揭開一直以來蒙在衰老之上、名為“總體”的面紗,找到這些組織的真實衰老模式:
即使是在同一器官組織內,不同類型細胞的衰老速度也是不一樣的,再加上器官原有的秩序和結構性,就導致了**“重點高度衰老位置”的出現,研究者們綜合基因情況將衰老得分前5%的區域單獨劃出,命名為SSS**。
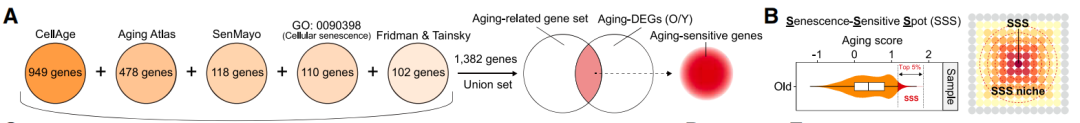
圖注:SSS衰老據點的挑選方法和標準
研究者們證明,作為深植器官組織的衰老病灶,SSS發揮着驚人的“據點”作用:
衰老分數、OSE分值和細胞身份丟失程度都在SSS點達到頂峯,然後隨着與SSS點距離的增大而降低;
在SSS中,體液免疫反應和補體激活升高,並有更高的衰老相關分泌表型(SASP)評分。前者和器官衰老的大特點一致,後者可能指向SSS的衰老“潛移默化”作用:以SSS為中心,周邊區域都會成為“衰老高危區”;
除了本身性質和環境,SSS似乎還有派遣“小兵”的能力,並通過它們將衰老更高效地傳播到更遠區域……
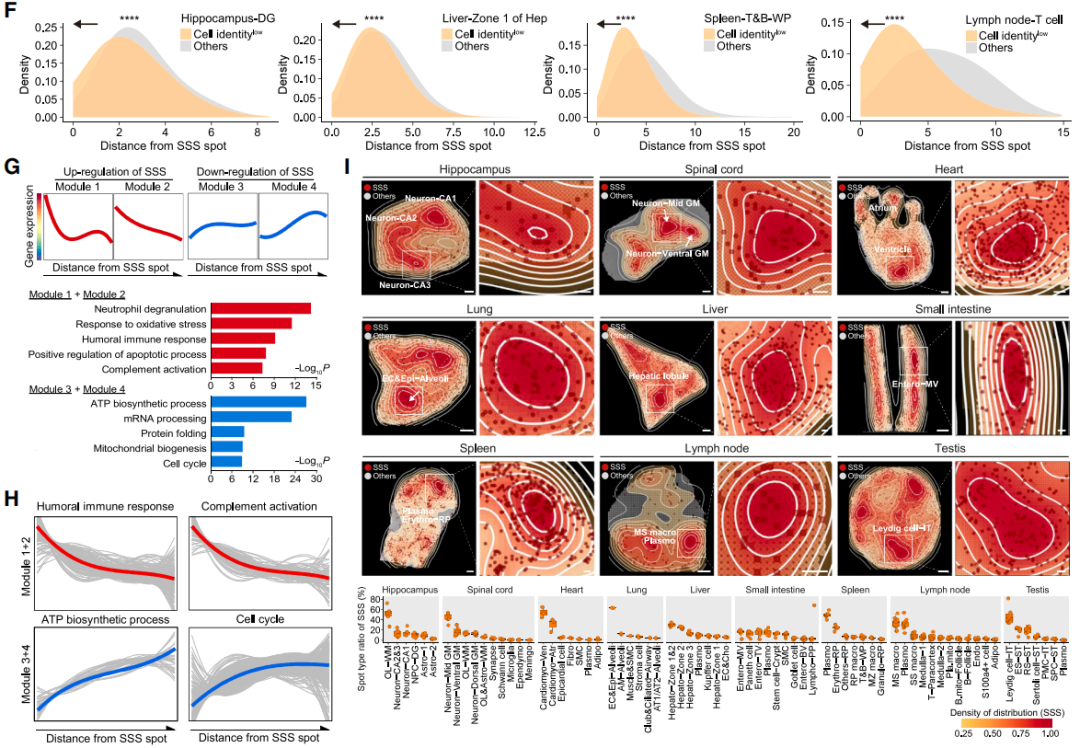
圖注:各器官中的SSS都保持了上述3個特點

關於嶄新的SSS概念,前兩點要麼與初步實驗結果契合,要麼在更早的研究中早有體現,但最後一點就顯得格外新奇,“小兵”是什麼?
經檢測,這種廣泛出現在所有成分SSS、並能脱離SSS發揮促衰傳播作用的物質,竟然是免疫利器——抗體。
免疫系統是維持體內安全穩定的特殊力量,那細胞毒性T細胞和漿細胞就是奮戰在對抗內外源病原體一線的兩大力量。前者單純靠“武力”,能暴力吞噬或破壞病原體結構;後者是“技術流”,主要負責分泌對病原體有粘附和“高亮”作用的抗體來達到場控作用。
圖注:對抗病原體的免疫系統兩大“巨頭”
按道理説,衰老細胞本身就屬於“病原體”範圍內的一員,但在近幾年的衰老相關研究中T細胞早已翻車,因為它們不僅能殺滅病原體,還能引起炎症,肆意出現的慢性炎症被證明是重要衰老標識;而現在,這翻車也輪到後者B(漿)細胞了:
當一小撮細胞成為一個SSS衰老據點,那麼不論它們原來是什麼功能細胞,現在它們都會開始高表達免疫相關基因,如Igkc、Jchain (Igj)、Ighg1、Igha、C4b等,然後,漿細胞、少突膠質細胞(神經支持細胞的一種)甚至心肌細胞,都開始分泌抗體了!
這種“衰老抗體”緊緊圍繞在SSS區域及其周邊,並隨着年齡的增長和SSS一樣在各組織器官裏不斷積累。
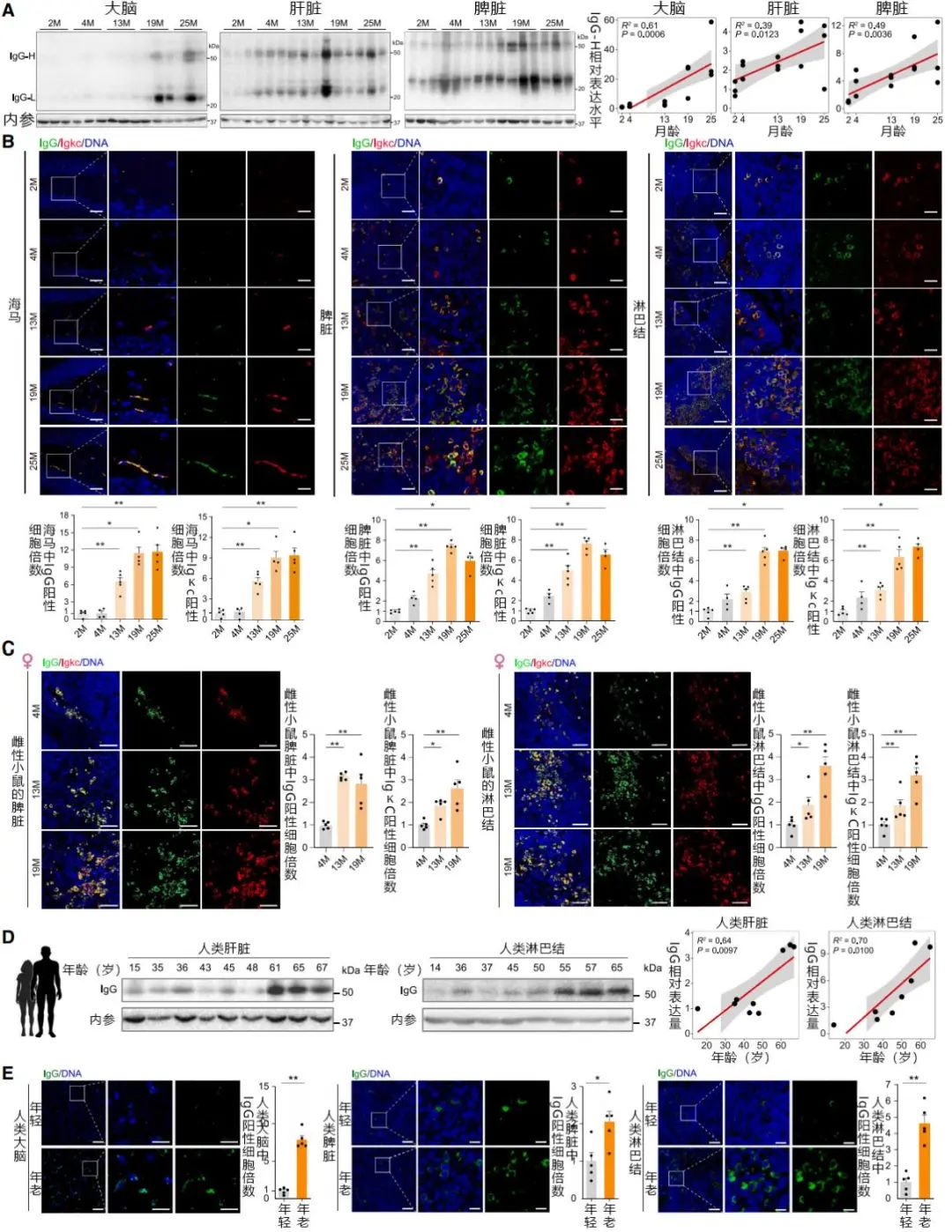
圖注:圖中的IgG和IgκC都是常見“衰老抗體”,在小鼠或人類體內這類抗體都隨年齡增長而增加
除了作為各組織器官中衰老重點的標誌外,衰老抗體還具有比SASP更強勁的“衰老感染力”。研究者們從SSS點提取了佔比最高的衰老抗體IgG,然後將它加到年輕人/鼠正常巨噬細胞、小膠質細胞的培養環境中。
很快,這些細胞就老了,無一倖免。尤其是還作為免疫系統重要成分的巨噬細胞,在迅速衰老的同時還轉變成了促炎型,如果不是被侷限在培養皿中甚至準備去坑其他組織細胞一把。
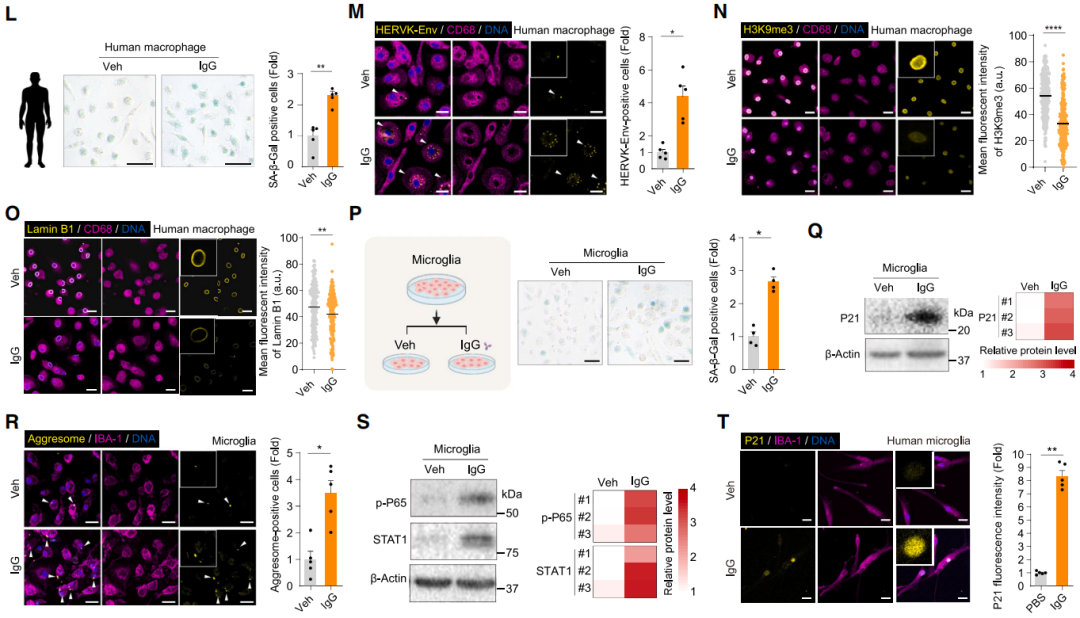
圖注:人巨噬細胞和小膠質細胞在IgG環境中加速衰老
單純對細胞的影響可能還不夠直觀,研究者又給6月齡(約等同於人類剛成年)小鼠連續腹腔注射衰老IgG。
100天后,原本應當正處壯年(約為人類30歲)的實驗小鼠也老了,由內而外的那種,表皮可能還看不出啥,但脾臟、淋巴結、海馬、肺和心臟都已經積累了相當多的衰老標誌物(p21等)、促炎細胞因子(IL-1β等)和纖維化指標。
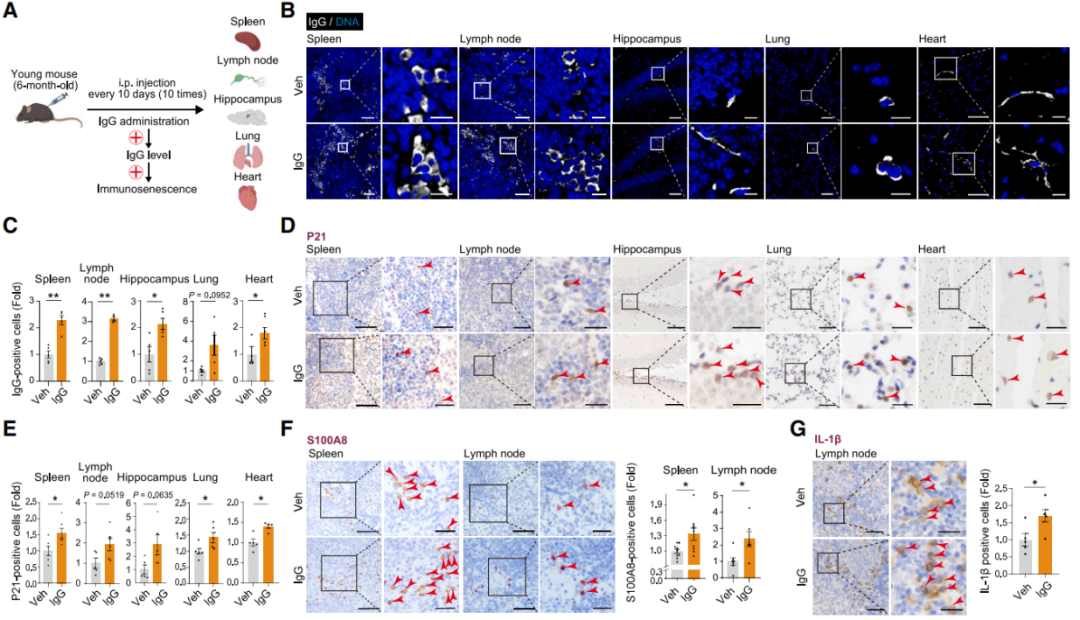
圖注:注射IgG100天后,年輕小鼠體內的衰老和纖維化指標水平大幅上升

衰老據點SSS和它的小兵衰老抗體,組成了全新、但更清晰的衰老圖景,同時也提示人類:不想讓自己的身體成為一片狼藉的戰場?那你得抓緊抗衰了!
既然只要變成SSS據點,不論原先什麼身份/功能的細胞都無法控制自己開始分泌抗體,那從源頭出發消滅漿細胞或者躲避病原體就不再可行,於是在本項研究中,研究者們採用的對策是專門針對IgG的****Fcgrt反義寡核苷酸干預法。
除了數量多、佔比高,IgG能作為衰老抗體中的主力,還因為它不好消滅、特別頑固。別的正常抗體做完了本職工作就會被安排下線,但IgG有一套獨特的回收再循環系統:FcγR。只要同FcγR結合,IgG就能逃脱被降解的命運,一直保留下來[2]。
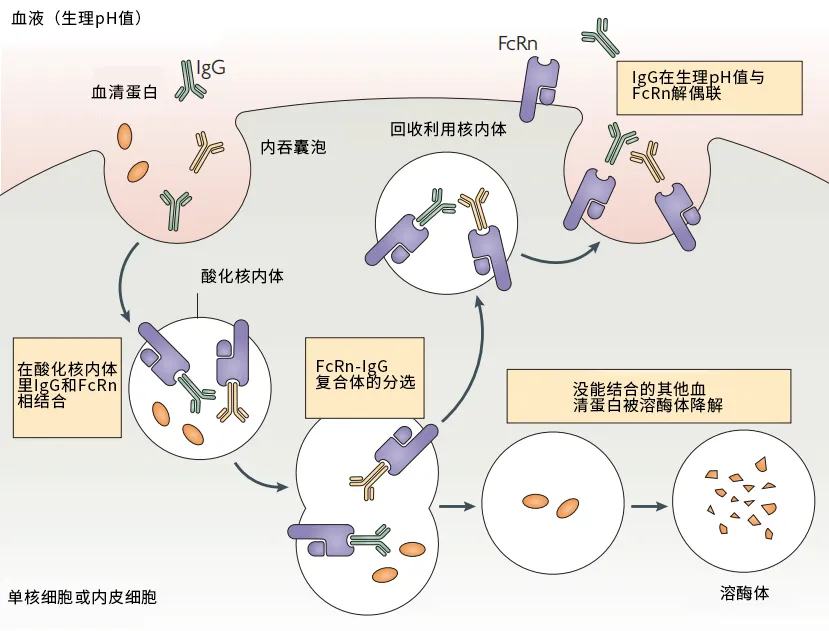
圖注:IgG回收再利用
Fcgrt反義寡核苷酸雖不能直接針對IgG,但能阻滯回收IgG的FcγR表達,間接消耗IgG。本研究中,與腹腔注射IgG正好相反,給19月齡中年小鼠注射Fcgrt反義寡核苷酸能在短短40天內將各器官內的IgG水平降低一半甚至更多,衰老標誌物也同步降低;
之前還有類似研究證明,直接敲除Fcgrt基因或能將小鼠壽命延長12%,並同步延長健康期[3]。
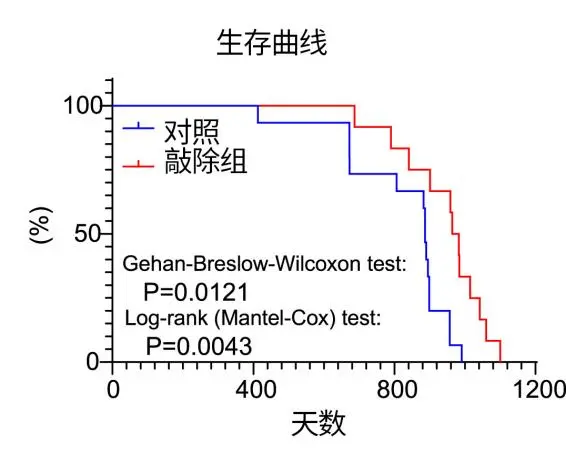
圖注:敲除Fcgrt基因能延長小鼠壽命12%
而除了這種相對複雜、涉及基因層面的解決方法,本文研究者們也提出了更貼近生活的方案:“成熟的抗衰老策略,如長期鍛鍊和接觸年輕體液(即換血抗衰中的血漿置換法)也能減輕衰老組織中IgG和衰老細胞的積累”。
總之,SSS找到了,衰老抗體也找到了,衰老具體模式和關鍵點都已在握,剩下的就是“解決它”,那在此之前,不如先按照研究者們建議的那樣,鍛鍊起來呢?
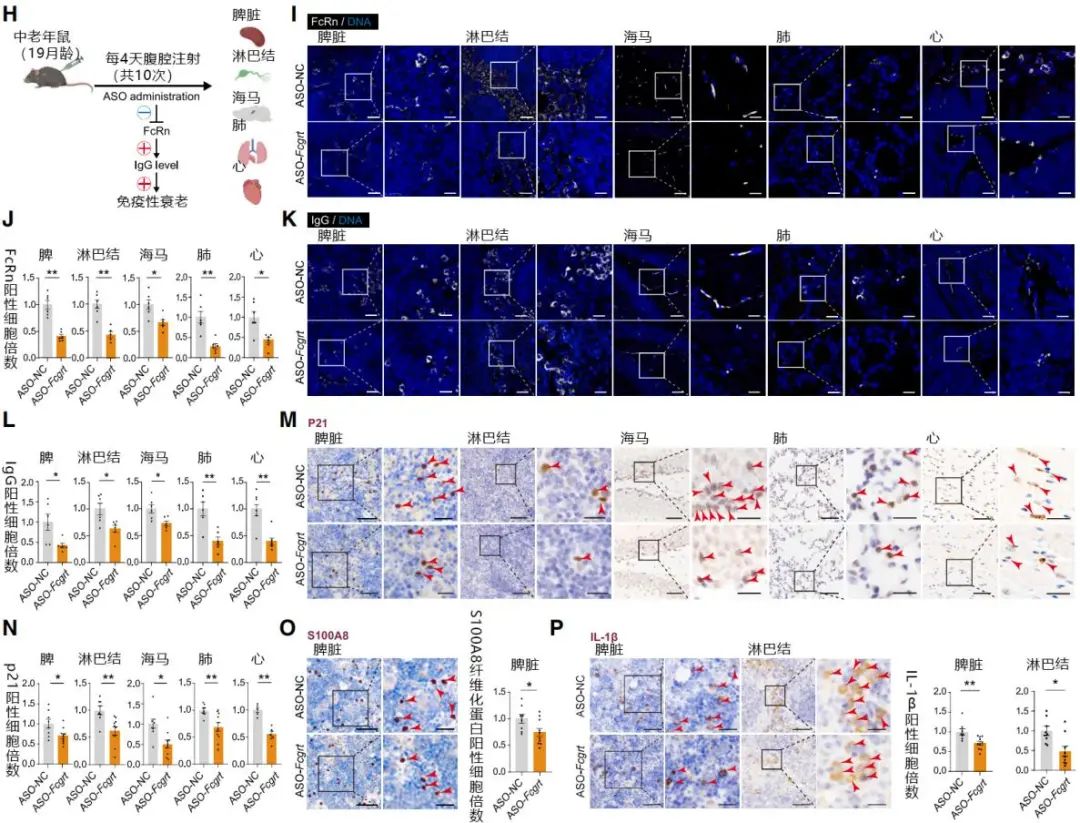
圖注:Fcgrt反義寡核苷酸能降低小鼠IgG、衰老標誌和纖維化標誌
[本文標題為《Spatial transcriptomic landscape unveils immunoglobin-associated senescence as a hallmark of aging》,發表在生物學頂刊《Cell》上,通訊作者為中科院劉光慧教授、張維綺研究員、曲靜研究員和華大生命科學研究院顧穎博士,第一作者為Shuai Ma、Zhejun Ji、Bin Zhang、Lingling Geng、Yusheng Cai、Chao Nie、Jiaming Li、Yuesheng Zuo、Yuzhe Sun、Gang Xu。本研究得到了國家自然科學基金(82125011、82488301、82322025、81921006 和 82122024)、國家重點研發計劃(2020YFA0804000、2022YFA1103700、2020YFA0112200、2021YFF1201000、2021YFA1101401、2022YFA1103800、2022YFC3602503、2022YFA1104701、2023YFC3504301、2020YFA0113400 和 STI2030-重大項目-2021ZD0202400)、國家自然科學基金(92149301、92168201、82330044、32341001、92049304、92049116、32121001、82192863、82361148131、82271600、32200610、82371570、82201727、82301758、32300980、82071588、82230043、82361148130 和 8231101626)、中科院基礎研究青年科學家計劃(YSBR-076、 YSBR-012、YSBR-036)、中科院青年交叉學科團隊、北京市自然科學基金項目(Z230011、Z240018、JQ24044、5242024)、深圳市科技計劃(RCJC20221008092804002)、中科院信息化計劃(CAS-WX2022SDC-XK14)、XPLORER PRIZE 新基石科學基金(2021-1045)、北京市醫學科研機構公益性發展改革試點項目(JYY2023-13)、中科院青年創新促進會(E1CAZW0401、2022083、2023092、2020085)、中國科學院青年科學家資助計劃(2021QNRC001)、中國科學院動物研究所自主科研計劃(2023IOZ0102和2023IOZ0202)、北京市新星計劃(20240484493)、首都醫科大學優秀青年人才計劃(12300927)、浙江省阿爾茨海默病重點實驗室(ZJAD-2024001)、北京附屬醫學研究院技術發展項目(11000023T000002036310)、北京市屬高校教師隊伍建設優秀青年人才培養計劃(BPHR202203105)的支持。]
參考文獻
[1] Ma, S., Ji, Z., Zhang, B., Geng, L., Cai, Y., Nie, C., Li, J., Zuo, Y., Sun, Y., Xu, G., Liu, B., Ai, J., Liu, F., Zhao, L., Zhang, J., Zhang, H., Sun, S., Huang, H., Zhang, Y., Ye, Y., … Liu, G. H. (2024). Spatial transcriptomic landscape unveils immunoglobin-associated senescence as a hallmark of aging. Cell, S0092-8674(24)01201-7. Advance online publication. https://doi.org/10.1016/j.cell.2024.10.019
[2] Roopenian, D. C., & Akilesh, S. (2007). FcRn: the neonatal Fc receptor comes of age. Nature reviews. Immunology, 7(9), 715–725. https://doi.org/10.1038/nri2155
[3] Lo, K. A., & Sun, L. (2013). Turning WAT into BAT: a review on regulators controlling the browning of white adipocytes. Bioscience reports, 33(5), e00065. https://doi.org/10.1042/BSR20130046