Kirkland教授:骨硬更易患骨質疏鬆,不如來點“刺激”一解脆骨愁!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯1小时前

作為“沉默的流行病”, 骨質疏鬆似乎已成一個不容小覷的公共衞生難題。據美國CDC發佈的最新數據顯示[1],50歲+的人羣中,其患病率高達12.6%,低骨量的情況更是達到43.1%。照這趨勢,預計到2025年,與年齡相關脆性骨折的經濟負擔可能將超過250億美元。
真是讓人捏一把大汗,最近,Senolytic療法的先驅,來自西達賽奈醫療中心的Kirkland教授的最新研究説不定為你對骨質疏鬆症的擔憂帶來了新的希望:“來點刺激”可能有助於恢復衰老骨細胞的功能,改善骨骼健康[2]!


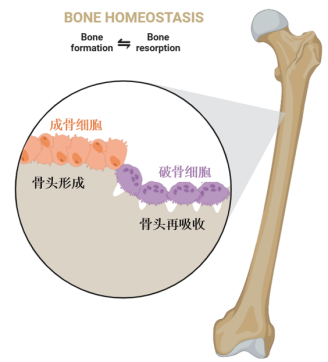
作為一種以骨量減少、骨結構惡化為特徵的骨骼疾病,骨質疏鬆症不僅增加了骨折的風險,更嚴重影響了患者的生活自理能力。説到骨質疏鬆,繞不開的一定是這倆活寶:成骨、破骨細胞。
破骨細胞[3],是由單核細胞或巨噬細胞前體合體形成,擅長分泌酸性磷酸酶和蛋白酶溶解骨骼中的羥基磷灰石晶體,並將其吸收回血液以備不時之需[4];相對地,位於骨骼表面的成骨細胞[5]負責生成新骨**,通過分泌與鈣離子結合的蛋白質,形成羥基磷灰石晶體,促進骨骼生長與礦化。**
圖注:成骨、破骨細胞平衡系統
這對骨界“雙胞胎”,在我們身體中相互配合,共同守護骨骼健康。不過,要是破骨細胞嗨過了頭,吸收骨質的速度超過了建骨速度,就會導致身體骨密度下降,引發骨質疏鬆風險[6]。
破骨、成骨細胞的平衡很重要,但我們還得給那些被自己分泌的骨基質“封印”的骨細胞一點關注,沒錯,就是那些“樸實無華”、名字就這麼簡單的骨細胞,佔據骨骼的80%-90%,曾被認為只能“佔位”,但在本文研究者的探索下,逐漸展示出了它們真正的實力[7]。

不要以為深埋骨內就只能當個“吃瓜羣眾”,骨細胞可以感知傳遞外部的機械刺激,所以主要負責將這種刺激轉化為細胞內信號,激活內部細胞信號通路參與骨骼的形成和重塑。而且要是稍有不慎,這些“吃瓜羣眾”,很可能給你的骨骼系統來個迎頭痛擊。
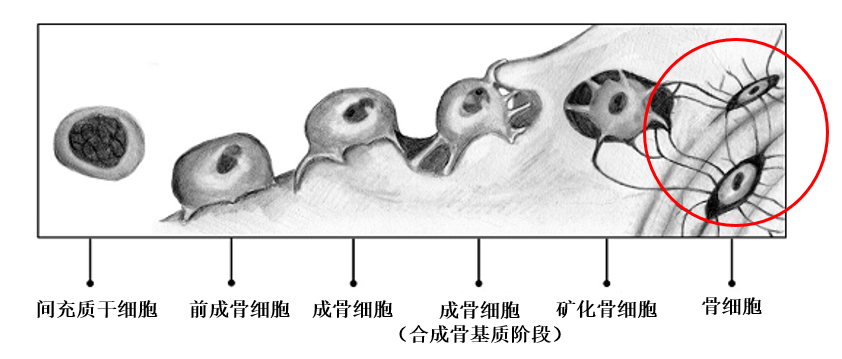
圖注:骨細胞的形成過程
隨着衰老,骨細胞內部的細胞骨架(即撐起細胞、維持細胞形態的結構)會發生結構變化,彈性與靈活性降低,阻礙了力的傳導,進而削弱骨細胞的力感知能力。
同時在外部,衰老骨細胞還會表達SASP(衰老相關分泌表型),進一步改變骨微環境,導致骨形成減少、骨吸收增加、其他骨細胞功能下降,加劇骨質疏鬆風險。

為什麼有這樣的變化?不如先來看看基因怎麼説,對衰老骨細胞的基因表達量進行檢測後,作者發現,在骨細胞中,衰老相關基因的表達水平發生顯著變化,其中最突出的當屬Sost、Mepe和Mmp9這三個。
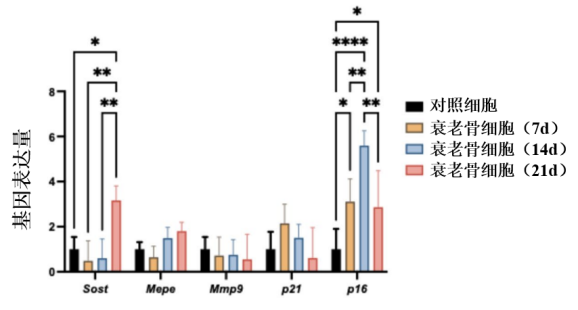
圖注:照射後不同時間點裏骨細胞中與衰老相關基因的表達水平變化
其中, Sost是一種能抑制Wnt/β-catenin信號通路(在骨形成和骨重建中發揮重要作用)的蛋白,其上調錶明成骨細胞的分化和骨基質的形成受到抑制,導致骨形成減少;
而Mepe是一種與骨礦化相關的蛋白,其表達增加則是因為**骨細胞在試圖維持骨基質的完整性,**其上調是對衰老引起的骨減少的一種適應性反應;
對於參與細胞外基質降解的酶Mmp9,它表達的降低會導致細胞外基質降解減少,從而導致細胞外基質過度沉積,影響衰老骨細胞骨組織的彈性和功能。
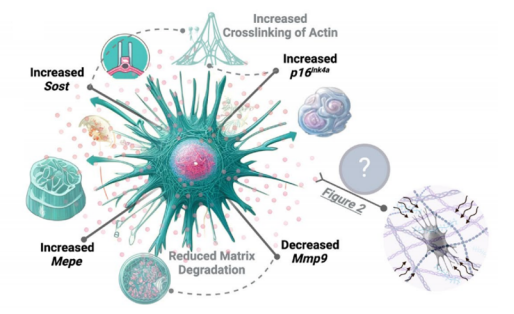
圖注:衰老照射後骨細胞中與骨細胞功能相關的基因表達發生不同的變化
總之,這些基因的變化反映了衰老骨細胞在細胞骨架結構和機械特性上的改變,所以我們可以去檢測衰老骨細胞中的這些基因表達量,從而提前預知自己骨細胞是否已經衰老……對嗎?

當然不是!本項研究的作者大大提到一個觀點:**目前常用的檢測衰老的生物標誌物,例如SA-β-Gal活性、衰老相關基因表達等,不僅在不同細胞和組織間差異顯著,而且還受到性別等其他因素的影響,**這就導致了它們的可靠性沒我們想象的那麼高。
對此,作者從歷年研究中總結出了一個更合適的指標:**生物物理標記物!**這……生物這個詞也看得懂,物理也看得懂,這倆一結合……到底是啥?回憶一下我們之前聊的衰老引起細胞僵硬,沒錯,就是檢測骨細胞細胞骨架上的力學特性的變化(在細胞上做物理實驗,想想就刺激!)。

圖注:檢測方法大揭秘
説幹就幹,通過高級光纖干涉的納米壓痕技術,研究人員**對細胞骨架模量以及膜粘彈性變化進行了延時的單細胞分析,**發現衰老骨細胞在細胞骨架和細胞膜上,會發生典型的生物物理變化,包括:
細胞骨架剛度增加
利用赫茲接觸力學模型,再搭配上負載壓痕數據。研究人員發現,輻射後的骨細胞在不同時間點(D7、D14和D21)的楊氏模量(衡量材料剛度的一個指標)相比對照組明顯增加,表明細胞變得更加僵硬。
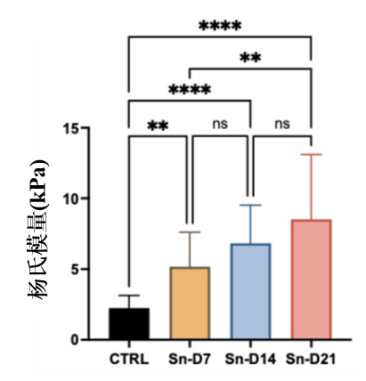
圖注:時間軸上,衰老細胞的楊氏模量穩步上升!
細胞膜粘彈性改變
與平穩的正常細胞不同,衰老細胞在納米壓痕實驗中迴歸基線的過程裏,出現了明顯的二次峯值,表明其細胞骨架的粘彈性質發生了改變,粘附力更高,導致細胞恢復到原始形態的速度比正常細胞慢。
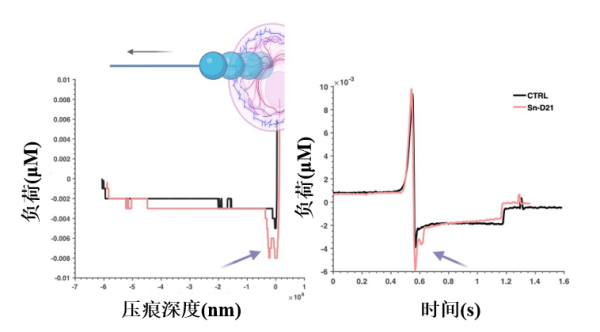
圖注:不同組細胞在卸載時的粘附力表現,差距不是一點點
細胞形態變化
當然,以上這些物理特性的變化,都是最直觀地反映在了衰老骨細胞的形態上。免疫熒光染色圖像還顯示,衰老骨細胞的體積膨脹,原有的勾連在一起的凸起部分(樹突網絡)斷裂,細胞邊界也是亂七八糟,完全沒有了對照組的規整模樣。
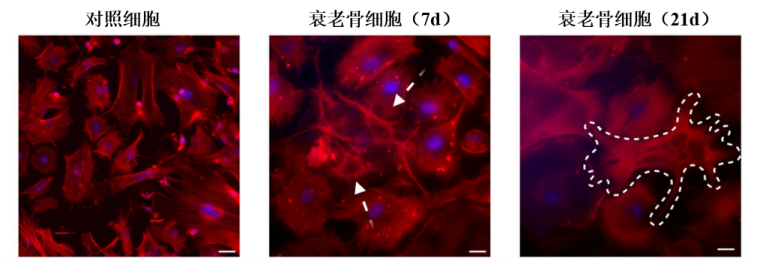
圖注:歲月催“胞”老……
串聯以上的研究結果,不難發現,隨着衰老,骨細胞的**細胞骨架變得僵硬,傳遞信號的應力纖維也減少,無法有效地感知外界環境的變化並傳遞機械信號至下游靶點(例如成骨、破骨細胞),從而影響骨重塑與維持骨強度的能力,**增加患骨質疏鬆的風險。
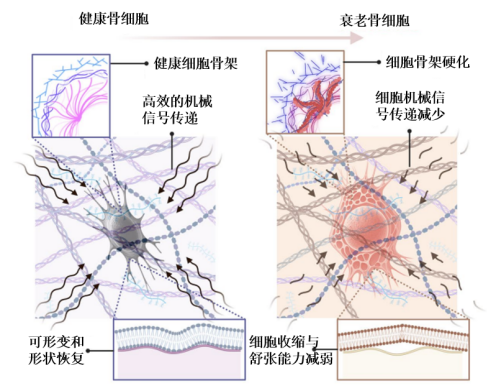
圖注:衰老骨細胞發生的變化

找到病因,那接下來就是對症下藥了,基於對生物物理標記的探索,作者也提出了一項治療骨質疏鬆的新招:生物力學刺激[8]。顧名思義,就是利用外界物理手段,比如機械拉伸、壓縮、電刺激等,給細胞或組織做個“SPA”,從而影響它們的行為和功能,實現治療效果。
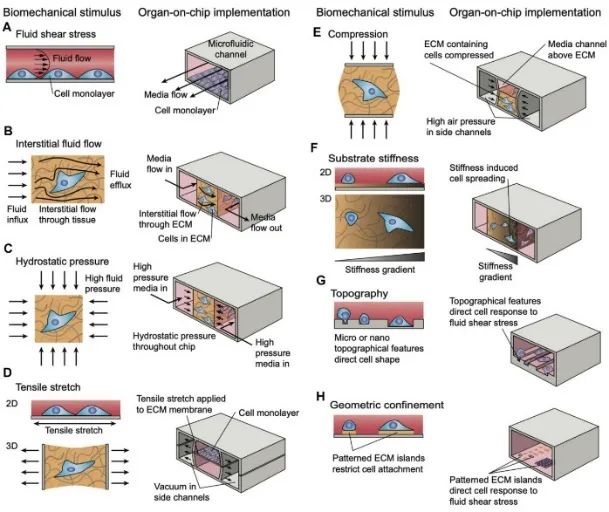
圖注:多種生物力學刺激對細胞行為的影響
這種力學刺激可以引發細胞的多種反應,比如調節基因表達與鈣離子內流,影響細胞的增殖分化、組織再生等[9],此外,它還能調整細胞外基質(ECM)硬度,或是改變流體動力學剪切應力(就像游泳時水流對你產生的推力)來提升細胞功能[10]。
雖然聽上去玄乎,但早已有不少研究已經在生物力學刺激改善骨質疏鬆方面做出成果:力學刺激可以通過激活多種信號通路(β-catenin信號通路、PGE2通路、NO通路等)影響骨細胞的增殖與分化,達到維持骨量,增加骨密度的目的[11]。
當然,一直讓你躺在實驗台上接受機械刺激,激活信號通路來治療骨質疏鬆,顯然不太現實,所以……來一場酣暢淋漓的八段錦[12]吧!
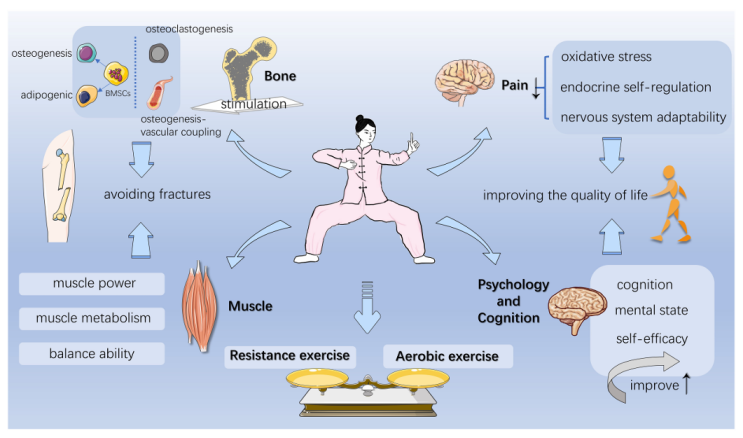
圖注:八段錦幫助治療骨質疏鬆症的神秘機制大公開
結合了有氧運動與阻力訓練的百家之長,鍛鍊八段錦能產生多種機械負荷(如張力、壓縮和流體剪切應力)來刺激骨細胞,在促進骨形成的同時還能減少骨質流失,增強骨密度,預防因年齡增長導致的骨質疏鬆。(真是科技與傳統的完美結合,看來每週來幾次八段錦還真挺有道理……)
時光派點評
讀完這篇研究,最讓派派驚豔的,還是從生物物理學角度,解析了細胞骨架力學****變化與衰老之間的關係。
當然,以上的這些發現還得經過後續研究的驗證,才能進一步探索開發例如針對細胞骨架重塑的藥物或者新型的生物力學裝置,這樣的抗衰大招,值得期待一手!
