上半年營收136.01億,創新藥撐起恆瑞醫藥的半壁江山
王力联系邮箱:[email protected] -联系电话:17621622896 欢迎交流
(文/王力 編輯/周遠方)8月27日晚間,恆瑞醫藥發佈公告稱子公司獲《藥品註冊證書》,其自主研發的1類新藥夫那奇珠單抗注射液獲批上市,用於治療中重度斑塊狀銀屑病。
值得注意的是,這是恆瑞醫藥在自免疾病領域的首個創新藥,打破了長期進口藥壟斷局面,為銀屑病患者提供新選擇。這是恆瑞醫藥今年在創新藥領域的又一成就。
不久前,恆瑞醫藥發佈2024上半年業績報告,公司上半年實現營業收入136.01億元,同比增長21.78%;上半年淨利潤34.32億元,同比增長48.67%。
值得注意的是報告期內,雖受集採影響恆瑞醫藥的仿製藥收入有所下滑,但上半年創新藥收入達66.12億元,同比增長33%,加上對外許可收入1.6億歐元,創新收入總和已佔總營收的一半以上。
這也意味着,從快速仿製(fast-follow)到同類最優(best in class)再到首創新藥(first-in-class),恆瑞醫藥的創新藥已撐起營收的半壁江山,全球市場上,恆瑞醫藥為首的中國創新藥企也正開闢新的領地。
此外,就在半年報業績披露前不久,恆瑞醫藥宣佈聘任徐學健為副總經理、首席質量官,全面負責質量管理工作,此舉一度被市場解讀為對國際化挑戰的積極應對。
今年上半年,恆瑞醫藥在連雲港的一個製劑生產設施接到了來自美國食品藥品監督管理局(FDA)的警告信。儘管這一設施向美國市場出口的產品收入在恆瑞的整體收入中佔比較小,但此事件仍然一度引發了市場的擔憂情緒。
公開資料顯示,徐學健擁有豐富的製藥行業經驗和學術背景,曾在藥明生物、藥明康德及FDA擔任高級職位,他的加入或將為恆瑞醫藥帶來國內外GMP法規和製藥行業精益化運營管理的先進理念,也有望助力公司創新藥的研發和國際化戰略的推進。
創新藥營收佔比過半,二季度研發費用創新高
8月21日晚間,恆瑞醫藥發佈了其2024年上半年的財務業績報告,報告期內公司實現營收與利潤的增長。
報告顯示,恆瑞醫藥上半年實現了136.01億元的營業收入,相較去年同期增長了21.78%;同時,公司歸屬於上市公司股東的淨利潤為34.32億元,同比增長48.67%,扣除非經常性損益後的淨利潤為34.90億元,同比增長55.58%。
從業務構成方面來看,恆瑞醫藥的創新藥業務表現突出,成為公司業績增長的主要驅動力。報告期內,公司創新藥收入(含税,不含對外許可收入)達到66.12億元,同比增長33%。
具體到產品層面,瑞維魯胺、達爾西利、恆格列淨等進入醫保目錄後的創新藥產品收入實現了快速增長;阿得貝利單抗被多地納入“惠民保”特藥報銷目錄,其收入貢獻進一步擴大;海曲泊帕獲得多項臨牀指南推薦,銷售收入持續穩定增長。然而,這些產品的增長動力主要來源於政策利好和市場準入門檻的降低,而非產品競爭力的顯著提升。
值得注意的是,上半年恆瑞醫藥從Merck Healthcare處獲得了1.6億歐元的對外許可首付款,這一收入在公司的中期報告中“非主營業務導致的利潤重大變化説明”部分得到了特別提及,指出由於這一筆收入的確認,公司的利潤實現了較大幅度的增長。
對此,一些市場分析人士指出,在排除來自Merck Healthcare的1.6億歐元(摺合人民幣約12.7億元)收入後,恆瑞醫藥在第二季度的營收仍實現了接近12%的同比增長。然而,若進一步計入15%的所得税影響(即扣除約10.8億元人民幣的利潤),則公司的歸屬母公司淨利潤呈現同比下降趨勢。實際上,這一現象與二季度研發投入的大幅增加也有關。
具體來看,今年上半年恆瑞醫藥的研發費用達38.60億,同比增長26.23%,二季度研發費用18.18億元成為史上研發費用最高單季,佔營收的比重由上年同期的20.83%上升至本期的23.91%。
就在財報披露後不久,8月27日晚,恆瑞醫藥宣佈其子公司蘇州盛迪亞生物醫藥有限公司獲得國家藥監局簽發的《藥品註冊證書》,批准自主研發的1類新藥夫那奇珠單抗注射液上市,用於治療中重度斑塊狀銀屑病成年患者。這一創新藥標誌着恆瑞醫藥在自免疾病領域的突破,打破了同類進口藥物的壟斷局面。
夫那奇珠單抗是一種針對人IL-17A的重組人源化單克隆抗體,用於治療與IL-17通路相關的自身免疫疾病,如銀屑病。該病是一種無法根治的自身免疫性皮膚病,而夫那奇珠單抗的療效已得到臨牀數據的支持。

截圖來自恆瑞醫藥公告
此外,夫那奇珠單抗還針對銀屑病關節炎、成人活動性強直性脊柱炎等疾病開展臨牀研究,其中治療活動性強直性脊柱炎的項目已進入上市申報階段。目前,全球已有三個IL-17A抗體藥物上市,包括Secukinumab、Ixekizumab和Netakimab,2023年Secukinumab和Ixekizumab的全球銷售額合計約77.40億美元。
然而,報告期內收集採影響,仿製藥營收有所下降。2024年3月,第九批國家集採涉及恆瑞的產品注射用醋酸卡泊芬淨在上半年銷售額同比減少了2.79億元。同時,地方集採涉及的產品中,碘佛醇注射液和吸入用七氟烷及鹽酸罌粟鹼注射液上半年銷售額也同比減少了2.76億元。兩者合計,共減少了5.55億元。
面對集採的挑戰,公司正在加速轉型創新,加大創新藥研發投入,加快創新藥的研發上市進程,以減少對仿製藥業務的依賴。同時,恆瑞醫藥還在優化產品結構,逐步減少低附加值仿製藥的生產,加大高附加值仿製藥和創新藥的研發和生產力度。
新任首席質量官亮,海外BD模式創新與質量挑戰並存
近年來,恆瑞醫藥積極拓展美國等海外市場,而就在今年7月中旬,恆瑞醫藥連雲港製劑廠收FDA警告信,這封警告信列出了兩條缺陷,主要涉及質量控制部門在文檔監督和控制方面的不足,以及設施設計不充分導致的無菌產品生產區域污染或混淆風險。
儘管該場地2023年出口美國市場產品的收入僅佔恆瑞醫藥年度營業收入的0.39%,但對於一家正在積極進軍國際市場的國內大藥企來説,任何質量問題都是不容忽視的。地緣政治緊張下,恆瑞為代表的中國藥企面臨複雜環境,仿製藥入美路難,創新藥也挑戰重重。
此後7月29日晚,恆瑞醫藥發佈公告,聘任徐學健為公司副總經理、首席質量官,全面負責公司的質量管理工作。徐學健的加入,無疑將為恆瑞醫藥帶來國內外GMP法規和製藥行業精益化運營管理的先進理念,同時業內也普遍認為這一任命背後,是恆瑞醫藥在面臨國際化挑戰時的積極應對。
徐學健擁有豐富的製藥行業經驗和深厚的學術背景,他曾在藥明生物和藥明康德擔任首席質量官和高級副總裁,也在美國食品藥品監督管理局(FDA)擔任過高級CMC評審員。他表示,將持續優化質量文化建設和cGMP管理能力,全面提升生產質量國際化管理水平,助力公司創新藥研發和國際化戰略發展有序推進。
在人才戰略方面,恆瑞不斷夯實高質量人才梯隊、完善人才激勵機制。上半年,除徐學健外,先後在美國強生、美國施貴寶等跨國藥企擔任臨牀研發負責人的延錦春博士加入恆瑞任副總經理,全面負責所有腫瘤產品和核藥產品醫學策略及臨牀研究,他的加入將進一步強化恆瑞醫藥在腫瘤產品和核藥產品醫學策略及臨牀研究方面的實力。
在堅持創新戰略的背景下,恆瑞醫藥近年來在腫瘤和慢病領域持續深耕,並加速技術平台的建設。其創新藥及新適應症不斷獲得批准,今年上半取得創新藥臨牀批件57個,10項臨牀推進至Ⅲ期,20項臨牀推進至Ⅱ期,19項臨牀推進至Ⅰ期,公司有90多個自主創新產品正在臨牀開發,300餘項臨牀試驗在國內外開展。今年上半年共取得4項CDE突破性療法認定,未來審批有望加速。
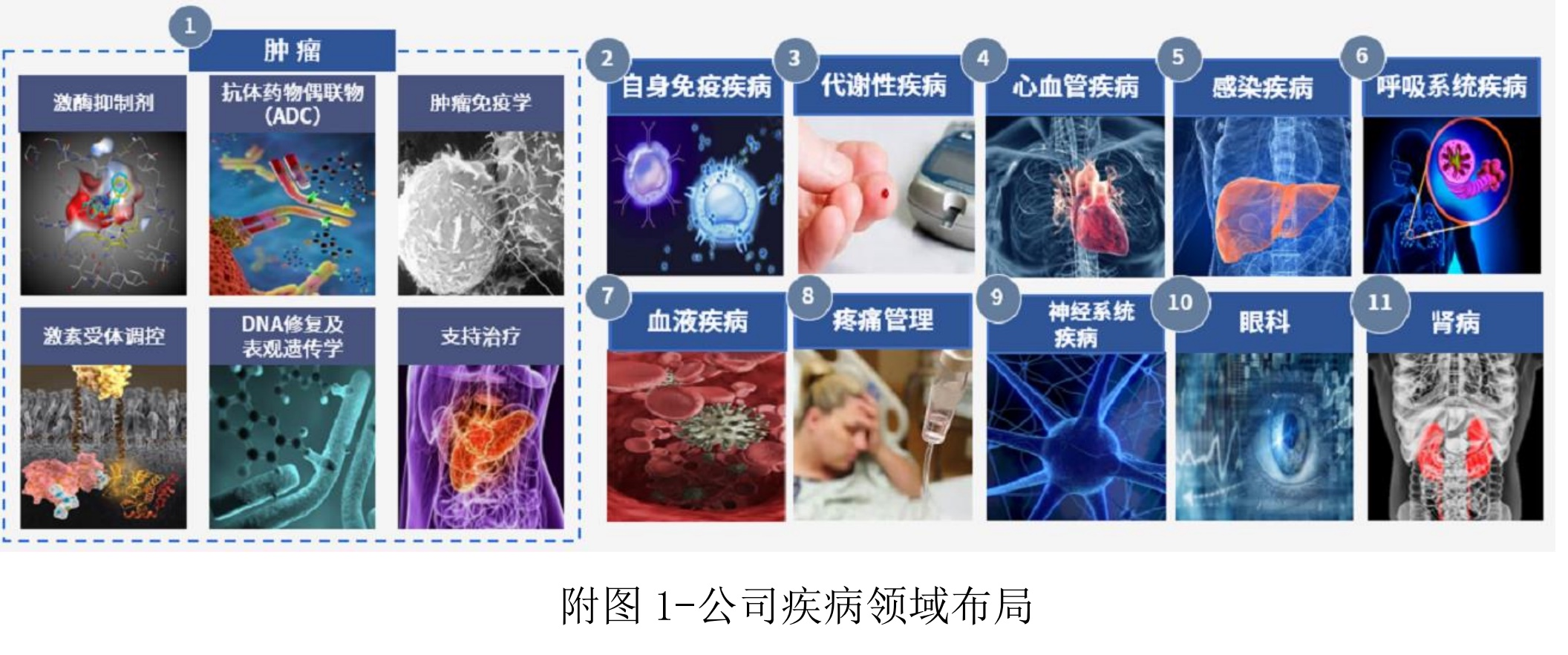
圖片來自恆瑞醫藥財報
憑藉強大的研發引擎,2024年上半年公司有13個自主研發的創新分子進入臨牀階段,涉及腫瘤、自免、呼吸、代謝、心血管和影像等多個疾病治療領域;目前公司ADC平台已有12個新型、具有差異化的ADC分子成功獲批臨牀,其中SHR-A1811(HER2 ADC)、SHR-A1921(TROP2 ADC)、SHR-A1904(CLAUDIN18.2 ADC)三款產品進入Ⅲ期臨牀;SHR-A1811已有6項適應症被CDE納入突破性治療品種名單。
在國際化戰略實施上,氟唑帕利、海曲泊帕等創新藥的多個國際多中心Ⅲ期臨牀試驗正有序開展,此外,SHR-A1912、SHR-A1921及SHR-A2102三款ADC創新藥更是獲得了美國食品藥品監督管理局(FDA)的快速通道資格認定。
為持續推動研發創新,恆瑞醫藥在全球範圍內廣泛佈局,已在連雲港、上海、美國及歐洲等地設立了14個研發中心,匯聚了一支超過5000人的全球研發團隊。報告期內,公司持續優化並完善化藥(含多肽、PROTAC)、單/雙抗體藥、ADC藥物、小核酸、核藥、多特異性抗體及雙抗ADC平台等成熟技術平台,並初步構建了PDC、AOC、DAC、mRNA等新分子模式平台,同時積極探索結構生物學、AI藥物研發等新興領域,不斷拓寬研發邊界。
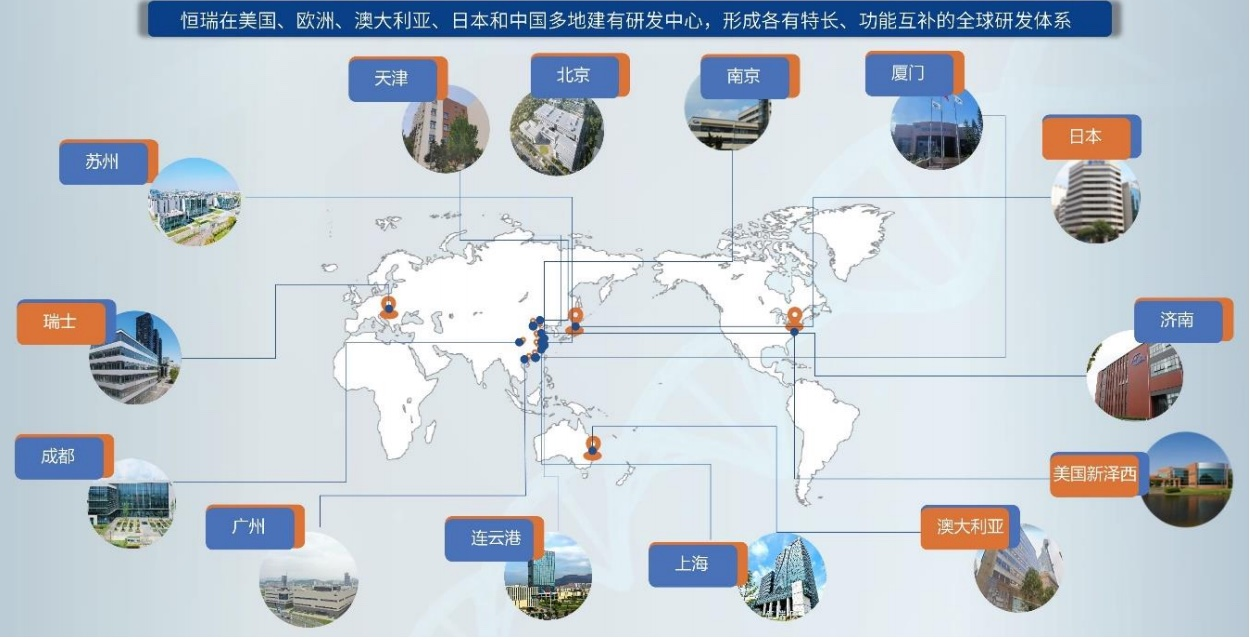
恆瑞醫藥全球範圍內研發中心圖片來自恆瑞醫藥財報
今年7月,公司的布比卡因脂質體注射液,獲得了美國FDA的上市批准,成為全球首個該品種的仿製藥,這顯示了公司在疼痛管理領域的創新努力得到了國際認可。此外,子公司成都盛迪的另一種藥物——他克莫司緩釋膠囊,也在今年年初在美國獲得上市許可,同樣作為該領域的首仿藥,加強了公司在免疫抑制劑市場的國際地位。
當前來看,恆瑞醫藥在創新藥研發與國際化征途雖面臨諸多挑戰,但亦穩步前行。徐學健及延錦春博士的加盟,為公司在質量管理與國際化戰略上注入了強勁動力。作為中國醫藥創新代表性企業,恆瑞為首的中國藥企也正在全球開闢新的疆域。