全球首例!中國醫生將豬肝植入人體_風聞
医学界-医学界官方账号-为你提供可靠、有价值的内容是我们的存在方式。1小时前
這一手術的順利開展,為豬肝移植未來走向臨牀挽救患者生命,提供了重要的理論依據。
**撰文 |**凌駿
責編丨汪航
今天(9日)中午,空軍軍醫大學西京醫院宣佈,在中國科學院院士竇科峯教授的領銜下,於1月7日成功將一隻多基因編輯豬的全肝,原位移植到一位腦死亡患者體內。
這是人類歷史上首次嘗試在人體內原位移植豬的全肝,竇科峯院士表示,這既是異種器官移植領域的重大突破,也是異種肝移植向臨牀邁進的關鍵一步。截至發稿,患者多項基礎生命體徵保持平穩。
全球範圍內,近年來學界已接連進行了豬心、豬腎的人體移植試驗,我國在異種大器官移植領域也有十餘年探索,現已進入全球第一梯隊。
成都中科奧格生物創始人潘登科教授和團隊培育了此次手術的移植用豬,他告訴“醫學界”,這一手術的順利開展,為豬肝移植未來走向臨牀挽救患者生命,提供了重要的理論依據。

把豬肝植入人體
據西京醫院報道,本次的供體豬肝臟重量約800克,來自一隻經過了6種基因改造的醫用豬。
移植受者此前因其他疾病,在醫院經全力搶救,多次評估後均認證為“已腦死亡”,家屬同意無償參與異種肝移植科學研究。移植實施方案先後通過了學術委員會、醫學倫理委員會、器官移植委員會和動物委員會論證,符合國際異種移植相關要求。
1月7日,手術由西京醫院肝膽外科竇科峯院士、陶開山教授主刀領銜,麻醉科、外科手術室、超聲科、腎臟內科、重症醫學科等十餘個科室共同參與。
從打開豬的腹腔開始,手術歷經供體豬肝切取、患者原肝切除、新肝植入、動靜脈重建、止血關腹等多個階段,歷時十餘個小時。
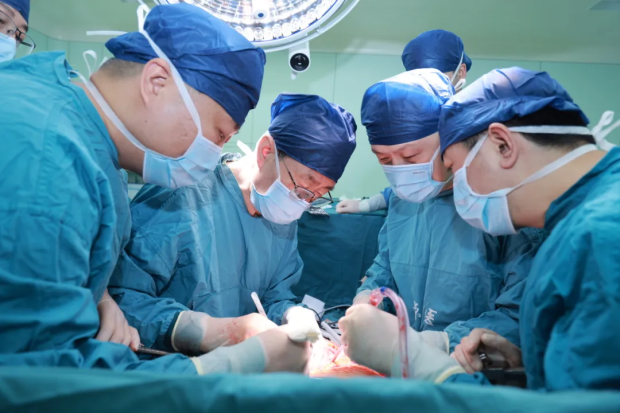
西京醫院肝膽外科竇科峯院士、楊詔旭副教授等為受體移植新肝 圖源:西京醫院微信公眾號
據報道,術中豬肝移植完成,開放血流後,肝臟血流灌注良好,隨即產生膽汁。這意味着豬肝已取代“原生肝臟”,在患者體內發揮正常的生理功能。
術後持續監測顯示,患者循環等基礎生命體徵平穩,肝功能等多項指標逐步趨於平穩,標誌着手術獲得成功。
事實上,早在2024年3月西京醫院就宣佈,在全球範圍內首次將豬肝以異位移植的方式,植入一位腦死亡患者的體內。
潘登科向“醫學界”解釋稱,“‘異位’代表着患者原有的肝臟仍得到保留,是在其它部位又植入了豬肝,可以理解為豬肝人體移植的初步可行性驗證。”
但異位輔助肝移植不切除受體自身肝臟,無法充分了解移植豬肝的生理替代功能。潘登科表示,“此次手術則完全依靠植入的基因編輯豬肝,就讓患者維持了相應的生理功能,這為豬肝作為急性肝衰竭的過渡治療挽救患者生命,提供了重要的理論依據。”
竇科峯院士則表示,從目前結果來看,基因編輯豬肝臟在移植後早期有可能替代人類肝臟。此次研究為未來的臨牀應用,提供了重要理論依據和技術支撐。
十餘年的豬器官移植探索
根據世界衞生組織統計,全球每年只有不到10%的器官移植需求能得到滿足。在我國,每年約有30萬末期器官功能衰竭患者需要移植,但器官的供需比僅為1:30。異種器官移植則不受供體器官數量限制,一旦成功,將挽救無數終末期器官衰竭患者的生命。
自2021年美國率先開展基因編輯豬的腦死亡患者腎移植以來,目前全球已完成了21例異種大器官人體移植,主要集中在心臟、腎臟、肝臟3大器官。
在這條路上,西京醫院的科學家團隊也已進行了十餘年的探索。
2013年,西京醫院完成了亞洲首例轉基因豬到猴的異種部分肝移植術,術後猴子存活14天,創造了當時國際同類實驗的存活紀錄。2022年,西京醫院又成功開展全球首例“6基因編輯豬猴多器官、多組織同期聯合移植手術”。
2024年3月10日和3月25日,西京醫院專家團隊正式將豬器官移植推進人體,接連成功完成腦死亡患者的“豬肝”“豬腎”移植,轟動國際學界。
潘登科團隊則從2013年開始,一直提供移植用豬。2010年,潘登科帶領團隊培育出中國第一隻“抗免疫排斥基因豬”,正式打開了中國異種大器官移植的新時代。據介紹,用於異種器官移植的不是普通級的豬,為了解決生物安全問題,這些基因編輯豬一出生就要被送進超潔淨豬舍,斷奶接受人工飼養。
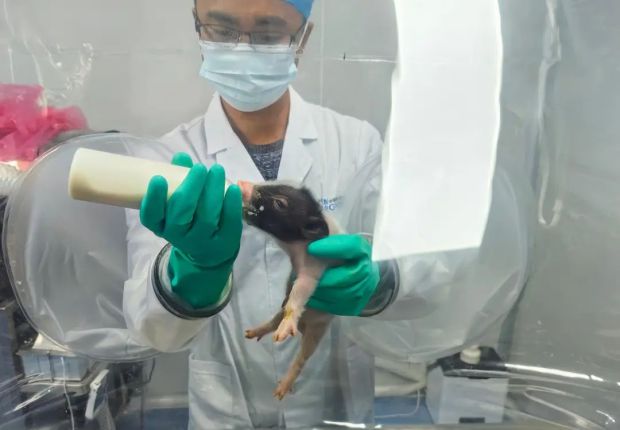
用於異種器官移植的基因編輯巴馬小型豬,斷奶接受人工無菌培養
經過多年的技術升級、優化和改進,西京醫院此次手術的移植用豬進行了“6基因編輯”,包括敲除了3種會引起人“超急性排斥和急性體液性排斥”的豬抗原,轉入了2種“人補體調節蛋白”和1種“人凝血調節蛋白”。
“事實上,早期豬的大器官移植存在諸多技術難點,臨牀應用前景也不被看好,很少有人願意投身其中。”潘登科告訴“醫學界”,“西京醫院醫生們前瞻性、有遠見的醫學思維,為我國這一領域的發展積累了諸多寶貴的經驗。”
以基因編輯的個數為例,潘登科告訴“醫學界”,國際上尚未有統一的共識和標準。“理論上,越多的基因改造可以讓豬器官越接近人體,但同時也會降低豬的存活率,並增加其他相關的潛在風險。”
器官移植中的“聖盃”
除了“移植本身”,移植器官的選擇也使得此次手術具有里程碑意義。在實施難度上,異種肝移植被認為是器官移植中的“聖盃”,放眼國際也鮮有開展。
“肝臟具有多項生理功能,參與了多項人體活動,要用豬肝完全替代人的肝臟,不匹配的問題更多,難度很大。”潘登科表示。
《器官移植》2022年7月刊文指出,豬肝產生的100多種蛋白質可能不會在人體內充分發揮作用。此外,人肝細胞和豬肝細胞在凝血蛋白表達、功能調節方面,存在物種特異性差異。這種差異可能導致凝血異常,從而影響移植肝臟的血液供應等。
竇科峯院士也介紹稱,相對於腎臟和心臟,肝臟涉及合成、分解、凝血、解毒和免疫等功能,解剖結構和生理功能更為複雜,因此,基因編輯豬肝臟移植技術的難度、科學意義更大。
潘登科告訴“醫學界”,此次手術的成功證明了,移植的豬肝能在早期行使正常生理功能。
據介紹,由於現階段豬肝移植的對象為“腦死亡患者”,需要依賴輔助醫療設備維持生命,再加上倫理相關問題,不可能無限期對患者進行試驗。此前,全球首例“腦死亡患者異位豬肝移植”術後觀察了11天,“因此患者數月後的急性、慢性排斥反應等情況還不得而知。”
但這並不影響豬肝移植的臨牀應用前景。
“短期內,豬肝移植最大的價值在於‘過渡肝’,幫助肝衰竭患者度過危險期,一部分急性肝衰患者的肝臟功能會慢慢恢復。”潘登科介紹。
西京醫院介紹,我國有近4億肝病患者,每年新增30萬-50萬肝衰竭患者。對於肝衰竭,肝移植是唯一有效根治方式。現實中,很多人因等不到人類供肝而失去生命。而異種肝移植不受供肝數量限制,可使更多終末期肝病患者獲益,未來可能替代同種肝移植。
值得一提的是,雖然看似天方夜譚,但異種器官移植離走上臨牀並沒有想象中那麼遙遠。
美國已有團隊表示,將正式向監管部門提出申請,有望在一年內全面推動豬器官移植進入臨牀試驗。我國則在2022年4月發佈了《中國人體異種器官移植臨牀試驗專家共識》,提出應本着“鼓勵研究、審慎發展”的態度,加強基礎研究,謹慎推進臨牀研究。
潘登科表示,相比國際,雖然我國異種器官移植研究的起步雖晚,但發展極快。
“之所以能逐步實現國際領先,正是因為我國的科學家多年來不懈地在動物研究中反覆進行驗證,覆盤每一次數據,在手術流程、移植技術、倫理層面不斷思考,才有瞭如今的成績。”潘登科説。