口服固體緩控釋製劑淺析之骨架型_風聞
山东大学淄博生物医药研究院-54分钟前
骨架製劑是緩控釋製劑的重要組成,因具有開發週期短、生產工藝簡易適於大生產、釋藥性能好、服用方便等特點被醫藥行業所重視。根據骨架材料的不同,一般分為親水凝膠骨架、生物溶蝕性骨架和不溶性骨架。本文將進行逐一介紹。
1.親水凝膠骨架製劑
親水凝膠骨架製劑的特點是骨架材料遇水或胃腸液後膨脹,形成凝膠屏障而控制藥物的釋放,其機理包括控制藥物通過凝膠層的擴散及凝膠的溶蝕。
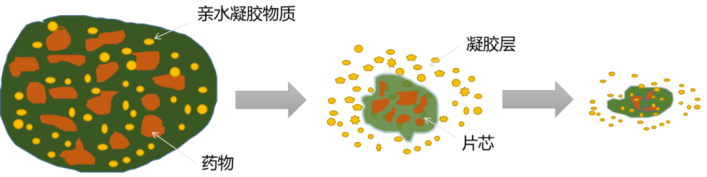
圖1 親水凝膠骨架製劑溶出示意圖(圖源自網絡)
目前工業上最常用的骨架材料為不同規格的羥丙甲纖維素(HPMC)、聚氧乙烯、海藻酸鈉和甲基纖維素等,其他如卡波姆、羧甲基纖維素鈉等也有使用。
高黏度的HPMC常作為緩控釋材料用於製備親水凝膠骨架製劑,低黏度型號則可用於緩釋及控釋片劑的致孔劑。骨架材料的關鍵指標會對釋藥產生顯著影響,如分子量、取代度和粒度。骨架材料的分子量越大(粘度等級越高),分子結構越複雜,緩控釋材料展開(玻璃態到凝膠態)過程也越長,藥物釋放就越緩慢。取代度是指在HPMC的分子結構中,羥丙基(HP)和甲氧基(MeO)的比例。不同的取代度會影響HPMC的溶解性、黏度等理化性質。其形成的凝膠骨架的速率也各不相同,進而影響着藥物的釋放速率。HPMC的粒徑對藥物緩控釋效果有直接影響,較小粒徑通常意味着更快的水化速率和更緊密的凝膠層網絡,從而可以顯著減慢藥物的釋放速度,特別是對於難溶性藥物。
親水凝膠骨架型製劑與傳統片劑製備方法相近,通常採用濕法制粒、幹法制粒、粉末直壓等方法制備。在濕法制粒工藝中,由於親水凝膠本身黏度較大,多數情況下不需另加黏合劑,同時由於骨架材料吸水後迅速膨脹,黏度增大,容易產生結塊現象,難以過篩,因此處方中常採用60%~95%的乙醇溶液作為潤濕劑。
常見的雙氯芬酸鈉緩釋片有鹽酸二甲雙胍緩釋片、富馬酸非索羅定緩釋片等眾多品種。
2.生物溶蝕性骨架製劑
生物溶蝕性骨架片的骨架材料為水不溶但可溶蝕的蠟質材料、胃溶或腸溶性材料等。這類骨架片隨着固體脂肪或蠟的逐漸溶蝕,通過孔道擴散與蝕解控制藥物釋放。常用的骨架材料有氫化植物油、硬脂酸、巴西棕櫚蠟、胃溶或腸溶丙烯酸樹脂、腸溶性纖維素等。一般水溶性較大的藥物可以製成溶蝕性骨架片。
製備方法常用的有熔融法和水分散法。熔融法是將藥物與輔料直接加入熔融的蠟質中,温度控制在略高於蠟質熔點,熔融的物料鋪開冷凝,固化、粉碎。水分散法是採用溶劑蒸發技術,將藥物與輔料的水溶液或分散體加入熔融的蠟質相中,然後將溶劑蒸發除去,乾燥混合製成團塊再顆粒化,之後進行壓片。
目前市場常見的溶蝕型緩釋片有硫酸嗎啡緩釋片、鹽酸羥考酮控釋片等藥物。
圖2 不同規格的鹽酸羥考酮控釋片(圖源自網絡)
3.不溶性骨架製劑
不溶性骨架片以水不溶性高分子材料為骨架,如乙基纖維素、滲透性丙烯酸樹脂等,胃腸液滲入骨架孔隙後,藥物溶解並通過骨架中存在的極細孔徑的通道,緩緩向外擴散而釋放。其釋放速率主要受藥物的溶解度,骨架片的孔隙率、孔徑和彎曲程度的影響,而與胃腸蠕動、pH、消化液中的電解質、酶的關係較小。在藥物的整個釋放過程中,骨架在胃腸道中不崩解,最終隨大便排出體外。
應注意的是難溶性藥物自骨架內釋放速率很慢,所以只有水溶性藥物考慮製成此類骨架緩釋片。此外,該類片劑有時釋放不完全,藥物量較大時會包含在骨架中不能釋放,因此大劑量的藥物也不宜製成這類緩釋片。常見的不溶性骨架製劑有單硝酸異山梨酯緩釋片、雙氯芬酸鈉緩釋片等。
在實際應用中,可以聯合應用多種不同溶解或溶蝕性質的骨架材料達到緩釋目的。山東大學淄博生物醫藥研究院專注緩控釋製劑和複雜製劑的立項與開發技術服務,團隊已完成多個緩控釋製劑的開發和申報,具有豐富的緩控釋處方工藝開發及產業化經驗。