生髮、壯陽都離不開的鋅,更藏有抗老奧秘?_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯51分钟前

從小到大,派派總被嘮叨:“小孩兒缺鋅長不高,得補鋅。”彷彿鋅就是那個決定身高的神秘力量;等長大了,畫風突變,又有人開始忽悠:補鋅能重振“男人雄風”,鋅又成了力量的源泉[1]。
真的是這樣嘛?但真相是……缺鋅這事不分年齡,連老人也無法倖免!一旦鋅不足,還會引發衰老風險。
最近的一篇研究顯示[2]:細胞內的一個重要結構—高爾基體,會通過影響體內的鋅穩態來影響細胞的衰老過程,鋅的缺乏會加劇高爾基體的功能障礙,導致細胞加速衰老。對於老年人來説,老了補鋅反而比以往認為的更為關鍵。


高爾基體?聽着有點陌生啊,但它其實就像線粒體、內質網等一樣,都是細胞器裏的一員,發揮着重要的作用。
作為細胞的核心樞紐,它不僅能接收蛋白質的分選信號,對其進行分揀、彙集後打包成各種分泌小泡後輸送至細胞的各個角落[3]。還能對蛋白質進行特殊“包裝”(糖基化修飾),便於其參與信號傳導[4]。

圖注:細胞的“物流中心”高爾基體
然而,隨着衰老,這個“物流中心”也開始出現問題。具體表現為與蛋白質加工、輸送有關的蛋白(TGN46、GM130)表達量顯著增加,體積膨脹、結構鬆散,運輸蛋白的效率降低,出現了所謂的“高爾基體壓力”的現象。
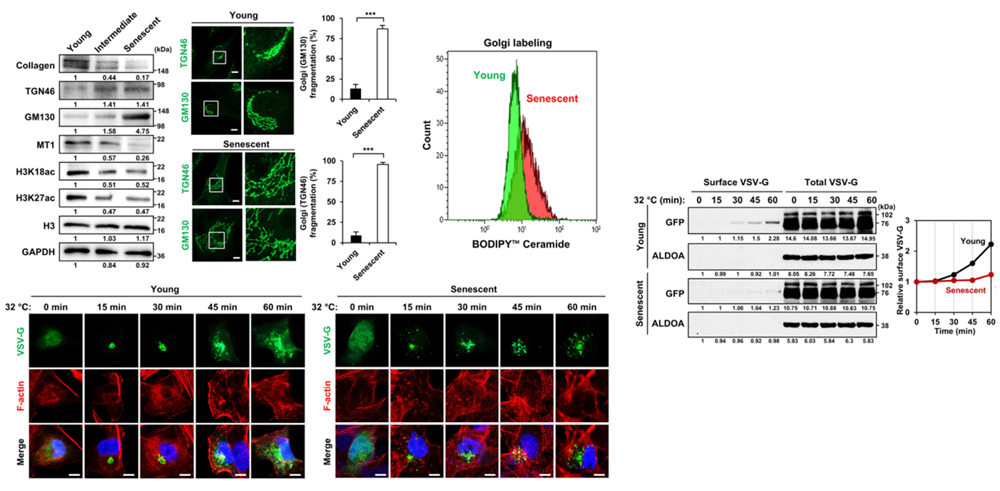
圖注:隨着衰老,高爾基體的結構出現異常,影響其加工、運輸功能
要是放任不管,這“壓力”還會演化成“應激”,波及細胞中的其他部分,首當其衝的就是高爾基體微管,即負責將與高爾基體相關的蛋白質精確地定位發送到其發揮功能的位置的“軌道”。
科學家們發現,衰老造成的“應激”現象,會導致高爾基體附近的微管表達量明顯下降,進而引發微管結構解體,蛋白質定位出現錯誤,拖累胞內物質運輸“大業”,影響細胞通路的信號傳遞。
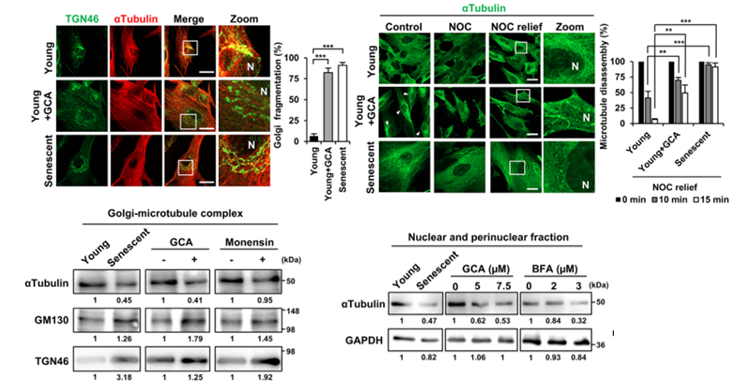
圖注:高爾基應激影響微管結構
所以,問題出在哪?細究鬆散的高爾基體,科學家們發現,有兩個維持高爾基體堆疊結構關鍵蛋白之間的相互作用明顯減弱:Golgin45和GRASP55。就是在對這倆蛋白的研究過程中,研究者們發現了另一個華點——鋅。
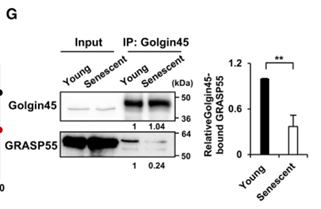
圖注:鋅依賴性高爾基體堆疊蛋白 GRASP55 和 Golgin45 之間的相互作用減弱

對於我們人體,鋅是一種不可或缺的微量元素。它不僅參與細胞內的大部分生理過程(新陳代謝、信號傳導、蛋白質合成、催化反應)[5]。而且,鋅離子還能與蛋白質中的氨基酸殘基(如半胱氨酸)結合,調節蛋白質的活性與穩定[6]。

圖注:含鋅最多的食物[7]!
但隨着衰老,體內鋅的缺乏,會導致體內一些依賴鋅、轉運鋅的蛋白質相互作用減弱,比如上文提到的Golgin45和GRASP55以及鋅轉運蛋白ZIP13等,就會加劇高爾基體的結構不穩定和功能障礙,最終導致衰老加速。
缺鋅對高爾基體功能的影響
通過觀察鋅缺乏的小鼠,科學家們發現其體內的其他重要轉運蛋白(例如ZIP14和Na+/K+泵)的糖基化程度減少,繼而導致與高爾基體壓力相關基因(Arf4和Uap1/1)表達的顯著上調,推動蛋白質運輸受阻,出現功能紊亂。
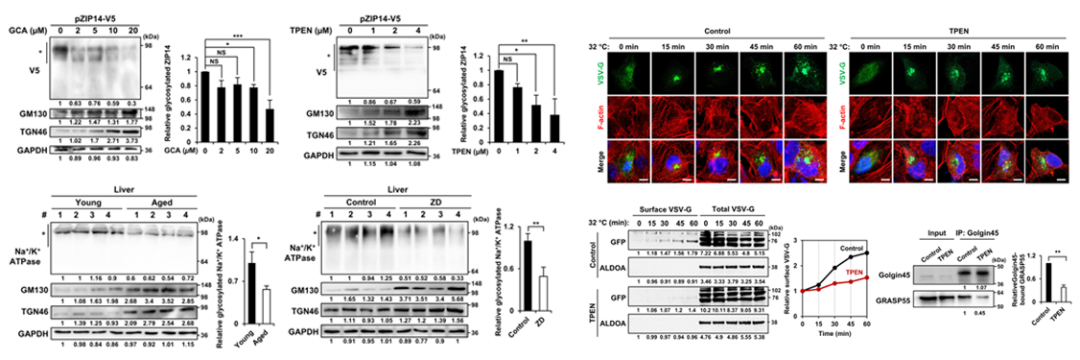
圖注:鋅缺乏影響高爾基體功能
缺鋅對高爾基體結構、微管功能的影響
鋅缺乏會損害高爾基體的功能,那如果直接敲除高爾基體中的鋅轉運蛋白ZIP13,細胞又會發生何等變化?科學家們在敲除ZIP13後發現,與之前衰老細胞表現出的“應激”狀況一樣,高爾基體不僅功能異常,結構更是碎了一地……
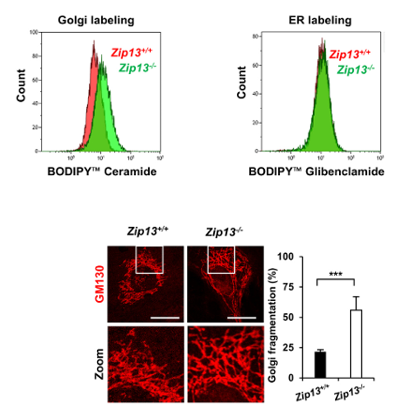
圖注:鋅缺乏出現與衰老相似的高爾基體結構變化
而且,ZIP13的缺失還會使得高爾基體微管中微管蛋白的表達量顯著降低,表明缺鋅會影響高爾基體相關微管的組裝與動態性,最終連累細胞蛋白轉運功能。
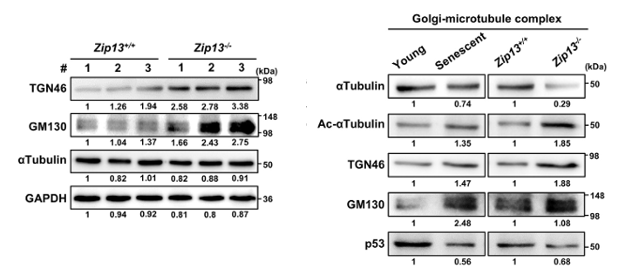
圖注:鋅缺乏對高爾基體微管結構的影響
缺鋅對細胞內蛋白質定位的影響
微管受到影響,接下來被幹擾的功能也就不難猜到了:細胞內蛋白質的運輸和定位。
科學家們發現,在缺鋅造成的衰老過程中,具有核定位信號的蛋白質(如p53、p300、HDAC1和HDAC2)在細胞核內的表達水平降低,無法正確地從細胞質轉移到細胞核發揮調控細胞週期以及DNA修復的作用。
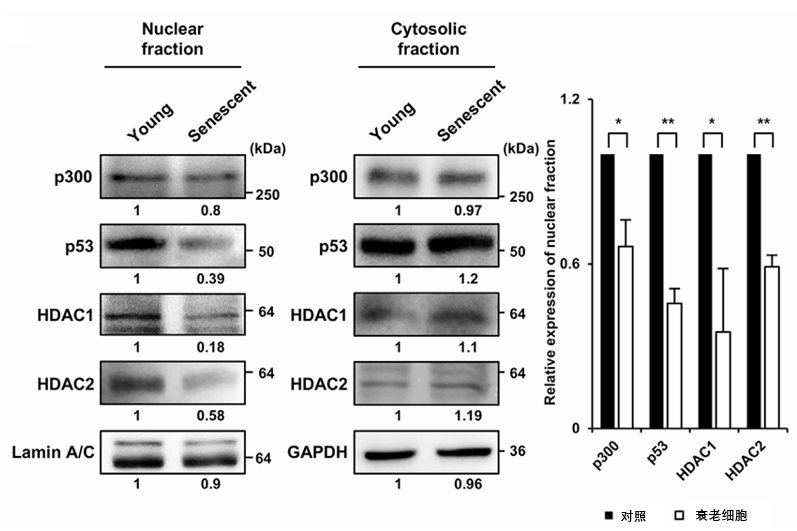
圖注:鋅缺乏影響細胞內蛋白質定位
缺鋅對DNA修復、表觀遺傳調控的影響
比如其中的p53蛋白,它在DNA修復方面發揮關鍵作用。科學家們發現,在缺鋅細胞中,p53激活劑無法激活下游p21和Mdm2等靶基因的表達,通路受阻,修復技能大打折扣,細胞無法有效響應DNA損傷,DNA損傷標誌物γH2AX的表達量顯著增加。
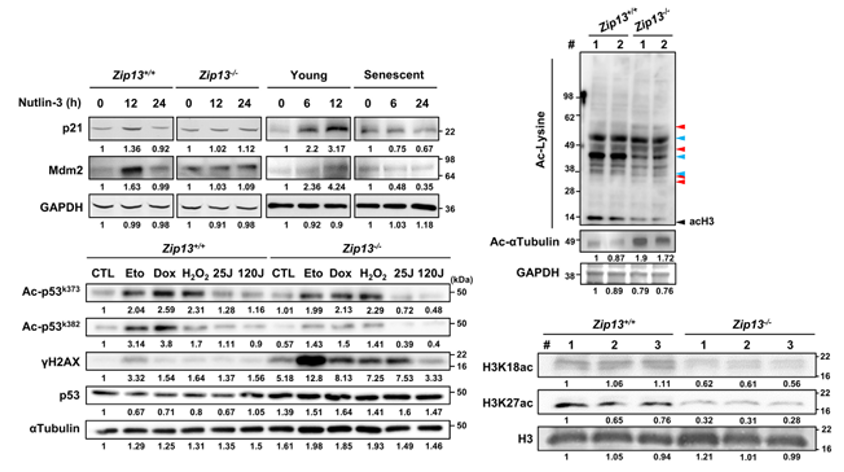
圖注:缺鋅影響細胞DNA修復、表觀遺傳調控
再比如負責乙酰化修飾的HDAC家族,在鋅穩態失衡的情況下,HDAC1、2無法進入細胞核內參與乙酰化修飾過程,導致組蛋白H3在K18和K27位點的乙酰化水平降低,從而影響細胞的表觀遺傳調控(神似衰老細胞…)。
以上種種研究結果都表明,鋅與高爾基體之間,存在密切的相互作用關係。鋅通過GRASP55和Golgin45形成複合物,幫忙穩定高爾基體結構,反過來,高爾基體也能通過鋅轉運蛋白ZIP13調節細胞中的鋅穩態。
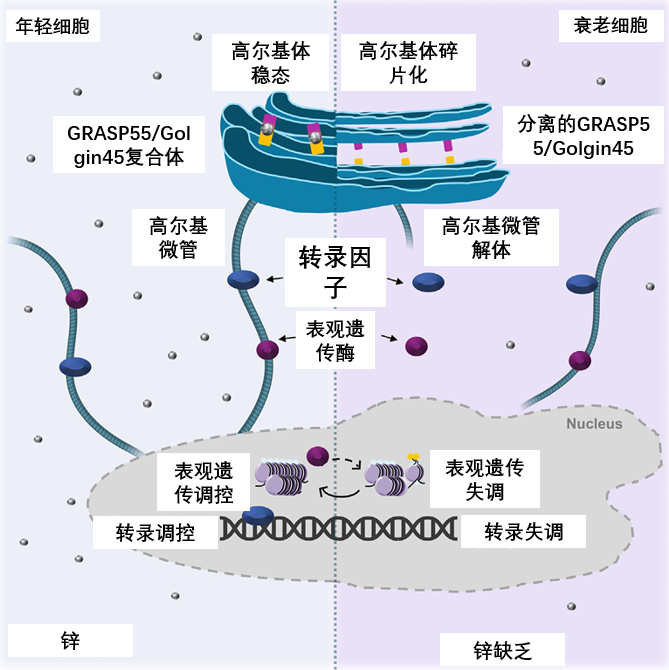
圖注:鋅—高爾基體調控機制

所以,維持體內鋅的平衡對於延緩衰老具有重要意義!那該如何補鋅呢?《中國居民膳食營養素參考攝入量(2023版)》中對鋅攝入量的推薦為:12mg/天,可耐受的最高攝入量為40mg/天。
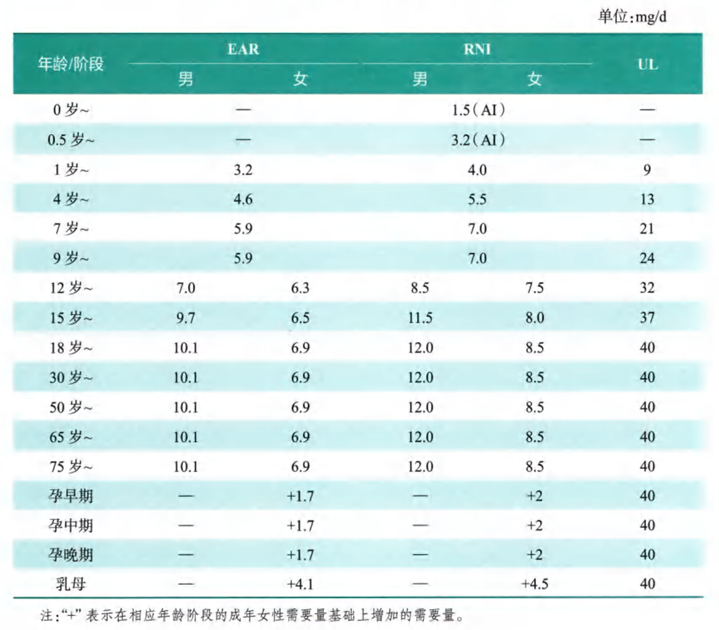
圖注:中國居民膳食鋅參考攝入量(RNI為日推薦攝入量,UL為可耐受最高攝入量)
據統計,多種日常食物中均富含鋅[7],特別是鋅的寶庫——牡蠣,每100g含有約70mg的鋅,不到一兩就能滿足一整天需求。

牛羊肉裏的含鋅量也不賴,每100克中含有超過3mg的鋅,可以説,只要在日常生活中能做到均衡飲食,在維持體內鋅平衡這塊,無需額外補充。
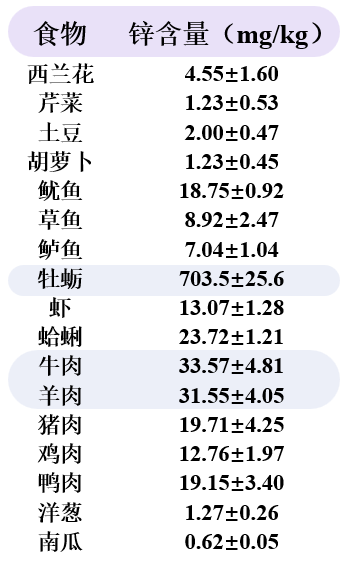
圖注:不同食物中的鋅含量
然而,如果飲食中缺乏這些富鋅食物,或是存在吸收不良的問題,也可以讓補充劑[8]出手相救,常見的鋅補充劑形式包括硫酸鋅、葡萄糖酸鋅和天冬氨酸鋅。有研究表明,相比其他鋅補充劑,天冬氨酸鋅(Zn-Asp)的效率更為高效。
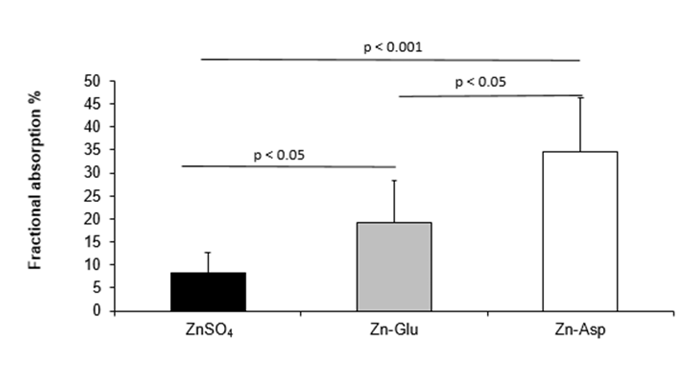
圖注:天冬氨酸鋅是一種更有效的鋅補充劑
(還想知道更多鋅與衰老之間的秘辛嗎?點擊下方小卡片,後台回覆關鍵詞 補鋅 解鎖如何更好補鋅!)
時光派點評
相對於缺鋅造成的脱髮、皮炎、免疫系統缺陷外,派派關注鋅在抗衰方面的作用,以本文為例,所謂衰老,不僅只有細胞的默默退化的獨角戲,更可能是由於細胞內鋅平衡失調和高爾基體功能障礙引起的複雜交互作用的結果。

因此在未來的抗衰戰場上,我們更應該去維持高爾基體鋅穩態、保護高爾基體及微管功能,也許真可能成為未來抗衰治療的關鍵。
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Hadwan, M. H., Almashhedy, L. A., & Alsalman, A. R. (2012). Oral zinc supplementation restores high molecular weight seminal zinc binding protein to normal value in Iraqi infertile men. BMC urology, 12, 32. https://doi.org/10.1186/1471-2490-12-32
[2] Brito, S., Heo, H., Kim, J., Cha, B., Jeong, Y., Choi, W., Shrestha, C., Lee, G. H., Park, S. J., Yoon, K. B., Oh-Hashi, K., Kim, S. T., Chae, S., Cho, S. K., Weon, B. M., Kim, J., & Bin, B. H. (2024). Age-associated interplay between zinc deficiency and Golgi stress hinders microtubule-dependent cellular signaling and epigenetic control. Developmental cell, S1534-5807(24)00763-9. Advance online publication. https://doi.org/10.1016/j.devcel.2024.12.024
[3] Schröder M. (2008). Engineering eukaryotic protein factories. Biotechnology letters, 30(2), 187–196. https://doi.org/10.1007/s10529-007-9524-1
[4] Kellermann, M., Scharte, F., & Hensel, M. (2021). Manipulation of Host Cell Organelles by Intracellular Pathogens. International Journal of Molecular Sciences, 22(12), 6484. https://doi.org/10.3390/ijms22126484
[5] Foster, M., & Samman, S. (2012). Zinc and regulation of inflammatory cytokines: implications for cardiometabolic disease. Nutrients, 4(7), 676–694. https://doi.org/10.3390/nu4070676
[6] Hulst, M., Jansman, A., Wijers, I., Hoekman, A., Vastenhouw, S., van Krimpen, M., Smits, M., & Schokker, D. (2017). Enrichment of in vivo transcription data from dietary intervention studies with in vitro data provides improved insight into gene regulation mechanisms in the intestinal mucosa. Genes & nutrition, 12, 11. https://doi.org/10.1186/s12263-017-0559-1
[7] Mai, W., Wang, F., He, S., Wen, Y., Yu, G., Zhang, L., & Dong, H. (2024). Zinc contents in foods and estimates of dietary intakes in Guangzhou, Guangdong Province, China. Frontiers in nutrition, 11, 1364033. https://doi.org/10.3389/fnut.2024.1364033
[8] Piacenza, F., Giacconi, R., Costarelli, L., & Malavolta, M. (2023). Preliminary Comparison of Fractional Absorption of Zinc Sulphate, Zinc Gluconate, and Zinc Aspartate after Oral Supple-Mentation in Healthy Human Volunteers. Nutrients, 15(8), 1885. https://doi.org/10.3390/nu15081885