老了神經元在大腦裏“蹦迪”,還是認知退化罪魁禍首?別再將所有衰老歸咎於“損傷”_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯15小时前

具不完全統計,每年冬天有7000餘隻貓不慎把自己點着:鑽進老家爐灶的、站在小太陽前一動不動直至“火貓三丈”的、爪欠嘗試去抓火的……冬日裏的貓貓趨熱實屬“正常”,畢竟其他生物也不遑多讓。
但同樣在一個冬日,實驗室裏的衰老實驗模型動物線蟲引起了日本名古屋大學研究者們的好奇:作為其為數不多的“智商”體現,大部分線蟲都會自覺奔赴最適合自己生存的温度,但有些線蟲一反常態不為所動,怎麼回事?
原來是老了啊,那沒事……還是有事的!當大部分人認為這是因為神經退化導致的認知障礙,研究者們卻得出了完全相反的結論——説不定這種認知衰退產生的原因,是神經元“超進化”呢[1]?


説到因為衰老造成的機體功能障礙,大家的經驗、歷史的研究都一致認為,這是從小至分子蛋白、大到組織器官的衰退及損傷導致的。
就以本文中主要討論的因為年齡增長而逐漸的故障的“趨熱本能”為例:在温度不適宜的情況下,線蟲會自覺遷移到15-25℃的生存温度區間裏,然後在該範圍內做等温移動。
雖説是一種“本能”,但也離不開線蟲那僅包含了302個神經元的小腦瓜的全速運轉,早在1995年,就有一篇Nature詳細觀察了線蟲的趨熱過程後總結出其神經活動經驗[2]:
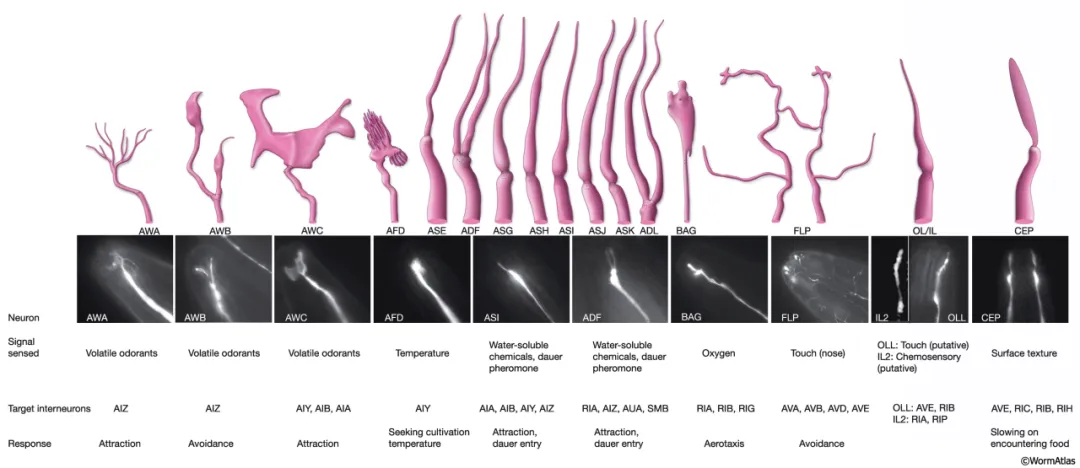
圖注:線蟲各類神經元一覽[3]
首先也最重要的是AFD感覺神經元,當一側或雙側的AFD神經元被人為破壞,線蟲就會表現出對極端温度的奇怪偏好,有的嗜熱,有的嗜冷,還有的直接一整個亂跑,穿梭於各種不同的温度温度範圍;
其次就是其他與AFD相互作用的神經元,它們被破壞也大多會造成線蟲對温度感知和相關移動的障礙,比如破壞了AIY神經元線蟲就會嗜冷,而被破壞了AIZ的則會嗜熱……總之,這篇研究的統一邏輯就是“破壞一類神經元——產生相應功能障礙”,非常合理……吧?
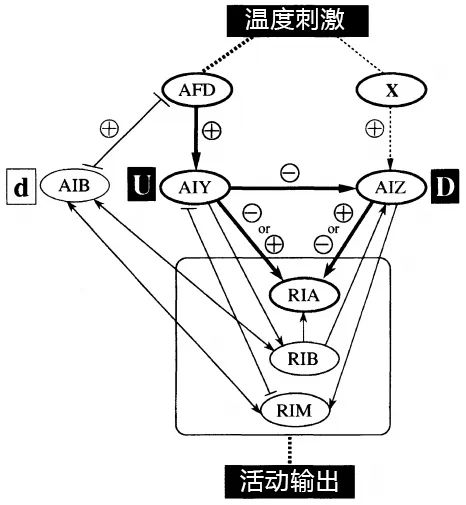
圖注:這篇Nature輸出的核心結果——趨熱行為的神經活動支持
本文的研究者們也覺得甚是合理,於是他們首先嚐試破壞了有正常趨熱性年輕線蟲的AFD或AIY神經元,然後得出了和95年Nature完全一致的功能障礙結果;於是他們接下來信心滿滿地去檢測失去了趨熱性的老年線蟲的這倆神經元活動,結果懵了:
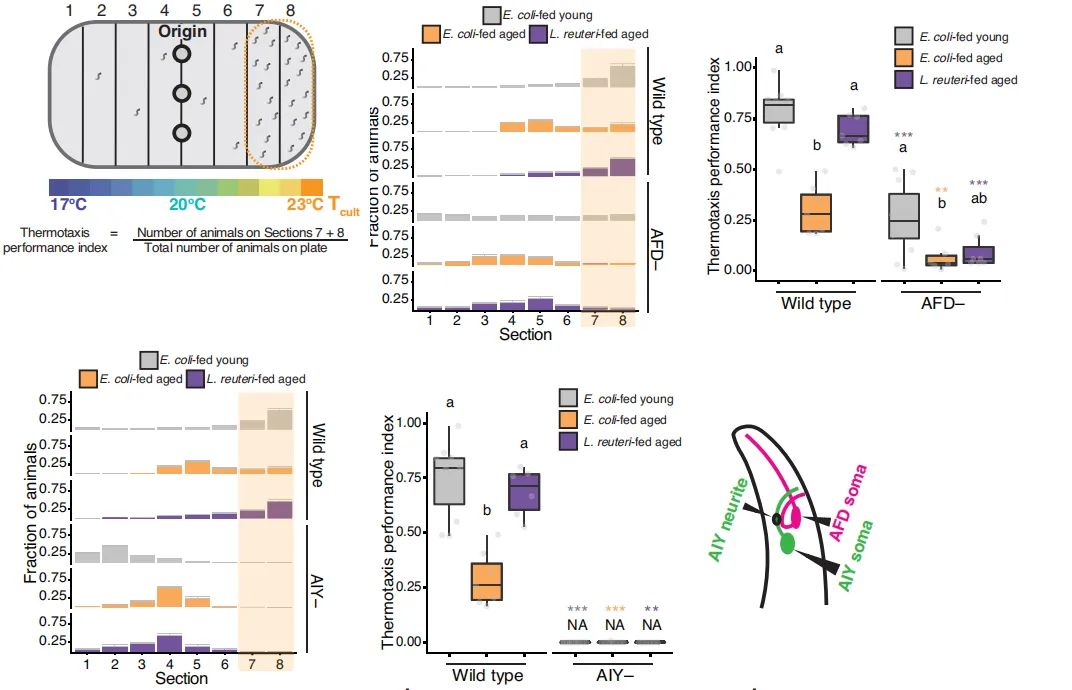
圖注:AFD、AIY受損後線蟲的趨熱能力也受損
鈣反應是反映神經元活動的“金標準”,一定程度上能反映神經元功能的完整性,但用温度變化檢測了不同年齡段線蟲在處理温度信息時AFD等感温神經元裏發生的鈣反應,他們沒有發現任何差異!
啊?不是神經元受損然後相應功能趨熱性才受損的嗎?AFD和AIY完好無損,但趨熱能力悄悄地壞掉了?不對勁,30年了,一定是有什麼不知道的、超越95版Nature的東西也在介入老年個體的神經調控。
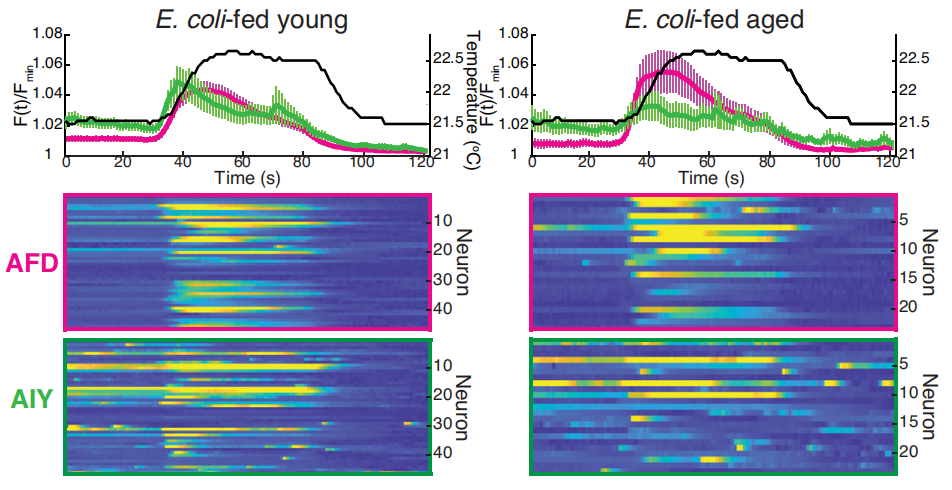
圖注:AFD和AIY鈣反應沒有發生顯著變化,但線蟲的趨熱反應的確是被破壞了

既然查了AFD和AIY,那把其他的也查了也就是順手的事。和對AFD的研究邏輯一樣,首先研究者們用誘導細胞凋亡的方式逐一破壞了不同線蟲的不同神經元,檢測是否會對它們的趨熱運動造成影響。
ASI、AIZ、AIB……這些神經元的破壞都無法影響線蟲的趨熱反應,直到AWC和AIA,神奇的事情才發生了:破壞了已經出現趨熱障礙的老年線蟲的AWC或AIA神經元,它們因為年齡出現的趨熱障礙反而恢復了正常!

咋回事?歷史研究顯示,AWC是掌管線蟲嗅覺的重要認知組分[4],而AIA也作為一種中間神經元負責傳遞各種功能神經元的信號[5],所以這倆不存在“本來就多餘”的可能性;那趨熱反應的破壞,總不能是因為這倆神經元在“蹦迪”吧?
研究者們接着去檢測了AWC和AIA神經元裏的鈣反應,發現果然,和年輕對照相比,老年線蟲腦子裏的AWC和AIA神經元果然“不正常”地活躍了起來,表現為鈣反應的隨機、瞬時、大幅變化,而這一現象又被描述為“神經元多動症”。
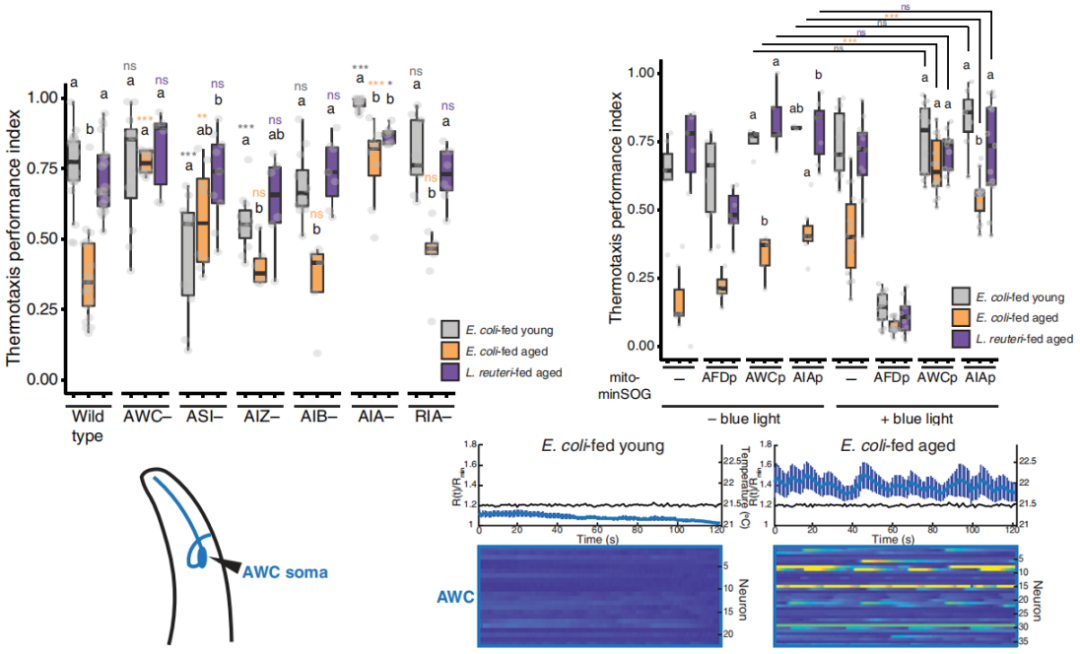
圖注:AWC和AIA多動,消除這倆神經元,反而有助於維護線蟲的趨熱反應
為了進一步證實“神經元多動症”在“線蟲多動症”中的作用,研究者們接着去探索了AWC和AIA神經元介導線蟲行動紊亂的具體機制。
No.1
AWC:收到的信息太多,崩潰了
神經元嘛,作為傳遞消息、下達指令的“神秘組織”,最關鍵的就是接受信息和發出信息,而AWC作為一種具有獨立功能的感覺神經元大類,其收發信息剛好仰賴於一對基因:unc-13和unc-31。
前者主要負責收信息:對接前端神經元發來的“信息包”突觸小泡,並負責生產突觸前蛋白“對接站”等;後者則主要負責神經元通過胞吐發出“信息包”所需要的蛋白和其他條件。
兩者都很重要,但只有AWC中unc-13被消滅的線蟲才能從老年AWC“多動症”中掙脱出來,而unc-31不行。所以對AWC來説,可能是因為接受其他神經元傳信的過程出了岔子,才導致其隨機性非正常興奮,繼而進一步介導線蟲在不同温度下“亂跑”。
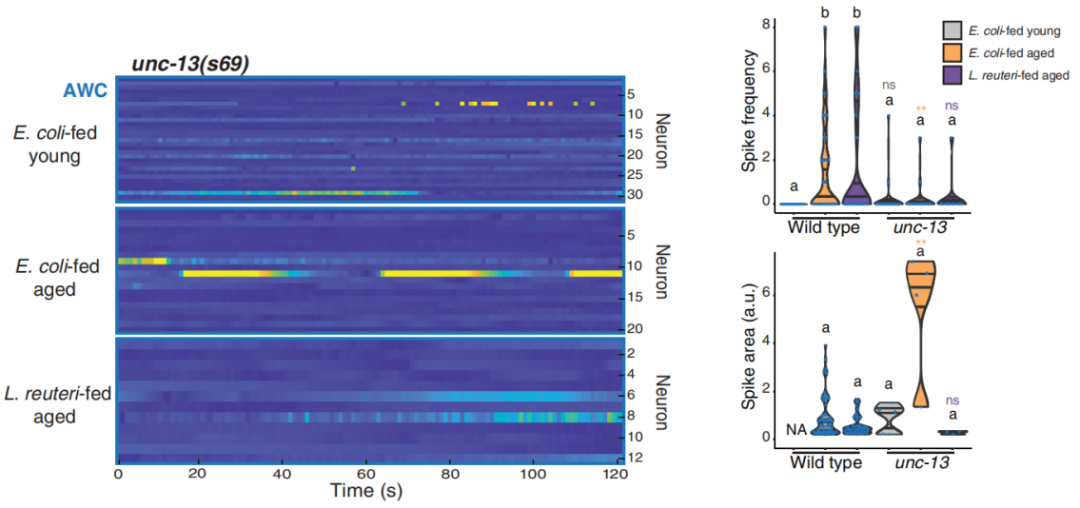
圖注:敲除unc-13能緩解老年線蟲的AWC多動症
No.2
AIA:發出信息太多了,也崩潰了
和AWC一樣,AIA的工作也離不開unc-13和unc-31這對基因的全力支持,但和AWC恰好相反,對AIA更重要的是unc-31。
消除了AIA中的unc-13,能略微降低該反應的聚集度和持續時間,但消除了unc-31能顯著降低AIA的不正常活性。
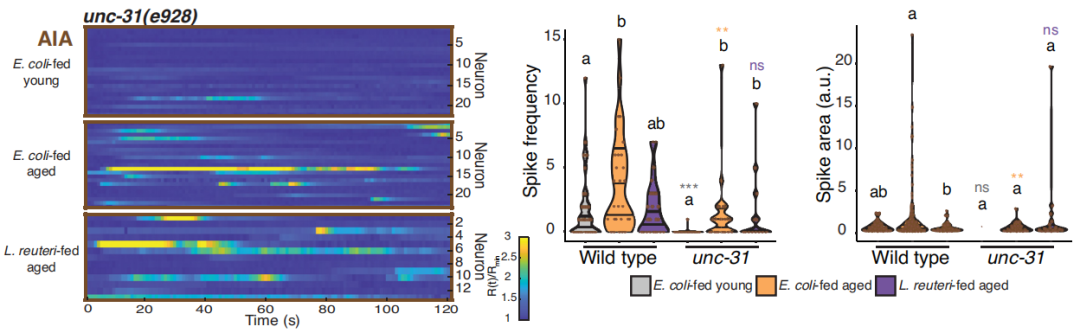
圖注:敲除unc-31能緩解老年線蟲的AIA多動症
值得注意的是,除了因為各自為戰、收發信息過勞會導致AWC或AIA神經元的多動,研究者們發現,這兩種神經元還在通過共享雙向突觸“私相授受”:幹掉AIA,能一定程度緩解AWC的多動情況;幹掉AWC,也能一定程度緩解AIA的多動情況。
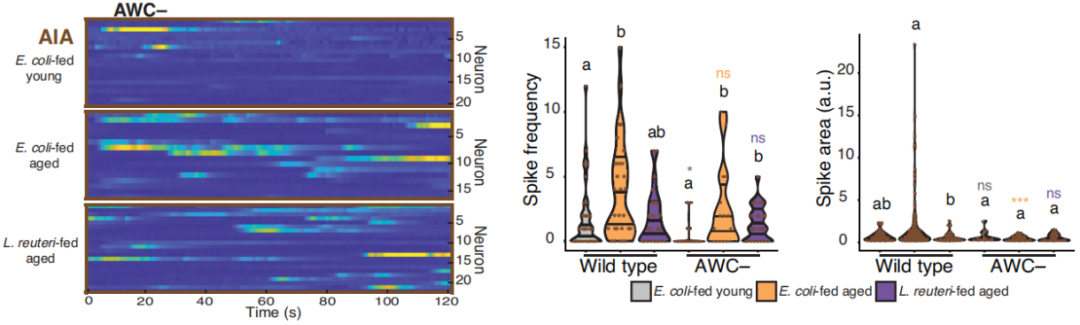
圖注:幹掉AWC,就能緩解AIA的多動症
所以!線蟲的這種“認知退化”還真不是因為神經元細胞或神經組織的損傷。
在歷史研究中,我們見多了那些針對衰退啊、障礙啊、損傷啊的補救措施,但這正常功能的過度表達又該怎麼解決?總不能像探究過程中一樣,一棍子打死、全部敲除吧?線蟲聽了都着急:那我嗅覺怎麼辦?(AWC是專門負責線蟲嗅覺的感覺神經元)

有意思的是,其實在探索線蟲認知障礙的一開始,研究者們似乎就湊巧摸到了針對本文所討論的認知障礙的解決方法:
不同飲食的線蟲,在老年趨熱行為方面的認知表現是不一樣的。
大部分實驗室線蟲的食譜都只有大腸桿菌,那它們的老年認知狀態就都差不多,會出現趨熱能力方面的障礙;但還有一些線蟲吃上了“酸奶味的高級餐”——羅伊式乳桿菌,那它們的老年趨熱認知就會好得多。
在後續的各項原理探索實驗中,羅伊式乳桿菌組都發揮出了接近年輕對照組的認知水平,且證明了自己和已經被探索出的神經元多動症有關:不同飲食的線蟲體內,AFD鈣反應一樣不會產生差別,但AWC和AIA會。
當然,證明了羅伊式乳桿菌就是神經元多動症的“正解”也並不能解決問題:人不可能,也不應當和線蟲保持一樣的飲食,想象一下那畫面都相當炸裂。所以,還得進一步找到藏在不同菌菌背後的認知抗衰原理。
研究者發現,羅伊式乳桿菌的這種抗衰能力其實和一種我們常知的長壽因子密切相關——daf-16,也就是人類身上大名鼎鼎的FOXO。
在AWC神經元中迫使daf-16不表達,則羅伊式乳桿菌也救不了老年線蟲的認知障礙;而FOXO蛋白也早已在數不清的文獻中被證明是細胞穩態的關鍵,與代謝、壽命和癌症等多種生理狀態有關,抗氧化應激、修復DNA損傷、促進自噬也都不在話下[6]。
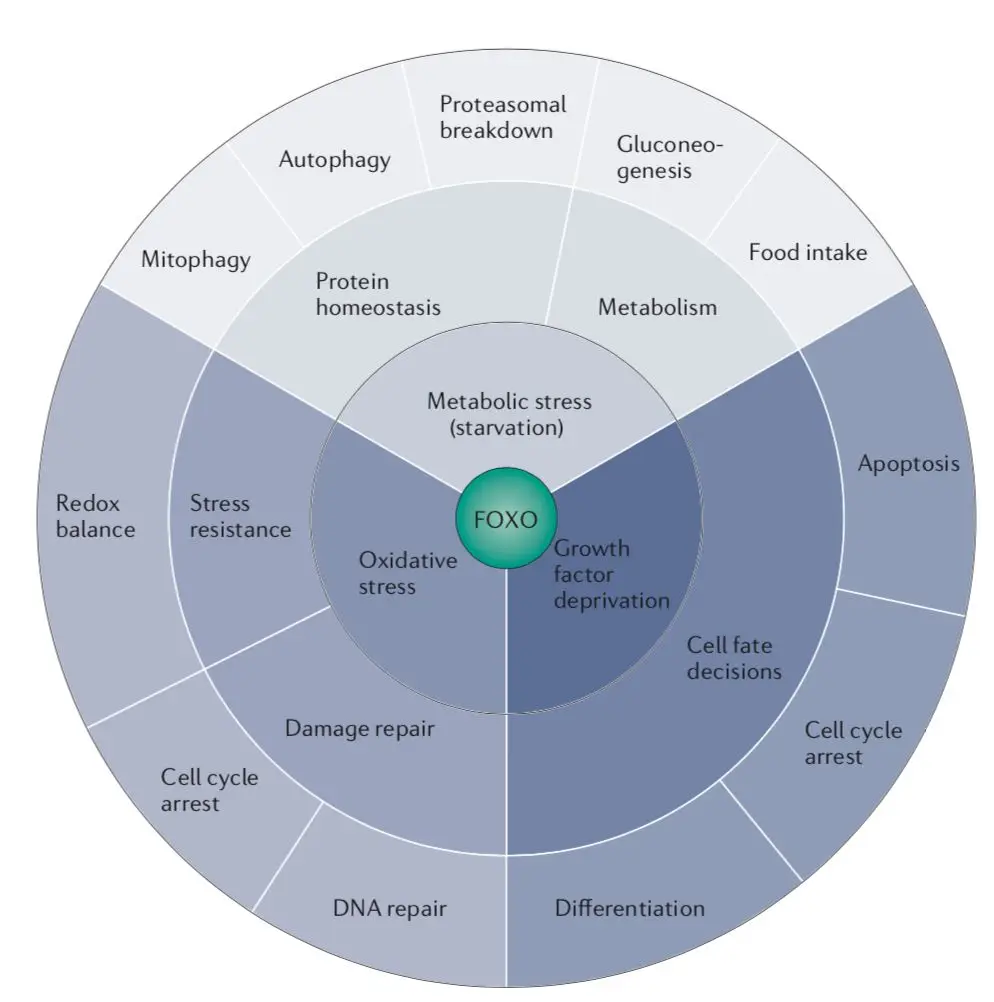
圖注:作為經典長壽因子,FOXO具有各種功能
神經元多動症,可不就是一種細胞“不穩重”嘛!當搞清楚了這一點,將線蟲的經驗運用到人類身上也就變得簡單了起來:激活FOXO就好了?那熱量限制行為干預、雷帕黴素等物質干預都可以用上,解決組織損傷和障礙是這一套,也可以用於解決它們的過於活躍。
看完了整個實驗流程,再仔細一想就會發現,線蟲趨熱行為中的“衰老悖論”其實並不難理解。怎麼説呢?老年線蟲其實的確會面臨一些神經元方面的損傷或“力不從心”,這即使對只有302個神經元的小腦瓜也會產生苦惱。
那為了解決這一問題,線蟲不得不督促自己所有神經元加班加點,其中也就包含了那些在日常工作中適量就好、多了反而惹麻煩,且本身尚未受損的神經元,就比如本文中的AWC和AIA。
所以,歸根結底,罪魁禍首還是最先出現損傷和功能障礙的那些細胞和組織!而要抗擊衰老、延長壽命,不如先嚐試着挽救組織,避免其因為衰老而損傷、缺失。
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Aleogho, B. M., Mohri, M., Jang, M. S., Tsukada, S., Al-Hebri, Y., Matsuyama, H. J., Tsukada, Y., Mori, I., & Noma, K. (2025). Aberrant neuronal hyperactivation causes an age-dependent behavioral decline in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America, 122(1), e2412391122. https://doi.org/10.1073/pnas.2412391122
[2] Mori, I., & Ohshima, Y. (1995). Neural regulation of thermotaxis in Caenorhabditis elegans. Nature, 376(6538), 344–348. https://doi.org/10.1038/376344a0
[3] https://www.wormatlas.org/index.html
[4] Dishart, J. G., Pender, C. L., Shen, K., Zhang, H., Ly, M., Webb, M. B., & Dillin, A. (2024). Olfaction regulates peripheral mitophagy and mitochondrial function. Science advances, 10(25), eadn0014. https://doi.org/10.1126/sciadv.adn0014
[5] Saul, J., Hirose, T., & Horvitz, H. R. (2022). The transcriptional corepressor CTBP-1 acts with the SOX family transcription factor EGL-13 to maintain AIA interneuron cell identity in Caenorhabditis elegans. eLife, 11, e74557. https://doi.org/10.7554/eLife.74557
[6] Link, W., & Ferreira, B. I. (2025). FOXO Transcription Factors: A Brief Overview. Methods in molecular biology (Clifton, N.J.), 2871, 1–8. https://doi.org/10.1007/978-1-0716-4217-7_1