一場勉強通過的答辯,讓化學翻過“最黑暗的篇章”_風聞
返朴-返朴官方账号-关注返朴(ID:fanpu2019),阅读更多!43分钟前

撰文 | 鄭超(中國科學院上海有機化學研究所研究員)
這便是自然科學的特別之處:偉大的人物會逐漸變得渺小,
因為後繼者的新發現總是讓前輩們黯然失色。
——雅各布斯·亨裏克斯·範特霍夫
化學反應種類繁多,時間尺度差異也極大。向混有酚酞試液的檸檬水中倒入蘇打水,溶液立即由無色變為粉色,這説明酸鹼中和可以在瞬間完成。無論江蘇高郵的鹹鴨蛋,還是浙江金華的火腿,品嚐醃製食物的美味需要耐心等待幾周甚至數月。而古代生物的遺體在地下沉積,隨着地質運動形成煤和石油則必須經歷數百萬、甚至上億年的漫長歲月。這些事實清楚地告訴我們,有必要為化學反應賦予“速率(rate)”的特徵,來刻畫反應中物質的數量隨時間變化的快慢。化學動力學(chemical kinetics)正是為了回應這一需求在十九世紀中葉萌芽產生,至今仍在不斷發展。馬克思認為:“一種科學只有在成功地運用數學時,才算達到了真正完善的地步”。化學動力學第一次將微積分引入化學反應的研究,幫助化學躋身精確科學的行列。然而有趣的是,時至今日,究竟應該使用怎樣的數學關係才能恰當地描述像“化學反應速率”這樣複雜的對象,仍然是擺在化學家面前的一道難題。
概率遊戲:“質量”作用定律
化學動力學誕生於重重困難之中。十九世紀是化學蓬勃發展的時代,歐洲主要國家的工業化,特別是採礦、冶金、製藥、化肥、染料等行業的快速發展,既對各類化學品的研發和生產提出了迫切的需要,也為化學家們施展他們的技藝提供了廣闊的舞台。但是正因為如此,十九世紀的化學研究充滿了實用主義的色彩,主流化學家工作的重心始終聚焦於新物質和新反應的發現。至於對特定化學反應背後原理的探討,無論如何也是第二位的。當然,在對物質微觀結構知之甚少的年代,我們不能苛求多數化學家都具備定量研究化學反應進程的自覺。另一方面,技術手段的匱乏所帶來的阻礙也不容忽視。測定反應的動力學行為需要即時監控體系中某種物質濃度的變化,在今天的化學實驗室中一般依靠先進的原位譜學來實現,這種便利是一個多世紀以前的化學家無法想象的。此外,從原始實驗數據中挖掘出普適的動力學規律需要足夠的數學技巧和直覺。但是化學起源於古老的鍊金術,“厭惡”數學幾乎是所有鍊金術士的共同本能。這樣看來,化學動力學最初的起步必然離不開來自學科外部的刺激。也許是陰差陽錯,也許是“命中註定”,有關化學動力學的探索在德國“業餘”化學家威廉米(L. F. Wilhelmy)的“玩票”中拉開了序幕。
威廉米早年在波美拉尼亞(現屬波蘭)經營一家藥店,31歲時放棄生意,輾轉於德國多地求學,最終在海德堡大學獲得博士學位。1849年起他在母校擔任了五年私俸講師(privatdozent),之後便離開大學從事私人研究。1850年,威廉米利用旋光儀研究了蔗糖的水解反應。蔗糖是日常生活中最常見的糖類物質,其在酸性條件下會水解成葡萄糖和果糖。這三種糖分子都具有手性,能使穿透其溶液的圓偏振光的偏振面發生旋轉。其中蔗糖和葡萄糖是右旋,果糖是左旋、且旋光值遠大於葡萄糖。因此向蔗糖溶液中加一點酸,隨着蔗糖的水解,就可以通過旋光儀觀察到穿透溶液的圓偏振光從右旋逐漸變成左旋。威廉米不是最早研究蔗糖水解的人,但是不同於當時一般化學家的研究理念幫助他從中發現了化學動力學的玄機。威廉米認為考察一種陌生現象最好的方法不是埋頭於實驗觀測,而是首先假定一個描寫該現象的數學方程,再用實驗數據檢驗方程的正確性。這樣既能避免實驗的盲目性,又有望得到定量的規律。威廉米學習過法國大數學家傅里葉(J. Fourier)的《熱的解析理論》,從一維熱傳導方程中得到了靈感。根據傅里葉的理論,當初始温度分佈滿足餘弦函數時,絕熱杆上某處的温度u隨時間t的變化率與該處的温度成正比:



得出與威廉米相似結論的還有英國人哈考特(A. G. V. Harcourt)。不同於威廉米只有五年編外講師的學術經歷,哈考特是牛津大學卓有聲望的化學教授,他還有一位忠實的朋友——同是牛津大學教授的數學家埃森(W. Esson)。哈考特和埃森分別負責實驗和計算,合作研究化學動力學長達五十年之久。威廉米成功的關鍵,除了提出(2)式的天才之外,還在於使用旋光值指示蔗糖的濃度。這種方法既可以做到即時觀測,又不會對水解反應本身造成擾動。而哈考特和埃森則利用“碘鍾”反應解決了濃度測量的棘手問題。碘鍾反應的原理非常簡單:雙氧水與碘化鉀溶液反應緩慢生成碘單質,碘單質又能與大蘇打反應被迅速移除;而碘單質最顯著的特徵莫過於遇到澱粉顯藍色。如果在雙氧水與碘化鉀的反應燒杯中預先加入少量澱粉和大蘇打,則反應產生的碘單質必須等待所有大蘇打被消耗之後才能在燒杯中累積,進而與澱粉作用使溶液變藍。這時再加入相同量的大蘇打,溶液的藍色將因為碘單質被移除而迅速褪去,直到新加入的大蘇打完全消耗後方可恢復。如此反覆操作,燒杯中的藍色不斷顯現/褪去,形成一座美麗的碘鍾。它天然地指示着雙氧水與碘化鉀反應的速率。碘鍾反應操作最大的挑戰是如何準確記錄溶液變色的時刻。根據哈考特1866年論文中的描述,這要求一位訓練有素的觀察者注視溶液,同時耳朵靠近時鐘,心中默數秒針的滴答聲,在溶液變色的瞬間記下所經過的秒數。用這種略顯簡陋的方法,哈考特能夠記錄從幾秒到幾十秒不等的時間間隔(甚至估計到0.01秒),並且有了驚人的發現。隨着雙氧水的消耗,溶液顏色兩次變藍的間隔逐漸拉長。將剩餘雙氧水的數量對反應時長作圖,得到一條指數衰減的曲線。埃森據此導出的公式與威廉米的(3)式完全等價。
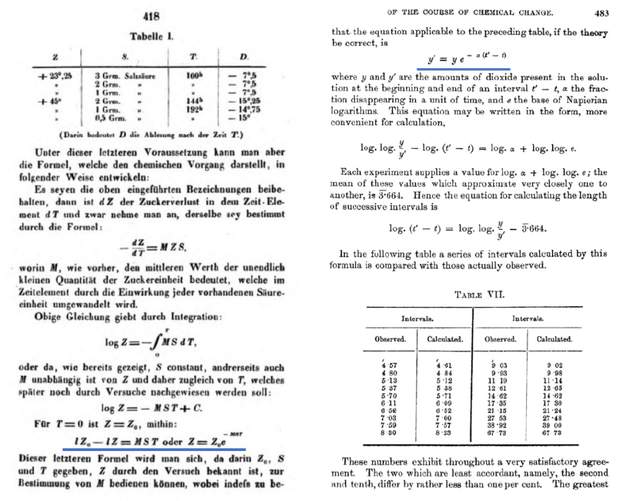
威廉米和哈考特/埃森發現的(2)式和(3)式,事實上給出了偽一級(pseudo-first order)反應的動力學特徵,即反應速率正比於單一反應物的濃度。把(2)式“稍加推廣”,我們可以猜想對於形如



事實上,(5)式的產生過程頗為複雜,絕不是對(2)式的簡單推廣。1864年瓦格和古德貝格用挪威語發表第一篇論文時並不知道威廉米的結果(威廉米工作的價值還要等到十九世紀80年代才被德國化學家奧斯特瓦爾德(F. W. Ostwald)慧眼所識),哈考特和埃森的論文也尚未見刊。瓦格和古德貝格研究化學反應進程的出發點是一種名為“親和力(affinity)”或者“化學力(chemical force)”的傳統觀念。受限於對物質微觀結構認識的不足,也出於對宏觀力學的“模仿”,遲至十九世紀中葉仍有不少化學家相信,化學反應的發生是受某種“力”的驅動。不同物質之間親和力的大小決定了化學反應的方向和程度。瓦格和古德貝格希望量化這種親和力。他們選擇的研究對象是羧酸與醇的酯化和酯的水解構成的可逆反應。當時人們已經知道,可逆反應不管從哪一方啓動,最終都會達到相同的“平衡”狀態。瓦格和古德貝格認為這種平衡意味着正逆反應雙方的親和力相等(正如宏觀物體的靜力平衡那樣)。考慮形如


能“推動”化學反應的親和力當然是子虛烏有。正如奧斯特瓦爾德批評的那樣,親和力的概念對於化學動力學的發展沒有貢獻,只有傷害。但是從微觀角度認識化學動力學的正確路徑也不可能是奧斯特瓦爾德鼓吹的“唯能論”,而是以分子運動論為基礎的統計力學。最早從分子運動的視角解釋化學反應的是奧地利因斯布魯克大學的物理學家弗德勒(L. Pfaundler)。他在1867年的論文中明確提出,化學反應由分子的碰撞引發,碰撞頻率越高則反應速率越快。一旦確立這樣的觀點,那麼質量作用定律幾乎就是理所當然的結論。我們可以把物質的濃度視為在反應容器空間中某一點發現物質分子的概率。如果每種物質的空間分佈都相互獨立,那麼根據概率論的基本原理,分子碰撞事件的概率一定可以寫成物質濃度的冪的乘積(以化學計量數為指數),而(2)式和(5)式中的速率常數k可以粗略地理解為能夠引發化學反應的“有效碰撞”的頻次。作為刻畫化學反應動力學性質最關鍵的參數,速率常數k的測量和解析自然成為化學動力學研究的核心問題。
抽絲剝繭:阿倫尼烏斯公式
在多數情況下,升高温度都能夠加速化學反應的進行。這從分子運動的角度很容易理解,因為温度本來就是分子運動平均速度的量度,當運動速度加快時,分子碰撞乃至發生化學反應的概率自然會增加。但是,物理化學家不會滿足於簡單的定性描述,而是嘗試在不同温度T下測量給定化學反應的速率常數k,希望在k與T之間建立定量的依賴關係。雖然在十九世紀下半葉不斷有這方面的研究成果問世,但是它們能給出的答案遠比不上所帶來的困惑。人們發現,如果把ln k作為擬合目標,那麼它有時與T成正比、有時與ln T成正比、有時又與-1/T成正比,甚至把這三個温度項線性組合,還經常能提升擬合的精度!眾多不同形式的k ~ T方程並立,讓人難以相信速率常數和温度之間存在簡明、普適的數學關係。難怪奧斯特瓦爾德會感嘆:對於速率常數與温度關係的研究,是化學動力學“最黑暗的篇章(the darkest chapter)”。
表1. 各種關於化學反應速率常數k與絕對温度T的方程
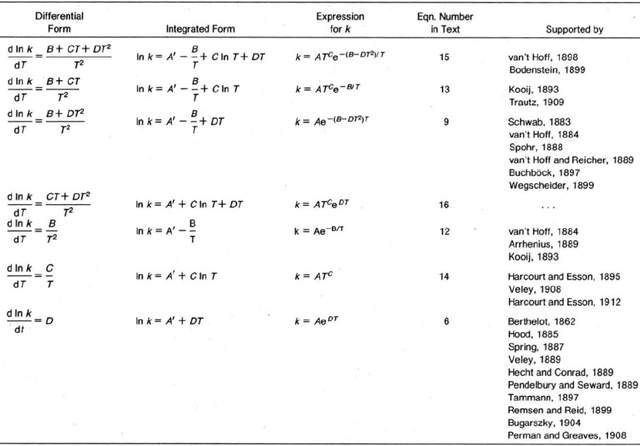
導致這種局面的主要原因,是當時動力學實驗所能覆蓋的温度區間很窄。如果實驗温度設定為0 ~ 50攝氏度,其變化幅度(以絕對温度計算)只有區區20%,此時T、ln T和-1/T三者本身就接近線性關係。因此,即便使用同一組動力學實驗數據,也完全可能擬合出不同的k ~ T方程。也就是説,如果不深究方程背後的物理圖像,僅以擬合精度評定優劣,那麼對k ~ T關係的探索一定會迷失方向。浸淫反應速率研究半個世紀的哈考特把希望寄託於年輕人,期盼化學家在測量時間的腳步時能夠收穫如同天文學家預言掩星(occultation)的喜悦。幸運的是,這道謎題沒有等待太久就迎來了它的解答者:物理化學雙子星——荷蘭人範特霍夫(J. H. van ’t Hoff)和瑞典人阿倫尼烏斯(S. Arrhenius)。

範特霍夫和阿倫尼烏斯年紀相仿,學術經歷也有許多相似之處。他們都在博士階段做出了劃時代的成果,卻不被“權威”認可,甚至遭到無情的打擊。範特霍夫於1874年首次提出碳原子的“四面體”結構假説,用來解釋手性物質的旋光現象。但是這一思想實在是過於超前,難以被當時的主流有機化學界接受。德國化學家科爾貝(H. Kolbe)甚至諷刺範特霍夫天馬行空的想象力配得上烏得勒支獸醫學院講師的職位。此後,範特霍夫前往阿姆斯特丹大學和柏林大學工作,把研究興趣轉向物理化學,在化學平衡與動力學、滲透壓理論等方面做出了開創性的貢獻。1884年範特霍夫出版了《化學動力學研究》一書,用熱力學的觀點看待化學平衡,為最終闡明速率常數隨温度變化的規律鋪平了道路。
從熱力學出發解決與温度相關的問題是一條非常自然的思路,況且在十九世紀下半葉,宏觀熱力學已經發展到相當完善的程度。然而熱力學精巧的概念和公式並不是為了研究化學反應而被創造出來的,跨學科的知識移植需要合適的契機。最早涉足這條道路的是德國人霍斯特曼(A. Horstmann),他於1873年發現固體氯化銨分解產生氣體(氨氣和氯化氫)的過程和液體蒸發產生氣體的過程遵守相同的熱力學規律。霍斯特曼借用熱力學中熵的思想描述固體產氣反應中壓強p、温度T和反應熱q的關係

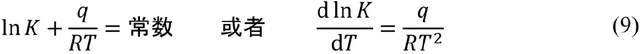

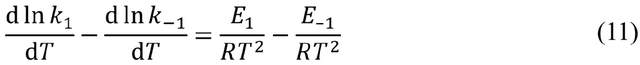
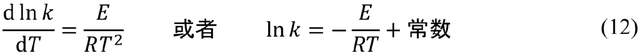
阿倫尼烏斯早年求學於瑞典烏普薩拉大學和斯德哥爾摩大學,在博士論文中提出了電解質水溶液的電離學説。這項離經叛道的理論使阿倫尼烏斯在答辯中只拿到三等成績(Cum Laude),險些沒能通過學位答辯。論文公開發表後也遭到了尖鋭的批評(電離理論的反對者中不乏像門捷列夫(D. I. Mendeleyev)這樣的著名化學家)。但是阿倫尼烏斯沒有放棄自己的理論,而是將論文寄給奧斯特瓦爾德、範特霍夫等人,併成功地得到他們的賞識。奧斯特瓦爾德甚至不遠千里趕赴瑞典,與阿倫尼烏斯當面討論電離學説,並邀請阿倫尼烏斯到他就職的里加工業大學任教。得益於“國際”學術界的支持,阿倫尼烏斯在1884年底取得了烏普薩拉大學物理化學副教授的職位。此後的近十年中,阿倫尼烏斯到歐洲各處遊學。1885年前後,他在阿姆斯特丹與範特霍夫開展了短暫的合作研究,阿倫尼烏斯將源自電離理論的思想應用於化學反應,在1889年提出了“活化能(Ea)”的概念,使阿倫尼烏斯公式最終定形為
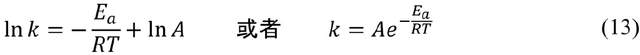
像食鹽那樣在熔融狀態和水溶液中能導電的物質就是電解質。自法拉第(M. Faraday)以來的化學家們對電解質溶液導電的解釋,是外加電流使鹽水中的“氯化鈉分子”分解,產生帶正電荷的鈉離子和帶負電荷的氯離子,分別向陰極和陽極移動,這也是“電解(electrolysis)”一詞的原義。阿倫尼烏斯仔細研究電解質溶液的電導率後提出:氯化鈉的分解不是通電造成的結果,而是在其溶於水時就已完全進行(無法理解電解質電離過程中正負電荷分離的自發性,是學位評審教授們給阿倫尼烏斯“差評”的主要原因)。對於像醋酸這樣的弱電解質,阿倫尼烏斯認為只有一小部分“活化”醋酸分子發生了電離(釋放氫離子和醋酸陰離子),對溶液導電產生貢獻。阿倫尼烏斯用相同的思路看待化學動力學問題。以蔗糖的水解反應為例,根據統計力學,在給定温度下大量蔗糖分子的運動速度並不相同,且遵守麥克斯韋-玻爾茲曼分佈。(13)式中的指數項exp(–Ea/RT)具有玻爾茲曼因子的數學形式,它代表着温度為T時能量高於Ea的蔗糖分子的比例。阿倫尼烏斯認為只有這部分“活化”蔗糖分子才能發生反應。活化蔗糖與普通蔗糖通過碰撞交換能量,處於動態平衡中。當温度升高時,活化蔗糖的比例顯著上升,水解反應的速率也隨之加快。Ea作為活化蔗糖所應具有的最低能量閾值,活化能是十分貼切的名稱。(13)式中的指前因子A則代表當Ea = 0時(所有蔗糖分子都處於活化狀態),水解反應的極限速率常數。

經過範特霍夫和阿倫尼烏斯的抽絲剝繭,果真在速率常數k和温度T之間找到了一種簡明、且有物理圖像支撐的數學關係。儘管對指前因子A和活化能Ea必須與温度無關的要求有些生硬,也與不少實驗結果不符,但是阿倫尼烏斯公式仍然受到物理化學家的喜愛。範特霍夫的《化學動力學研究》出版五十年後,英國曼徹斯特大學的波拉尼(M. Polanyi)和美國普林斯頓大學的艾林(H. Eyring)提出了著名的“過渡態理論”(又名活化絡合物理論、絕對速率理論),在勢能面概念的基礎上,從分子配分函數出發,導出了基元反應速率常數的表達式(艾林公式)。艾林公式的數學形式與阿倫尼烏斯公式十分相似。其玻爾茲曼因子exp(–E0/RT)中的能量E0被解讀為過渡態結構與反應物的勢能之差。“ln k與–1/T線性相關”這個宏觀實驗現象最終在分子結構的微觀層面找到了理論依據。
多年曆練之下,範特霍夫和阿倫尼烏斯從不被權威認可的年輕人逐漸成長為受人尊敬的資深科學家。特別是阿倫尼烏斯,他不僅擔任了斯德哥爾摩大學教授和校長,而且深度參與了諾貝爾(A. Nobel)遺囑的執行和諾貝爾獎的提名及評選工作。1901年範特霍夫由於對滲透壓和化學平衡理論的貢獻獲得了第一屆諾貝爾化學獎。阿倫尼烏斯本人也因為提出電離理論在1903年獲得諾貝爾化學獎。雖然質疑阿倫尼烏斯將諾貝爾獎公器私用、私相授受,甚至阻撓論敵獲獎的批評聲始終存在(可能的受害者包括門捷列夫、德國人能斯特(W. H. Nernst)等人),但是範特霍夫和阿倫尼烏斯參與創立物理化學學科,特別是發展化學動力學理論的功績不會被後人忘記。
未完待續
在化學動力學的發展歷史上,定義反應速率常數k和確立阿倫尼烏斯公式,只能算作萬里長征走完了第一步。如何在複雜的有機分子性質和反應動力學行為之間建立定量構效關係,是後輩物理有機化學家孜孜以求的目標,更是引領有機合成化學邁進大數據與人工智能時代的出色嚮導……
致謝
作者感謝中國科學院上海有機化學研究所遊書力院士、黎佔亭研究員、中國科學院物理研究所曹則賢研究員、中國科學院大連化學物理研究所田文明研究員、美國範德比爾特大學楊中悦教授對本文的寶貴意見。
作者簡介
鄭超博士,中國科學院上海有機化學研究所研究員,國家自然科學基金委員會優秀青年科學基金項目獲得者。研究方向為物理有機化學與手性合成。
參考文獻
[1] E. A. Guggenheim, J. Chem. Educ. 1956, 33, 544.
[2] E. Farber, Chymia 1961, 7, 135.
[3] E. W. Lund, J. Chem. Educ. 1965, 42, 548.
[4] P. W. Andersen, Science 1972, 177, 393.
[5] J. Shorter, J. Chem. Educ. 1980, 57, 411.
[6] M. C. King, Ambix 1981, 28(2), 70.
[7] M. C. King, Ambix 1982, 29(1), 49.
[8] K. J. Laidler, J. Chem. Educ. 1984, 61, 494.
[9] K. J. Laidler, Arch. Rational Mech. 1985, 32, 43
[10] M. H. Abraham, J. Phys. Org. Chem. 1994, 7, 655.
[11] X.-K. Jiang, Acc. Chem. Res. 1997, 30, 283.
[12] F. Dyson, Nature 2004, 427, 297.
[13] J. Quílez, Bull. Hist. Chem. 2006, 31, 45.
[14] G. Nagendrappa, Resonance 2007, 12(5), 21.
[15] J. Mayer, K. Khairy, J. Howard, Am. J. Phys. 2010, 78, 648.
[16] J. Quílez, Found. Chem. 2019, 21, 221.
[17] J. Quílez, Found. Chem. 2021, 23, 85.
[18] B. J. Shields, J. Stevens, J. Li, M. Parasram, F. Damani, J. I. M. Alvarado, J. M. Janey, R. P. Adams, A. G. Doyle, Nature 2021, 590, 89.
[19] E. Callaway, Nature 2022, 608, 15.
[20] M. H. Back, K. J. Laidler, Ed. Selected Readings in Chemical Kinetics. Pergamon Press, 1967.
[21] P. Coffey, Cathedrals of Science: The Personalities and Rivalries That Made Modern Chemistry. Oxford Academy Press, 2008.
[22] T. Hey, S. Tansley, K. Tolle, Eds. The Fourth Paradigm: Data Intensive Scientific Discovery. Microsoft Research, 2009.
[23] N. E. Henriksen, F. Y. Hansen, Theories of Molecular Reaction Dynamics, The Microscopic Foundation of Chemical Kinetics, 2nd Ed. Oxford University Press, 2019.
[24] H. Westheimer, A Biographical Memoir of Louis Plack Hammett, National Academy Press, 1997.
[25] 格雷戈裏·D·沃爾科特、江曉源主編,《A Source Book in Chemistry,科學元典—化學》,華文出版社,2022年。
[26] 陳敏伯,《科學通報》,2016年,第79卷第3期,196頁。
[27] 趙凱華著,《定性與半定量物理學》(第二版),高等教育出版社,2008年。
[28] Ю. И. 索洛維耶夫、H. A. 菲古羅夫斯基著,丁由譯,《阿累尼烏斯傳:生平與活動》,商務印書館,1965年。
[29] 黎佔亭著,《二十世紀中國著名科學家書系——蔣錫夔》,金城出版社,2008年。

1. 進入『返樸』微信公眾號底部菜單“精品專欄“,可查閲不同主題系列科普文章。
2. 『返樸』提供按月檢索文章功能。關注公眾號,回覆四位數組成的年份+月份,如“1903”,可獲取2019年3月的文章索引,以此類推。
版權説明:歡迎個人轉發,任何形式的媒體或機構未經授權,不得轉載和摘編。轉載授權請在「返樸」微信公眾號內聯繫後台。