40天恢復肝臟銅穩態,人類有望獲益!_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯1小时前

自打工作以來,大家有沒有覺得時間好像被格式化了,為了能在繁忙之餘找點樂子,白天努力搬磚,晚上努力傷肝,肝不硬,都不好意思説自己是個合格的熬夜選手。但年輕的肝臟能經得住一時的磋磨,老化的肝臟卻狠狠表示:真“肝不動”了……

那麼,除了老生常談的熬夜,肝臟變老的誘因還有什麼呢?或許最近這篇刊登在Nature子刊《Nature Communications》上的研究能為大家解解惑。派派吃驚直呼:老朋友銅元素竟與肝臟老化關係匪淺[1]!經常糾結要不要補點銅?看完這篇也許你就悟了!

銅是一種廣泛分佈在人體各組織和器官中的微量元素,成人體內銅含量約為1.5-2.0 mg/kg,以肝臟和大腦中濃度最高。正常水平的銅對機體具有多種健康益處,如促進造血功能、維護神經系統和促進毛髮健康等。然而,一旦銅水平失衡(過量或缺乏)則可能對機體健康有害。
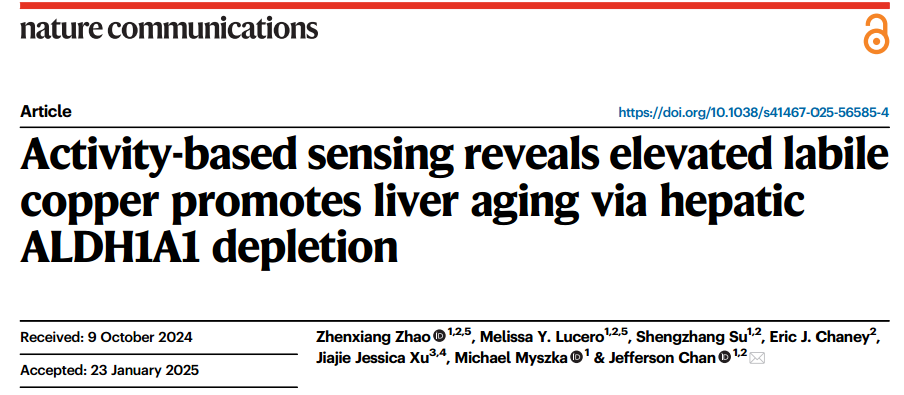
在體內,銅大部分時間與銅藍蛋白(血漿中銅的主要結合蛋白)或其他酶結合,被運輸到需要的細胞中或作為酶的輔助因子,調節酶的活性,這些結合態的銅通常沒有活性。但不是所有的銅都會被抓過去“鎖定”,在細胞內,還有一些能自由移動和參與化學反應的銅,它們就是——活性銅。
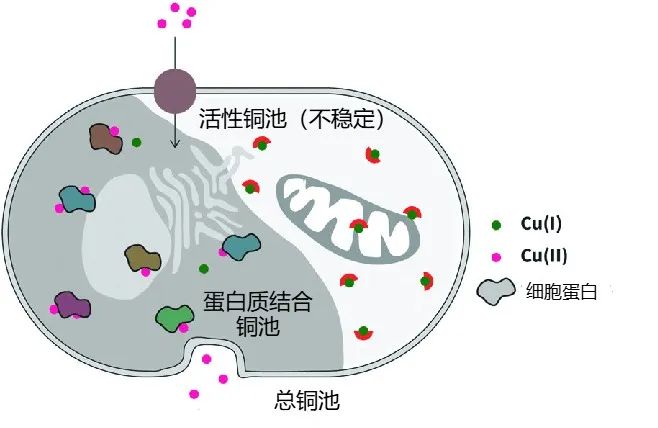
圖注:細胞內銅由兩個不同的池組成:緊密結合的蛋白質池和不穩定的生物可利用銅池[2]
活性銅常以一價銅離子Cu(I)或二價銅離子Cu(II)的形式存在於細胞內,它們與多種生物分子(如蛋白質、酶、DNA等)相互作用,共同維持着細胞的生理功能。然而,當細胞內活性銅水平失衡時,它們便可能從維持細胞功能的“助手”轉變為引發氧化應激的“隱患”,進而加速細胞衰老。
以最容易產生活性氧(ROS)的Cu(I)來講,一方面,Cu(I)會通過芬頓反應產生羥基自由基等活性氧,這些自由基會攻擊細胞的膜結構、蛋白質和DNA,導致細胞損傷。
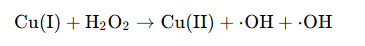
圖注:這裏的芬頓反應指在酸性條件下,Cu(I)催化過氧化氫分解生成了羥基自由基(·OH)
另一方面,細胞原本委以重任的“抗氧化衞士”——谷胱甘肽(GSH),肩負着結合Cu(I)的使命,以限制其活性並防止過量積累。但細胞內的GSH畢竟有限,與過量的Cu(I)反應使GSH嚴重損耗,細胞的抗氧化防線逐漸崩潰,進一步加劇了氧化應激和細胞衰老。

除了GSH,細胞也利用銅轉運蛋白、金屬硫蛋白(能結合和釋放銅,緩衝活性銅的水平)等機制來嚴格調控銅的水平。但天有不測風雲,誘使Cu(I)“失控”的角色可太多了,年齡,就是其一。

為了搞清楚年齡對活性銅的影響,研究者打算以含銅濃度高的肝臟作為研究對象,重點觀察Cu(I)在肝臟衰老過程中的表現。但是要精準追蹤Cu(I),還缺一個趁手武器。
為此,研究人員專門開發了一個銅活性探針(LCP-PA)。該探針可利用光聲成像技術(將光信號轉變為超聲信號,提供比熒光成像更清晰的三維圖像),特異性地檢測體內環境中Cu(I)的活性變化,特別適合用來研究Cu(I)與氧化應激和衰老相關的過程。
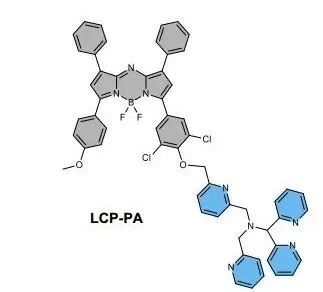
圖注:用於檢測銅離子活性的銅活性探針LCP-PA結構
在LCP-PA探針的幫助下,很快就出現了令人振奮的結果:
No.1
年齡增長,肝臟中的活性銅更“strong”了
研究人員把實驗小鼠分為了四個年齡組:年輕組(約7周齡)、成年組(約13周齡)、中年組(約42周齡)和老年組(約82周齡),並使用 LCP-PA 探針進行了光聲成像。
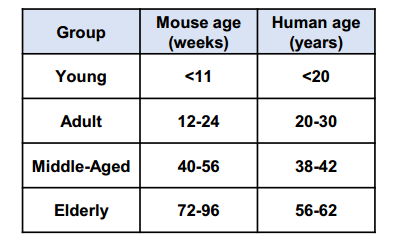
圖注:實驗小鼠各年齡組分佈及對應的人類年齡
結果顯示,LCP-PA的激活程度(反映Cu(I)的濃度和活性,以及氧化應激水平)隨年齡增長而增加,年輕組激活程度最低,老年組激活程度最高。具體來講,與對照年輕組小鼠肝臟中LCP-PA探針激活後的信號強度相比,實驗中各年齡組的激活程度分別為1.06倍、1.14倍、1.29倍和1.50倍。
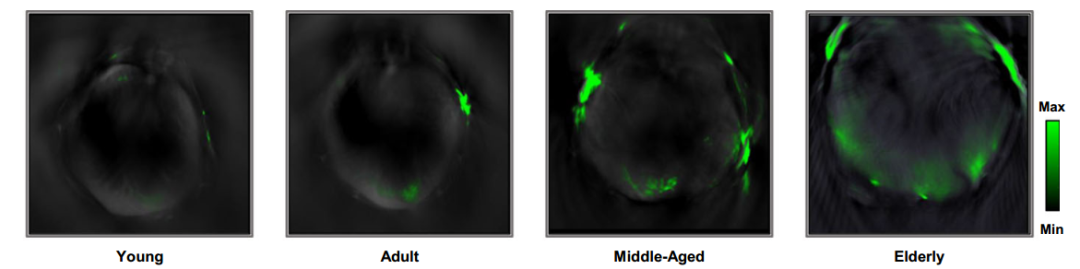
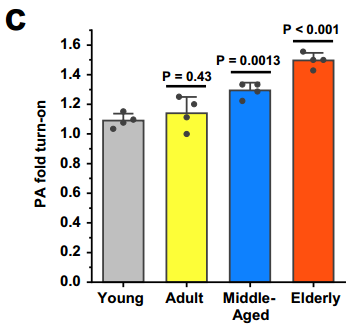
圖注:LCP-PA在各年齡組小鼠肝臟中的激活程度
不得不説,肝臟衰老防不勝防,一不小心,Cu(I)就要蠢蠢欲動了。。。
No.2
谷胱甘肽:年齡克我!
如前所述,谷胱甘肽(GSH)能與Cu(I)結合,防止其引發氧化應激。為了驗證此説法,研究人員利用熒光探針LCP-Green-4(用於體外細胞內銅離子成像,與Cu(I)結合時熒光增強)對人類肝癌細胞系HepG2進行了觀察:
結果顯示,用谷胱甘肽乙酯(能增加細胞內GSH水平)處理的細胞熒光強度比未處理的細胞降低了40%,這是由於更多的GSH結合了細胞內的Cu(I),導致探針檢測到的活性Cu(I)減少所致。相比之下,NEM(一種廣譜硫醇清除劑,能降低GSH水平)處理的細胞熒光強度增加了10%,表明Cu(I)的濃度提高了。
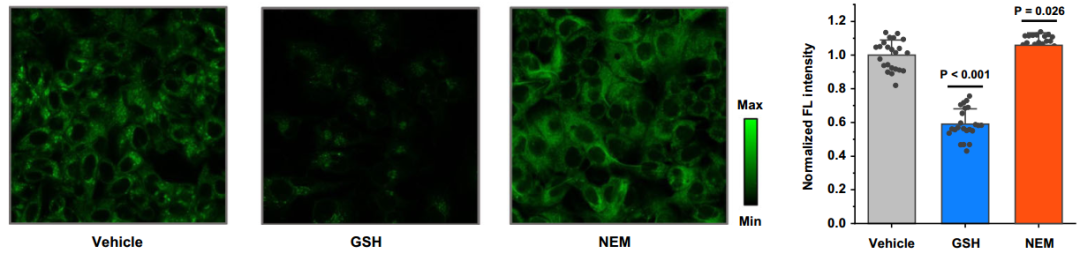
圖注:肝細胞中Cu(I)與谷胱甘肽之間的潛在關係
前面發現衰老會讓肝臟中Cu(I)活性變強,而現在來看GSH與Cu(I)顯然是此消彼長的關係,那隨年齡增長,GSH豈不是危矣?

確實如此!研究人員用LCP-PA 和 PACDx(表徵細胞內GSH活性)兩種探針對四個年齡組的小鼠進行體內光聲成像後發現,PACDx的激活程度與銅活性呈負相關,即在年輕組中最高,在老年組中最低,表明GSH活性隨着衰老降低了。
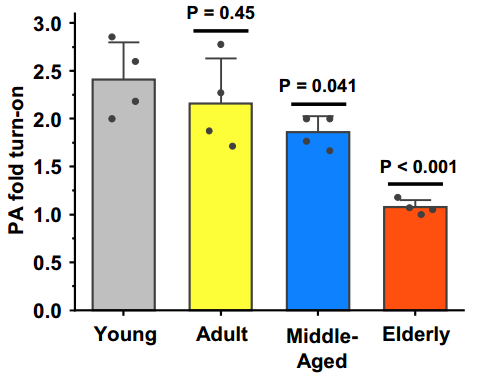
圖注:肝細胞中GSH活性隨着衰老而降低
好傢伙!年齡一上來,先是助長氧化應激“幫兇”Cu(I)的氣焰,現在又讓細胞抗氧化“能臣”谷胱甘肽熄火,事情好像都走向了不利的方向。
No.3
ALDH1A1酶:跟着玩完!
還沒完!隨着肝細胞內Cu(I)活性的增加,谷胱甘肽(GSH)活性的降低,肝細胞內氧化應激情況也出現了明顯的惡化:
研究者發現,GSH活性的降低會使HepG2細胞內的ROS的“產量”明顯增加。
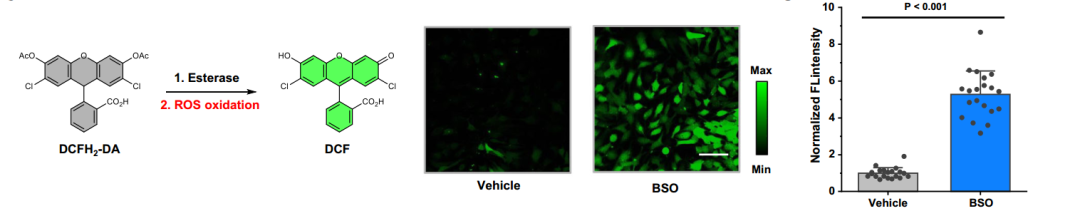
圖注:GSH活性降低會使肝細胞內ROS的水平顯著提高(BSO試劑用來降低GSH的活性;DCFH-DA,用來指示ROS產生的程度)
不僅如此,作為細胞保護酶和肝幹細胞通用標記物的醛脱氫酶1A1(ALDH1A1)也受到了波及。
研究發現,向HepG2細胞補充CuCl₂(用於增加細胞內活性銅離子)後,ALDH1A1酶活性顯著降低(由其專屬探針熒光強度指示,強度越低酶活性越低),進一步表明Cu(I)的增加可能消耗了GSH,導致ALDH1A1活性出現下降。
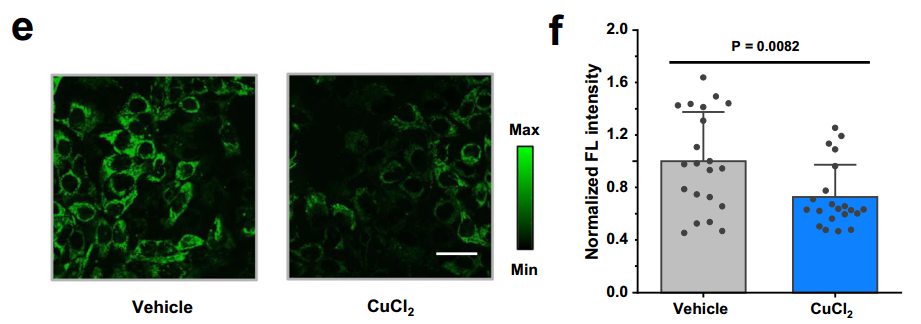
圖注:活性銅會消耗GSH,進而引起ALDH1A1活性降低
此外,研究還發現,老年小鼠肝臟樣本(包含多種不同類型的肝細胞)中ALDH1A1的水平比年輕小鼠樣本低79%,同樣説明年齡增長造成ALDH1A1活性下降以及肝幹細胞特性可能丟失的情況。
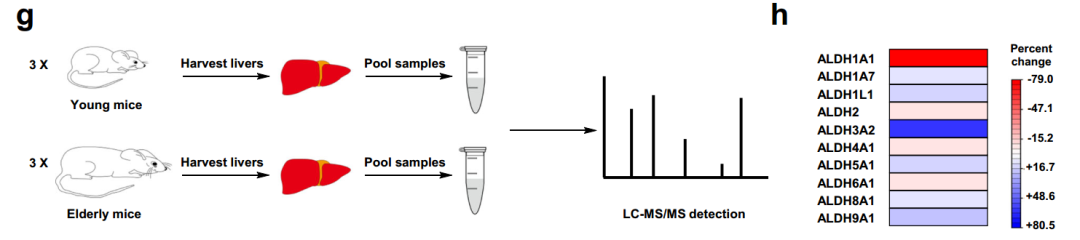
圖注:質譜分析顯示,老年小鼠肝臟樣本中ALDH1A1的水平比年輕小鼠低79%
ALDH1A1酶在多種細胞類型中表達,參與解毒反應,保護細胞免受氧化應激和化學損傷。然而,當Cu(I)活性增加使其功能受到抑制時,肝細胞損傷會加劇,肝臟解毒能力被削弱,後果就是肝臟加速老化。

所以,銅穩態失調可能是肝臟衰老的一個重要原因。那有沒有辦法對付這些超量的“銅”,還肝臟一個“清淨”呢?
受威爾遜病(一種銅代謝障礙疾病)的啓發,研究者迅速聯想到使用銅螯合劑。這類化合物能夠特異性結合銅離子並形成穩定的複合物,從而促進體內過量銅的排出。本研究中選用的ATN-224,因其高親和力、良好安全性和臨牀應用潛力而脱穎而出。
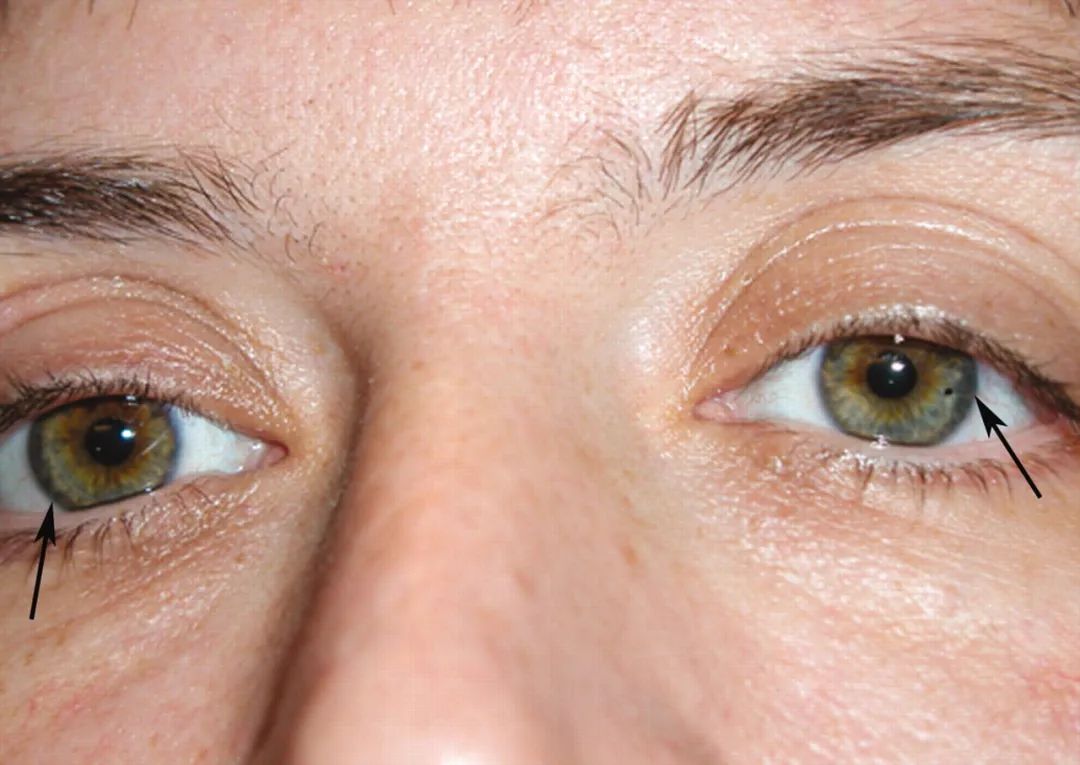
圖注:銅在角膜後彈力層沉積,形成特徵性的角膜K-F環,是威爾遜病的典型體徵之一
研究發現,在60天內,中年小鼠每日經口服灌胃接受ATN-224治療,其肝臟Cu(I)水平在****第40天便恢復至與年輕小鼠相當,而對照組小鼠的Cu(I)水平在整個研究期間持續上升。
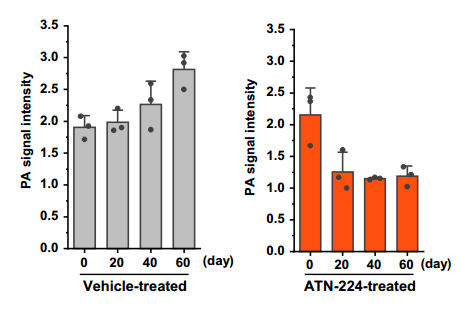
圖注:ATN-224治療降低了活性銅水平
此外,在60天的ATN-224治療中,中年小鼠體內ALDH1A1水平比對照組也有提高。在更接近臨牀的治療方案(140天,初期每日給藥,後續每三天一次)下,治療組小鼠ALDH1A1水平提升35%,且肝臟氧化應激顯著降低。
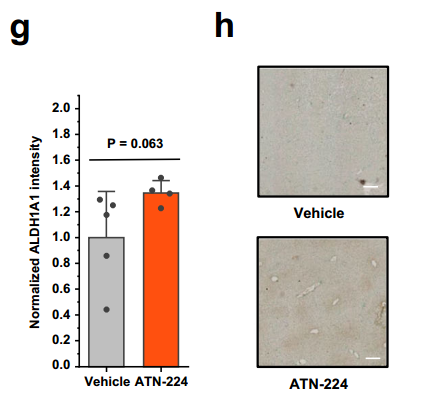
圖注:ATN-224治療使ALDH1A1水平提升,蛋白表達顯著增加
由此看來,銅螯合治療不僅能幫助我們調節銅的穩態,還能增加“有益酶”ALDH1A1的水平,從而減少額外Cu(I)引起的氧化應激損傷,避免肝臟提前衰老!
據派派查探,ATN-224目前正處於臨牀試驗階段。在等待它真正落地的同時,這裏也給大家整理了一些其他改善策略:
高銅風險人羣,注意減少體內銅
除了年齡增長可能導致體內活性銅的增加外,現實生活中還有許多其他因素可能導致某些人羣出現銅水平過量的情況。一旦獲悉自己有高銅風險了,我們可以這麼做:
**鋅劑治療。鋅可以抑制銅的吸收。**在銅代謝紊亂的治療中,鋅劑常被用作輔助治療手段,幫助減少體內銅的積累。


圖注:鋅可以抑制銅的吸收(左);牡蠣香是真的,高含銅量也是真的(右)
此外,避免高銅食物(如牡蠣、貝類、堅果、巧克力、肝臟等)、使用不含銅的烹飪器具或避免飲用含銅的水(如銅製管道中的水),這些小行動也能幫助我們潛移默化地減輕肝臟中銅的積累。
日常加強,細胞抗氧化能力
許多抗氧化補劑能增強細胞的抗氧化能力,如輔酶Q10、α-硫辛酸、谷胱甘肽前體(如N-乙酰半胱氨酸,NAC)等,這些補劑已被證明能減輕氧化應激水平。對特定疾病患者,健康人,以及那些希望通過補充抗氧化劑來預防氧化應激相關疾病或延緩衰老的人羣尤為適宜。

圖注:Q10也可能包含在我們的飲食中
當然,還可以攝入一些富含維生素C、維生素E、硒等抗氧化劑的食物,如柑橘類水果、堅果和綠葉蔬菜等。這些抗氧化劑食物也可以幫助中和活性氧,減輕機體氧化應激水平。
(對這些抗氧化補劑感興趣?點擊下方卡片,關注時光派後台回覆 抗氧化**,就能獲取相關資源查看啦!)**
根據需要,進行銅水平檢測
需要強調的是,作為人體必需微量元素,銅的過量或不足都可能引起健康麻煩。補充銅還是控制攝入,關鍵在於身體的實際需求。

圖注:定期檢測,健不健康早預防
定期檢測能有效監測血清和肝臟中的銅水平、銅藍蛋白水平,以及氧化應激標誌物(如丙二醛、8-羥基脱氧鳥苷等)水平,從而及時發現銅穩態失調的跡象。
因人體具有較為完善的銅代謝調節機制,健康個體銅過量或不足的情況其實很少發生。但對有銅代謝疾病家族史、老年人或已出現相關症狀的人羣來説,這些檢測就顯得比較重要了。
已有大量研究表明,肝臟衰老,會導致全身器官都跟着擺爛,就像多米諾骨牌一樣,一肝衰而全身哀。本研究從銅元素的角度,倒是給了我們一個改善肝臟健康,延緩衰老的新思路——調節銅穩態。

如果把肝臟健康事業比作一座大山,調節銅穩態的策略無疑是新開闢的光明小徑,到達山頂的路雖然艱辛,但每一步都充滿了希望。説不定這條小徑能引領我們突破傳統治療的侷限,為肝臟健康開闢新的天地!
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Zhao, Z., Lucero, M. Y., Su, S., Chaney, E. J., Xu, J. J., Myszka, M., & Chan, J. (2025). Activity-based sensing reveals elevated labile copper promotes liver aging via hepatic ALDH1A1 depletion. Nature Communications, 16(1), 1794.
[2] Shen, C., & New, E. J. (2015). What has fluorescent sensing told us about copper and brain malfunction?. Metallomics, 7(1), 56-65.