認知改善84.62%!44歲是大腦抗衰黃金期,確定不來點“脂肪”拯救宕機大腦?_風聞
时光派-时光派官方账号-聚集全球前沿、全面、专业抗衰资讯38分钟前

抗衰這事,你是從什麼時候開始的?有人從25歲開始往臉上扎針,有人35歲就已經恨不得把各類補劑當飯吃。但一提到“保養”大腦……大家好像都有點懵圈,有人30歲就開始緊張兮兮地練起數獨預防老年痴呆,有人50歲還自信自己的記性堪比備忘錄。
所以,大腦抗衰,有沒有什麼“黃金時間”?
有的!近期,來自紐約州立大學的研究人員在《PNAS》上揭秘了有關大腦衰老的真相:44歲開始加速走下坡路,67歲達到最快衰老速度,90歲趨於平穩。不過,在40-59歲之間的“關鍵窗口期”進行酮代謝干預,也許能逆轉大腦衰老**?**


有關大腦衰老這件事,學術界一直爭論不休,有的專家認為,認知衰退的主因是神經元數量的減少[2],而另一派人則覺得,比起神經元數量的減少,神經元功能的退化(例如突觸連接效率降低、神經遞質系統失調等)或許才是關鍵所在[3]。
“公説公有理,婆説婆有理”,到底誰對誰錯?分析完1.9萬人的腦成像數據後,作者給出了一個更為“出格”的見解:可能還與葡萄糖代謝有關!
神經元的問題還沒解決,葡萄糖怎麼又摻一腳……不過先看看本次的研究結果:隨着年紀增長,大腦功能網絡的穩定性存在3個關鍵節點。
α階段(圖中藍色α點,約43.7歲):腦網絡穩定性開始出現明顯下降;
I階段(圖中黃色I點,約66.7歲):穩定性加速惡化;
β階段(圖中紅色β1點,約89.7歲):穩定性定格,進入所謂的“平台期”。
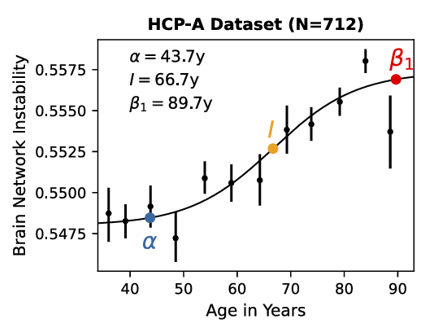
圖注:隨着歲數增長,大腦認知情況出現S型下滑(圖中縱座標為不穩定性,所以是呈向上趨勢)
在認知下滑的過程中,科學家們還有意外發現,外周血代謝標誌物HbA1c(與糖代謝相關)在α點附近飆升,同時開始出現血管變化(收縮壓升高)。
等到了I點後,不僅代謝問題依然存在,血管健康問題還變得更為明顯。反倒是代表炎症的C反應蛋白,在整個研究期間沒有顯著變化。
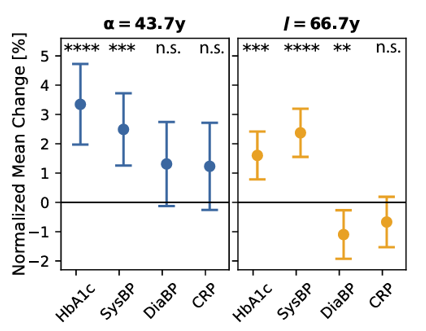
圖注:炎症可能不是早期大腦網絡不穩定的驅動因素
……看起來相比“看不見摸不着”的神經細胞與膠質細胞,或許大腦老化與代謝、血管的關聯更為強烈?不過還不能妄下定論,看看基因表達分析怎麼説。
選取了一批與能量代謝、血管和炎症機制相關的基因(包括葡萄糖轉運蛋白GLUT1、GLUT3、GLUT4、酮/乳酸轉運蛋白MCT1、MCT2和脂質轉運蛋白APOE)後,科學家們對其與大腦衰老之間進行了相關性分析。用不同顏色的“瓷磚”展示了這些基因與大腦衰老之間的關係。
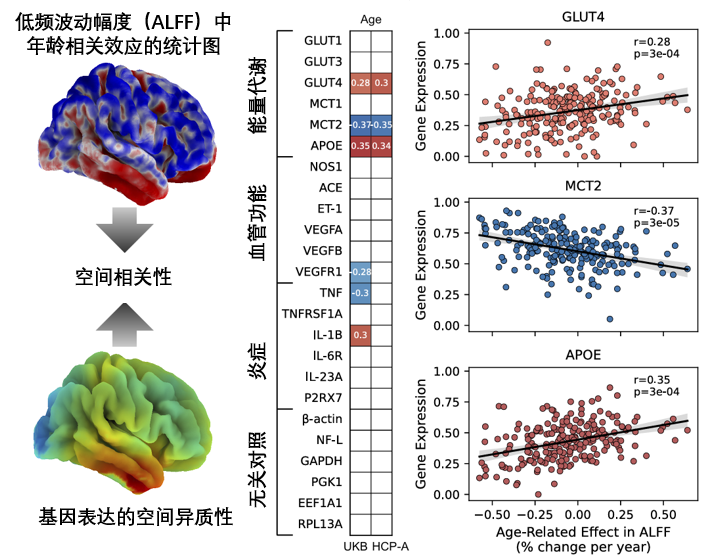
圖注:與能量代謝相關的三個基因(GLUT4、MCT2和APOE)顯示出與大腦衰老有顯著的相關性
觀察“彩色瓷磚”,科學家們發現,GLUT4(與胰島素抵抗相關)基因和APOE基因(涉及脂質轉運,其ε4等位基因還會增加阿爾茨海默病的風險)的表達均出現異常,表現出與大腦衰老的正相關性。
葡萄糖代謝與脂質轉運出現問題,也難怪大腦會因為缺能量宕機,不過嘛……問題不大,還有個表達量與大腦衰老效果呈負相關的基因:MCT2(神經元乳酸和酮體轉運蛋白),能在大腦缺少葡萄糖的時候,通過酮體代謝途徑,繼續為大腦提供能量。


而且基於前面的討論,作者還腦洞大開,提出了一個有關神經元代謝,是如何從“彎曲”到“斷裂”的假設性模型。解釋了為什麼大腦功能網絡的衰退是S型的,以及為什麼大腦能通過酮體代謝獲取能量,模型共分為三階段:
(生酮飲食與大腦之間,派派還有好多內容能説!不過篇幅緣故沒法詳解,要不來點點下方的小卡片,後台回覆關鍵詞 大腦 看看生酮飲食是如何能影響到大腦的吧!)
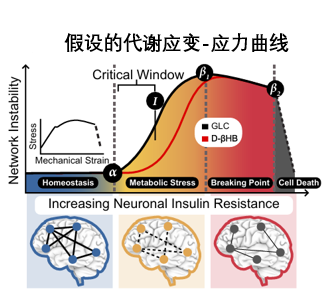
圖注:作者假設的神經元代謝模型
No.1
穩態 (Homeostasis)
早期階段,神經元能夠有效地利用葡萄糖作為能量來源,維持正常的細胞功能。
No.2
代謝壓力 (Metabolic Stress)——彎曲(Bending)
而隨着年齡增長,神經元會逐漸產生胰島素抵抗,導致胰島素介導的葡萄糖攝取、代謝及信號傳導效率下降,神經元開始出現能量供應不足與功能紊亂的現象,不過尚未達到不可逆的損傷程度,可以通過及時的代謝干預來恢復神經元功能,穩定大腦網絡。
如何幹預?沒錯,就是神經元另闢蹊徑,尋找到的其他能量來源……酮體。
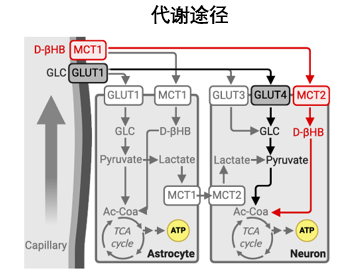
圖注:大腦能量代謝途徑
這裏的重點是紅色這條線——BHB途徑,作為主要的酮體之一,BHB(β-羥基丁酸)進入神經元時,並不經過葡萄糖轉運蛋白GLUT家族。特別是在胰島素抵抗的情況下,BHB能通過MCT2轉運蛋白進入神經元,參與酮體代謝,給中年大腦提供“後備隱藏能源”。
光説不“練”假把式,為了看看酮體干預是不是真的能救回神經元,科學家們也招募了101名年齡在21至79歲的健康成年人作為受試者(每位參與者給予 395mg/kg 的BHB與葡萄糖對照)並對其進行代謝干預。
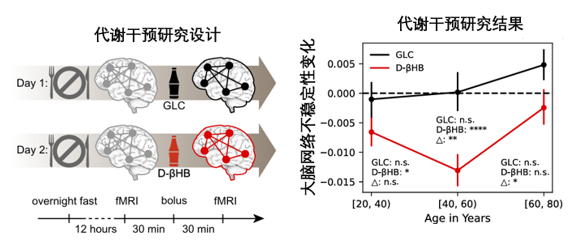
圖注:在窗口期(40-60歲)進行酮體干預,能顯著逆轉大腦老化跡象
結果表明,葡萄糖顯然……毫無效果,不過,BHB 卻穩定了 20 至 39 歲和 40 至 59 歲年齡組的大腦網絡,特別是在40-59歲之間,其效果猛增84.62%!出現顯著逆轉大腦老化的跡象。
No.3
斷裂 (Breaking Point)——細胞死亡 (Cell Death)
如果不干預呢?結果顯而易見:神經元最終會因能量嚴重短缺而發生不可逆的損傷,細胞死亡、大腦網絡解體,認知功能下降、引發神經退行性疾病。什麼?這時候再補酮體?抱歉,太晚了!
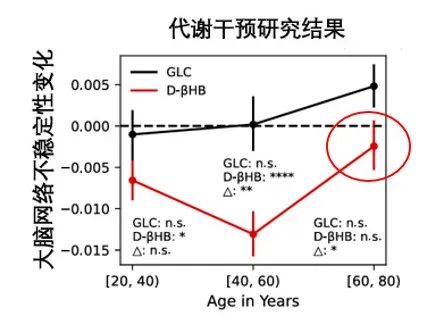
圖注:過了窗口期再補充酮體無法影響大腦網絡穩定性

所以,面對如此關鍵的黃金時期(40-60歲),想延緩大腦衰老,預防認知功能下降,有啥法子呢?作者也支了幾招:
1、間歇性斷食/生酮飲食
2、酮補充劑
間歇性斷食/生酮飲食放到一起來説,前者能通過週期性的飢餓狀態誘導代謝轉換,促使肝臟生成酮體,替代葡萄糖,成為大腦的能量來源[4],而生酮飲食則是通過高脂肪、極低碳水化合物攝入(碳水化合物<10%),誘導身體持續性酮症,為大腦提供新的能量來源[5]。
而對於酮補充劑,咱們可以把它分成兩大類:酮鹽和酮酯。
酮鹽是BHB(β-羥基丁酸)的鹽形式,包括飲品、粉末和膠囊等[6]。**它易被人體吸收,可以幫你繞過傳統生酮飲食的限制,快速提升血液酮水平,直接提供代謝燃料。**而且它的成本低,適合初次嘗試者(不過注意,用量過大可能會引起消化不適)。

圖注:飲品形式的BHB
如果想追求更高狀態,不妨試試與乙酸酯組合的BHB—酮酯,它更能增加和維持酮症狀態(比酮鹽高50%)[7]。不過酮酯通常價格較高,味道也比較強烈……也許會有不好的體驗。

圖注:三瓶高達117美刀……
當然,聊了這麼多關於生酮飲食/補劑的話題,派派還是想説:“生酮雖好,但也別輕易改變自己長時間養成的飲食習慣。”也有研究指出,長期堅持生酮飲食可能會增加男性糖尿病風險,還可能誘發非酒精性脂肪肝、心血管疾病等一系列慢性疾病[8]。
所以,本文的真正價值,還是在於提醒你,抗衰“黃金窗口”很重要,如果在中年時期就發現自己大腦對胰島素的抵抗在增加,可以及時進行針對性代謝干預,可以大大延緩你認知衰老的步伐。説不定退休後打麻將,你還能靠算牌能力讓老朋友們輸到懷疑人生!
聲明 - 本文內容僅用於科普知識分享與抗衰資訊傳遞,不構成對任何產品、技術或觀點的推薦、背書或功效證明。涉及健康、醫療、科技應用等相關內容僅供參考,醫療相關請尋求專業醫療機構並遵醫囑,本文不做任何醫療建議。如欲轉載本文,請與本公眾號聯繫授權與轉載規範。
參考文獻
[1] Antal, B. B., van Nieuwenhuizen, H., Chesebro, A. G., Strey, H. H., Jones, D. T., Clarke, K., Weistuch, C., Ratai, E. M., Dill, K. A., & Mujica-Parodi, L. R. (2025). Brain aging shows nonlinear transitions, suggesting a midlife “critical window” for metabolic intervention. Proceedings of the National Academy of Sciences of the United States of America, 122(10), e2416433122. https://doi.org/10.1073/pnas.2416433122
[2] Mora, S., & Allodi, I. (2023). Neural circuit and synaptic dysfunctions in ALS-FTD pathology. Frontiers in neural circuits, 17, 1208876. https://doi.org/10.3389/fncir.2023.1208876
[3] Hansen, R. T., 3rd, & Zhang, H. T. (2013). Senescent-induced dysregulation of cAMP/CREB signaling and correlations with cognitive decline. Brain research, 1516, 93–109. https://doi.org/10.1016/j.brainres.2013.04.033
[4] Koppold, D. A., Breinlinger, C., Hanslian, E., Kessler, C., Cramer, H., Khokhar, A. R., Peterson, C. M., Tinsley, G., Vernieri, C., Bloomer, R. J., Boschmann, M., Bragazzi, N. L., Brandhorst, S., Gabel, K., Goldhamer, A. C., Grajower, M. M., Harvie, M., Heilbronn, L., Horne, B. D., Karras, S. N., … Michalsen, A. (2024). International consensus on fasting terminology. Cell metabolism, 36(8), 1779–1794.e4. https://doi.org/10.1016/j.cmet.2024.06.013
[5] Jang, J., Kim, S. R., Lee, J. E., Lee, S., Son, H. J., Choe, W., Yoon, K. S., Kim, S. S., Yeo, E. J., & Kang, I. (2023). Molecular Mechanisms of Neuroprotection by Ketone Bodies and Ketogenic Diet in Cerebral Ischemia and Neurodegenerative Diseases. International journal of molecular sciences, 25(1), 124. https://doi.org/10.3390/ijms25010124
[6] Stubbs, B. J., Koutnik, A. P., Volek, J. S., & Newman, J. C. (2021). From bedside to battlefield: intersection of ketone body mechanisms in geroscience with military resilience. GeroScience, 43(3), 1071–1081. https://doi.org/10.1007/s11357-020-00277-y
[7] Dilliraj, L. N., Schiuma, G., Lara, D., Strazzabosco, G., Clement, J., Giovannini, P., Trapella, C., Narducci, M., & Rizzo, R. (2022). The Evolution of Ketosis: Potential Impact on Clinical Conditions. Nutrients, 14(17), 3613. https://doi.org/10.3390/nu14173613
[8] Crosby, L., Davis, B., Joshi, S., Jardine, M., Paul, J., Neola, M., & Barnard, N. D. (2021). Ketogenic Diets and Chronic Disease: Weighing the Benefits Against the Risks. Frontiers in nutrition, 8, 702802. https://doi.org/10.3389/fnut.2021.702802